ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 23.08.2024
Просмотров: 2266
Скачиваний: 1
СОДЕРЖАНИЕ
Основные понятия и законы химии Атомно - молекулярное учение.
Закон сохранения массы веществ
Составление химических уравнений
Расчеты по химическим уравнениям
Закон Авогадро и молярный объем газа
Основные классы неорганических
2. Разложение некоторых кислородсодержащих веществ (оснований, кислот, солей) при нагревании:
Графическое изображение формул
Химическое равновесие. Константа химического равновесия
Энергия Гиббса направленность химических процессов
Примеры термодинамических расчетов
Химическая кинетика. Скорость химической реакции
Молекулярность элементарных реакций
Смещение химического равновесия
3 Влияние температуры на положение равновесия
Основные характеристики растворов
Растворимость газов в жидкостях
Взаимная растворимость жидкостей
Растворимость твердых веществ в жидкостях
1. Давление насыщенного пара разбавленных растворов
2. Давление пара идеальных и реальных растворов
3. Температура кристаллизации разбавленных растворов
4. Температура кипения разбавленных растворов
5. Осмотическое давление разбавленных растворов
6. Понятие активности растворенного вещества
Слабые электролиты. Константа диссоциации
Количественные характеристики процесса гидролиза соли.
Направленность реакций в растворах электролитов
Протонная теория Брёнстеда-Лоури
Коррозия металлов и методы защиты металлов от коррозии
Волновое уравнение. Квантовомеханическое объяснение строения атома
Электронная структура атомов и периодическая система элементов
Структура периодической системы элементов д.И. Менделеева.
Периодичность свойств химических элементов и их соединений
Ковалентная связь. Метод валентных связей
Способы образования ковалентной связи
Гибридизация атомных орбиталей
Квантовомеханические теории строения комплексных соединений
2. Гибридизация орбиталей и структура комплексов
АВ![]() А++ В–
А++ В–
константа диссоциации выразится следующим соотношением:
К
=
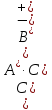 (8).
(8).
Для процесса диссоциации уксусной кислоты:
CH3COOH![]() H+
+ CH3COO–
H+
+ CH3COO–
K
=
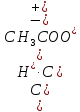
Многоосновные кислоты, а также основания многовалентных металлов диссоциируют ступенчато. Например:
H2CO3![]() H++HCO3–
H++HCO3–
HCO3–![]() H++CO32–
H++CO32–
Первое равновесие – диссоциация по первой ступени – характеризуется константой
KI
=
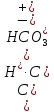
Для диссоциации по второй ступени:
KII
=
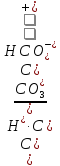
В случае угольной кислотыконстанты диссоциации имеют следующие значения: KI = 4,4∙10–7, KII = 4,7∙10–11. Для ступенчатой диссоциации всегда KI>KII>KIII>…, т.к. энергия, которую необходимо затратить для отрыва иона, минимальна при отрыве его от нейтральной молекулы.
Поскольку концентрация каждого иона для бинарного электролита равна произведению степени диссоциации α на общую концентрацию электролита С, выражение (13) в этом случае можно переписать следующим образом:
![]() (9)
(9)
Для разбавленных растворов можно считать, что (1 – α) = 1. Тогда получаем:
![]() (10)
(10)
![]() (11)
(11)
Т.о., степень диссоциации слабого электролита обратно пропорциональна концентрации и прямо пропорциональна разбавлению раствора; выражение (16) называют законом разбавления Оствальда. Степень диссоциации слабого электролита можно связать с изотоническим коэффициентом. Будем считать, что из N молекул электролита продиссоциировало n молекул, образовав νn ионов (ν – число ионов, на которое диссоциирует молекула). Поскольку изотонический коэффициент показывает, во сколько раз общее число молекул и ионов в растворе больше числа молекул до диссоциации, получаем:
![]() (12)
(12)
![]() (13)
(13)
Соотношение (13) дает возможность, экспериментально определив изотонический коэффициент раствора, рассчитать степень диссоциации слабого электролита.
В общем виде связь между коэффициентами і и определяется уравнениями
=
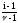 (14)
(14)
где – число ионов, образующих молекулу данного электролита. Так, для NaCl ν= 2, для Al2(SO4)3 ν = 5 и т. д.
Сильные электролиты
Предположение Аррениуса о том, что в растворе сильного электролита также существует динамическое равновесие между молекулами и ионами, как и у слабых электролитов, оказалось ошибочным. Экспериментальные исследования показали, что, во-первых, величина константы диссоциации сильного электролита зависит от концентрации (т.е. к растворам сильных электролитов неприменим закон действующих масс) и, во-вторых, никакими методами не удалось обнаружить в растворах сильных электролитов непродиссоциировавшие молекулы. Это позволило Н. Бьеррумусделать вывод, что сильные электролиты в растворах любых концентраций полностью диссоциируют на ионы и, следовательно, закономерности, полученные для слабых электролитов, не могут применяться к сильным электролитам без соответствующих поправок.
Качественная теория сильных электролитов была разработана П. Дебаем и Г. Хюккелем (1923). Для сильных электролитов, полностью диссоциирующих на ионы, даже при малых концентрациях растворов энергия электростатического взаимодействия между ионами достаточно велика, и пренебречь этим взаимодействием нельзя. Взаимодействие противоположно и одноименно заряженных ионов (соответственно притяжение и отталкивание) приводит к тому, что вблизи каждого иона находятся преимущественно ионы с противоположным зарядом, образующие т.н. ионную атмосферу. Радиус ионной атмосферы сравнительно велик, поэтому ионные атмосферы соседних ионов пересекаются; кроме того, каждый ион окружен дипольными молекулами растворителя – сольватной оболочкой. Т.о., в растворе сильного электролита возникает подобие пространственной структуры, что ограничивает свободу перемещения ионов и приводит к изменению свойств раствора в том же направлении, как действовало бы уменьшение степени диссоциации. Поэтому, определяя степень диссоциации раствора сильного электролита, получают т.н. кажущуюся степень диссоциации, т.е. величину α с поправкой на межионное взаимодействие. Чем выше концентрация раствора, тем сильнее взаимодействие ионов, тем меньше и кажущаяся степень диссоциации сильного электролита.
Количественные расчеты характеристик растворов сильных электролитов осуществляют с помощью понятий активности электролита аэ и активностей катионов и анионов а+ и а- соответственно, которые равны произведению коэффициента активности на концентрацию:
![]() ;
;
![]() ;
;![]() (15)
(15)
Для бинарного электролита средняя активность электролита связана с активностями ионов соотношением (16); подобным же образом связан средний коэффициент активности с ионными (17):
![]() (16)
(16)
![]() (17)
(17)
Дебаем и Хюккелем был разработан метод расчета среднего коэффициента активности сильного электролита. Для бинарного электролита уравнение имеет следующий вид:
![]() (18)
(18)
Здесь z – заряд иона, для которого рассчитывается коэффициент активности, I – т.н. ионная сила раствора: некоторый параметр, который одновременно учитывает молярную концентрацию и заряд всех имеющихся в растворе ионов. Ионная сила раствора равна полусумме концентраций всех ионов, умноженных на квадрат их заряда:
![]() (19)
(19)
Теория Дебая – Хюккеля применима только при концентрациях, не превышающих 0.05 моль/л. Для более концентрированных растворов сильных электролитов количественной теории не существует.
PН растворов
Жидкие протонсодержащие растворители вступают в обратимую реакцию самоионизации. Например, для воды:
H2O
+ H2O
![]() OH--
+ H3O+
или упрощенно H2O
OH--
+ H3O+
или упрощенно H2O![]() H+
+ OH‑
H+
+ OH‑
Состояние равновесия в этом случае характеризуется ионным произведением воды Kw:
Kw
= C(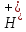 )∙C(OH‑)
= const
= f(T)
)∙C(OH‑)
= const
= f(T)
При
22 оС
Kw
= 1 .
10--14
и C(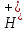 )∙
=C(OH‑)
= 1 .
10--7
моль/л
)∙
=C(OH‑)
= 1 .
10--7
моль/л
Содержание ионов оксония H+] и гидроксид-ионов OH-- удобно выражать через водородный показатель рН и гидроксидный показатель рОН:
рН
= ‑lg C(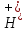 )∙и
pOH = ‑lg C(OH‑)
)∙и
pOH = ‑lg C(OH‑)
При
22 оС
в чистой воде рН = 7 и рОН = 7; рН
+ рОН = 14 =
const
= f(T).В водных растворах
кислот среда
кислотная.
Это значит, что C(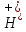 )∙> и при 22 оС
C(
)∙> и при 22 оС
C(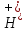 )∙больше 1 .
10--7
моль/л; водородный
показатель рН для
такого раствора меньше семи.
В водных
растворах оснований среда щелочная.
Это значит, что C(OH‑)
> C(
)∙больше 1 .
10--7
моль/л; водородный
показатель рН для
такого раствора меньше семи.
В водных
растворах оснований среда щелочная.
Это значит, что C(OH‑)
> C(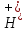 )∙и при 22 оС
C(OH‑)
больше 1 .
10--7
моль/л; гидроксидный показатель рОН для
такого раствора меньше семи, а водородный
показатель рН для такого раствора больше
семи. В водных растворах веществ, не
образующих избыток ионов водорода или
гидроксидных ионов среда
нейтральная.
Как и в чистой воде: при 22 оС
C(
)∙и при 22 оС
C(OH‑)
больше 1 .
10--7
моль/л; гидроксидный показатель рОН для
такого раствора меньше семи, а водородный
показатель рН для такого раствора больше
семи. В водных растворах веществ, не
образующих избыток ионов водорода или
гидроксидных ионов среда
нейтральная.
Как и в чистой воде: при 22 оС
C(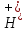 )∙= C(OH‑)
= 1 .
10--7
моль/л, а рН = рОН = 7. На практике водные
растворы со средой, близкой к нейтральной,
могут иметь рН от 6 до 8. Ниже приведены
значения рН некоторых растворов:
)∙= C(OH‑)
= 1 .
10--7
моль/л, а рН = рОН = 7. На практике водные
растворы со средой, близкой к нейтральной,
могут иметь рН от 6 до 8. Ниже приведены
значения рН некоторых растворов:
Раствор рН Раствор рН
Концентрированная Дождевая вода 6,5
соляная кислота –1,1 Чистая вода при 25 С 7,0
1М раствор HСl 0,0 Раствор пищевой соды 8,5