Файл: Лабораторная работа 26 определение никеля фотоколориметрическим методом.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 09.11.2023
Просмотров: 101
Скачиваний: 3
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Цель работы. Определить содержание хрома в сплаве методом титрования.
Сущность работы. Метод основан на окислении трехвалентного хрома до шестивалентного состояния с последующим титрование солью Мора.
Теоретическая часть. При растворении хромсодержащего сплава в разбавленной серной кислоте образуются соли трехвалентного хрома, которые окисляются персульфатом аммония в присутствии ионов серебра в качестве катализатора.
4Cr + 6H2SO4 → 2Cr2(SO4)3 + 4H2
Cr2(SO4)3 + 3(NH4)2S2O8 + 7 H2O → H2Cr2O7 + 3 (NH4)2SO4 +6 H2SO4
Присутствующий в сплаве марганец одновременно с хромом окисляется персульфатом аммония в HMnO4, в результате чего раствор окрашивается в фиолетово-красный цвет. Появление характерной окраски HMnO4 указывает на то, что окисление хрома закончено, так как у марганца окислительно-восстановительный потенциал равен +1,52 в, а у хрома - +1,36 в. Однако образующаяся окраска HMnO4 мешает дальнейшему определению хрома, основанному на титровании хромовой кислоты раствором соли Мора, поскольку HMnO4 также вступает в реакцию с двухвалентным железом:
2HMnO4 + 10FeSO4 + 7 H2SO4 → 2MnSO4 + 5 Fe2(SO4)3 + 8H2O
Чтобы исключить мешающее влияние этой реакции на определение хрома, перед титрованием добавляют хлорид натрия или соляную кислоту. При этом семивалентный марганец переходит в двухвалентное состояние, что сопровождается исчезновением красно-фиолетовой окраски.
Реактивы и оборудование:
-
Серная кислот (разбавленная 1:1), -
азотная кислота (пл.1,4), -
соляная кислота (пл.1,19), -
нитрат серебра 2%, -
хлорид аммония 5%, -
персульфат аммония 20%, -
соль Мора с=0,1 моль-экв/дм3, -
перманганат калия с=0,1 моль-экв/дм3, -
колба коническая объемом 500 дм3, -
мерный цилиндр на 50 см3, -
бюретка на 25 см3, -
аналитические весы, -
эл.плитка, -
хромсодержащий сплав.
Ход работы:
Навеску сплава от 0,1 до 2,0 г (величина навески зависит от содержания хрома в образце) помещают в коническую колбу на 500 см3, наливают 50 мл разбавленной 1:1 серной кислоты. После прекращения бурного выделения пузырьков газа раствор подогревают на плитке, добавив 3-4 см3 азотной кислоты для разрушения карбидов и полного окисления железа. Раствор кипятят для удаления окислов азота и появления паров SO
3 в присутствии серной кислоты.
Полученные сернокислые соли растворяют в 200 см3 воды, прибавляют 10 см3 2%-ного раствора азотнокислого серебра и слегка нагревают, затем прибавляют 50 см3 20%-ного раствора персульфата аммония и доводят раствор до кипения. Появление розовой окраски свидетельствует об окончательном окислении хрома. Раствор продолжают кипятить для разложения избытка персульфата аммония. К кипящему раствору добавляют 5 см3 5%-ного раствора хлорида натрия и кипятят 8-10 мин до полного разрушения марганцевой кислоты (появление желто-оранжевой окраски).
Раствор охлаждают, прибавляют из бюретки точно отмеренное количество титрованного раствора соли Мора до перехода окраски из желто-оранжевой в зеленую, после чего избыток соли Мора оттитровывают стандартным раствором перманганата калия до появления слабо розовой окраски, не исчезающей в течение 1 мин.
Протокол анализа:
1.Взятие навески: m=0,2015г
2.Растворение навески: VH2SO4=50мл; VHNO3=3мл
3.Восстановление навески: VNaCl=5мл
4.Добавление раствора соли Мора: Vсоли М=20мл
5.Определение поправочного коэффициента:
VKMnO4= 9,9мл; Vсоли М=10мл
К= VKMnO4/ Vсоли М=1,0101
6.Расчёт TKMnO4/Cr=
7.Процентное содержание хрома вычисляют по формуле:
ωСr =
V1 – общий объем прибавленного раствора соли Мора, см3;
V2 – объем перманганата калия, израсходованный на титрование избытка соли Мора, см3;
К – отношение эквивалентных объемов раствора перманганата калия и соли Мора К = V1/V2, где V1 –объем соли Мора, взятый на титрование,см3;
V2 – объем раствора перманганата калия, израсходованный на титрование соли Мора, см3.
Вывод: В ходе выполнения лабораторной работы я научилась определять содержание хрома в сплаве персульфато-серебрянным методом.
Техника безопасности:
1. Работа с концентрированными кислотами проводится в вытяжном шкафу
2. При работе с концентрированными кислотами обязательно надевать перчатки, защитные очки, халат.
3.Соблюдать осторожность при работе со стеклянной посудой.
4.Растворение навески стали производится только в вытяжном шкафу.
Контрольные вопросы.
-
Какие кислоты используют для растворения хромсодержащих сплавов? Напишите реакции.
Серная и азотная кислоты
4Cr + 6H2SO4 → 2Cr2(SO4)3 + 4H2
Cr2(SO4)3 + HNO3 → Cr2HNO3 + 3SO4
-
Какие реакции идут при разрушении карбидов хрома?
-
Что такое легирующие добавки? Для чего они используются?
Под легирующими добавками понимаются компоненты, улучшающие механические и физико-химические характеристики металлов и сплавов.
Для улучшения физических, химических, прочностных и технологических свойств металлы легируют, вводя в их состав различные легирующие элементы.
-
Какую роль играют ионы серебра?
В окислении хрома
-
Как рассчитать TKMnO4/Сr?
TKMnO4/Cr=
-
Какие еще существуют методы определения хрома в сплавах?
Фотометрический метод, феррометрический метод
-
К навеске анализируемого сплава 1,4520 г после соответствующей обработки для определения хрома добавлено 25,00 мл раствора соли Мора концентрации 0,1025 моль-экв/дм3 , на титрование избытка которого затрачено 6,50 мл раствора перманганата калия. Титр перманганата калия по хрому 0,00182 г/мл. Рассчитать содержание хрома в анализируемом сплаве.
Лабораторная работа № 29
ОПРЕДЕЛЕНИЕ МОЛИБДЕНА МЕТОДОМ ГРАДУИРОВОЧНОГО ГРАФИКА
Молибден содержится во многих сплавах. Он входит в состав жаростойких, кислотостойких, в бронировочных, в сплавы для аппаратуры химической и радиотехнической промышленности. Молибден в сплавах находится в виде карбидов, твердого раствора в железе. Металлический молибден и его карбиды не растворяются в серной, соляной и плавиковой кислотах. Серная разбавленная и соляная кислоты растворяют молибден лишь в присутствии окислителей (HNO3, H2O2 и др.). Для определения молибдена используют объемные методы, колориметрические, спектральные, весовые.
Сущность метода. Метод основан на измерении оптической плотности (А) раствора комплексного соединения молибдена(V) c роданидом калия K
2[MoO(SCN)5], имеющего желтую окраску. При определении Мо(VI) предварительно восстанавливают в Мо(V) аскорбиновой кислотой:
C6H8O6 + (NH4)2MoO4 → C6H6O6 + NH4MoO3 + H2O
2NH4MoO3 + 10KSCN + 4H2SO4 = 2K2[MoO(SCN)5] + 4H2O + 3K2SO4 + (NH4)2SO4
Оборудование и реактивы:
-
Спектрофотометр. -
Весы лабораторные с наибольшим пределом взвешивания до 150 г -
Набор кювет. -
Пипетки градуированные на 25,0 см3. -
Пипетка Мора на 25 см3. Колбы мерные на 50 и 100 см3. -
Цилиндры мерные на 10 см3. -
Стаканы на 200 и 400 см3. -
Серная кислота, разбавленная 1:1 -
Трилон Б концентрации 0,1 моль-экв/дм3 -
Муравьиная кислота, х.ч. 85%-ный раствор -
Калия роданид, раствор концентрации 4 моль/дм3 -
Аскорбиновая кислота 10%-ный раствор. -
Стандартный раствор, содержащий 1 мг/см3 молибдена(VI)
Приготовление 10%-ного раствора аскорбиновой кислоты. В стакан емкостью 200 см3 помещают 10 г аскорбиновой кислоты, добавляют 2 см2 раствора трилона Б концентрации 0,1 моль-экв/дм3, 90 см3 дистиллированной воды и 10 капель муравьиной кислоты, перемешивают и переносят в закрытую склянку.
Приготовление рабочего стандартного раствора с концентрацией 10 мг/дм3. В мерную колбу на 100 см3 вносят 1 см3 стандартного раствора и доводят дистиллированной водой до метки.
Приготовление градуировочных растворов для определения молибдена.
В
Выбор длины волны. Раствор, имеющий наиболее интенсивную окраску фотометрируют относительно дистиллированной воды при длинах волн от 350 до 500 нм поочередно с шагом 30 нм в кювете толщиной 10 мм, записывая результаты измерений в виде таблицы. Для дальнейшей работы выбирают длину волны соответствующую наибольшему светопоглощению исследуемого раствора.
Выбор кюветы. Толщину кюветы выбирают так, чтобы значение оптической (А) плотности находились в интервале 0,2-0,8.
Построение градуировочного графика. Измеряют оптическую плотность растворов стандартной серии при выбранной длине волны и толщины кюветы. Измерения проводят относительно раствора сравнения, которым является раствор не содержащий роданида калия. Измерения проводят два раза в каждой колбе серии. Готовят две серии стандартных растворов.
Определение содержания молибдена в анализируемой пробе. Анализируют две параллельные пробы. В мерную колбу вместимостью 50 см3 вносят аликвоту 10 см2 анализируемой пробы, по 4 см3 раствора серной кислоты (1:1), 20 см3 дистиллированной воды, 4 см3 раствора роданида калия, 5 см3 10%-ной аскорбиновой кислоты и тщательно перемешивают. Доводят до метки дистиллированной водой, выдерживают 20 минут и проводят измерения, используя в качестве сравнения раствор , не содержащий роданида калия.
Обработка результатов. Строят градуировочный график в программе MS Excel, откладывая по оси абсцисс концентрацию молибдена, а по оси ординат — соответствующие значения оптической плотности, либо используя программу QA 5300.
Массовую концентрацию молибдена(Мо) в анализируемой пробе, мг/см3 с учетом разбавления вычисляют по формуле:
с =
с(х) — концентрация молибдена(VI), найденная по градуировочному графику, мг/см3;
V(м.к.) - объем, до которого разбавлена проба, см3;
V(ал.) - объем пробы, взятый для анализа, см3.
За окончательный результат анализа принимают среднеарифметическое результатов двух параллельных измерений, абсолютное расхождение между которыми не должно превышать значений, указанных в таблице 1.
сmax – cmin < r
Погрешность рассчитывают по формуле ±∆ = 0,71·r
Результат представляют в виде сср ± ∆, мг/дм3 при доверительной вероятности Р= 0,95.
Таблица 1
-
Определяемый элемент
Массовая концентрация элемента, мг/дм3
Абсолютное расхождение, мг/дм3, r
молибден(VI)
От 10 до 100
св.100
4
6
П
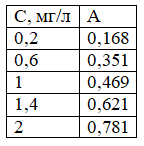 ротокол анализа:
ротокол анализа:С(1,0)=10*1/50=0,2мг/л
С(3,0)=10*3/50=0,6мг/л
С(5,0)=10*5/50=1мг/л
С(7,0)=10*7/50=1,4мг/л
С(10,0)=10*10/50=2мг/л
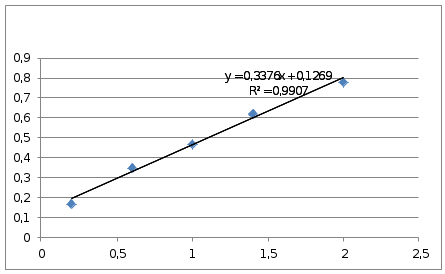
А(проба1)=0,162 ; А(проба2)=0,159
0,162=0,3376х+0,1269 0,159=0,3376х+0,1269
х=0,1039 х=0,0950
сmax – cmin=0,1039-0,0950=0,0089
0,0089<4, (r=4)
±∆ = 0,71·4=2,84
Вывод: В ходе выполнения лабораторной работы я научилась определять молибден методом градуировочного графика.
Контрольные вопросы.
-
Какие свойства придает молибден сплавам?
Молибден — увеличивает красностойкость, упругость, предел прочности на растяжение, антикоррозионные свойства и сопротивление окислению при высоких температурах.
-
В каком виде молибден находится в сплавах?
Для производства молибдена в качестве сырья используются молибденитовые концентраты, из которых получается чистый металл — основа для сплавов. В концентратах содержится около 20 % примесей, 1-9% оксида кремния, 28-32% серы и примерно 50 % молибдена.
-
Какие кислоты используют для растворения молибденсодержащих сплавов?
Сплавы молибдена растворяются в кислотах: в концентрированной соляной или серной ( 1: 3) при добавлении азотной кислоты. Удобным способомрастворения молибдена и его сплавов с вольфрамом является применение пероксида водорода или насыщенного раствора щавелевой кислоты в присутствии пероксида водорода; растворение происходит при умеренном нагревании раствора
-
Какие методы используют для анализа молибдена в сплавах?
Используют один из двух методов — плавка или порошковая металлургия.
-
На какой реакции основано определение молибдена фотометрическим методом?
Напишите реакции, которые при этом протекают.
C6H8O6 + (NH4)2MoO4 → C6H6O6 + NH4MoO3 + H2O
2NH4MoO3 + 10KSCN + 4H2SO4 = 2K2[MoO(SCN)5] + 4H2O + 3K2SO4 + (NH4)2SO4
Лабораторная работа № 30
ОПРЕДЕЛЕНИЕ МАРГАНЦА ПЕРСУЛЬФАТНО-СЕРЕБРЯНЫМ МЕТОДОМ
Марганец является легирующим элементом, он содержится почти во всех железных сплавах. В конструкционных, нержавеющих, кислотоупорных сталях его содержится от 2-3 до 15%. В железных сплавах он может присутствовать в различных формах: а) в форме твердого раствора в железе; б) в виде химических соединений – MnS, MnSi, Mn2Si, Mn3N2, Mn5N2, Mn2C, Mn3C4, MnSiO3, Mn2SiO4.
Обычно определяют общее содержание марганца. Его иногда добавляют для связывания серы в MnS, который значительно хуже растворяется, чем FeS, поэтому уходит в шлак. Для растворения низколегированных сталей и чугунов применяют обработку разбавленными кислотами.
Для разложения марганец-содержащих сплавов применяют смесь азотной, серной и фосфорной кислот. При этом образуются соответствующие соли:
Mn + H2SO4 → MnSO4 + H2↑
3Mn + 8HNO3 → 3Mn(NO3)2 + 2NO + 4H2O
3MnS + 14HNO3 → 3Mn(NO3)2 + 3H2SO4 + 8NO + 4H2O
Mn3C + 8HNO3 → 3Mn(NO3)2 + C + 2NO + 4H2O
Азотная и серная кислоты являются растворителями, а фосфорная связывает железо в прочный комплекс, а также стабилизирует НMnO4, чтобы она не разлагалась в диоксид марганца. Для определения марганца наиболее часто используют титриметрические методы анализа, основанные на реакциях окисления Mn2+.
Цель работы. Определить марганец в сплавах.
Сущность метода. Персульфатно-серебряный метод заключается в титровании раствора, содержащего марганцевую кислоту, образующуюся при окислении ионов марганца персульфатом аммония в присутствии ионов серебра в качестве катализатора. Для титрования используют смесь арсенита и нитрита натрия.
2 MnSO4 + 5(NH4)2S2O8 + 8H2SO4 → 2HMnO4 + 5(NH4)2SO4 + 7H2O
2HMnO4 + 5Na3AsO3 +4HNO3 → 2Mn(NO3)2 + 5Na3AsO4 + 3H2O
2HMnO4 + 5NaNO2 + 4HNO3 → 2Mn(NO3)2 + 5NaNO3 + 3H2O
Реактивы и оборудование:
-
Азотная кислота, -
серная кислота, -
фосфорная кислота, -
смесь кислот (к 500 см3 воды приливают при перемешивании 125 см3 серной кислоты, 275 см3 азотной кислоты и 100 см3 ортофосфорной кислоты. К полученной смеси кислот добавляют 30 см3 воды в которой растворен 1 г нитрата серебра), -
раствор нитрита натрия с=0,1 моль-экв/дм3, -
раствор серебра 0,5%-ный, -
персульфат аммония 25%-ный раствор; -
колба коническая на 250-300 см3, -
бюретка на 25 см3, -
цилиндр на 100 см3, -
аналитические весы, эл.плитка.
Ход работы:
Навеску 0,2-0,3 г средней пробы стали или чугуна, взятой с точностью 0,0002 г, помещают в коническую колбу и растворяют в смеси кислот, содержащей нитрит серебра. Растворение навески проводят в вытяжном шкафу в начале без нагрева. Закрыв колбу часовым стеклом. После прекращения бурной реакции колбу ставят на эл.плитку и нагревают до слабого кипения для растворения всей навески и удаления окислов азота. После этого в колбу добавляют 60-70 см3 горячей воды, приливают 5 см3 0,5%-ного раствора нитрата серебра и 10-15 см3 25%-ного персульфата аммония. Раствор быстро нагревают до кипения в течение 1,5-2 минут (но не больше, так как частично может разлагаться HMnO4).
За начало кипения следует принимать момент образования крупных пузырьков по всему объему раствора. Раствор должен иметь фиолетово-красную окраску и быть прозрачным. (Появление белой мути свидетельствует о выпадении AgCl, который не мешает анализу). Колбу с содержимым после кипячения выдерживают 2-3 минуты. Затем охлаждают в струе холодной воды.
Охлажденный раствор титруют раствором нитрита натрия до исчезновения розовой окраски. При этом раствор в колбе имеет зеленоватый или желтый цвет из-за наличия солей хрома, никеля и др. Это следует учитывать, чтобы не перетитровать раствор
Масса навески: Объем нитрита натрия с = 0,1 моль-экв/л:
m = 0,2030г V =3,6мл
Протокол анализа:
Процентное содержание марганца вычисляют по формуле:
ωMn =
V – объем нитрита натрия, пошедший на титрование, см3;
TNaNO2/Mn - титр раствора нитрита натрия по марганцу, определяется по формуле TNaNO2/Mn =
m
ωMn= = 1,94%
T
Вывод: В ходе выполнения лабораторной работы я научилась определять марганец в сплаве персульфатно-серебряным методом.
Техника безопасности.
-
Работы по растворению сплавов проводить в вытяжном шкафу. -
Использовать индивидуальные средства защиты при работе с сильными кислотами: очки, перчатки. -
Не использовать стеклянную посуду с трещинами и сколами. -
По окончании работы привести рабочее место в порядок.
Контрольные вопросы.
-
В каком виде марганец находится в сплавах?
В железных сплавах он может присутствовать в различных формах: а) в форме твердого раствора в железе; б) в виде химических соединений – MnS, MnSi, Mn2Si, Mn3N2, Mn5N2, Mn2C, Mn3C4, MnSiO3, Mn2SiO4.
-
Какие кислоты используют для растворения марганец содержащих сплавов? Напишите реакции растворения марганца в сплавах.
Для разложения марганец-содержащих сплавов применяют смесь азотной, серной и фосфорной кислот. При этом образуются соответствующие соли:
Mn + H2SO4 → MnSO4 + H2↑
3Mn + 8HNO3 → 3Mn(NO3)2 + 2NO + 4H2O
3MnS + 14HNO3 → 3Mn(NO3)2 + 3H2SO4 + 8NO + 4H2O
Mn3C + 8HNO3 → 3Mn(NO3)2 + C + 2NO + 4H2O
-
Какую роль играют ионы серебра в этом методе?
В качестве катализатора
-
Какие еще методы определения марганца вы знаете?
Фотометрический метод, гравиметрический метод
-
Что происходит при длительном кипячении раствора, содержащего HMnO4 Напишите реакции, которые при этом происходят.
4HMnO4 → 4MnO2 + 3O2 + 2H2O
-
Для определения марганца персульфатно-серебряным методом навеску сплава 1,3698 г после соответствующей обработки перевели в мерную колбу на 200 мл. На титрование 20,00 мл полученного раствора затрачено 20,5 мл раствора арсенит-нитрита натрия концентрации 0,5000 моль-экв/л. Рассчитать процентное содержание марганца в навеске.
Лабораторная работа № 32
ОПРЕДЕЛЕНИЕ МЕДИ ЙОДОМЕТРИЧЕСКИМ МЕТОДОМ
Сплавы на основе меди (цветные сплавы) имеют широкое промышленное применение. Сплав меди с цинком называется латунь. Она обладает хорошей свариваемостью и удовлетворительной механической обрабатываемостью. Добавки к латуни олова, никеля, марганца, алюминия придают ей повышенную твердость, прочность, устойчивость к коррозии.
Сплав меди с оловом называется бронзой, Бронзы используют в машиностроении при изготовлении деталей. Олово повышает химическую стойкость, фосфор добавляют как раскислитель, для устранения окислов олова, которые придают хрупкость сплавам. Свинец делает сплав более мягким. Сплав меди, никеля и цинка называется мельхиор, он сравнительно мягок, но высокоустойчив против коррозии.
Цель: определение содержания меди в сплаве йодометрическим методом.
Сущность работы: содержание меди в навеске определяют по количеству раствора тиосульфата натрия, израсходованному на титрование выделившегося йода.
Приборы и реактивы:
1. Азотная кислота, пл. 1,4;
2. Серная кислота, пл. 1,84 и 1:1;
3. Аммиак, 10%;
4. Уксусная кислота, 80%;
5. Пирофосфат натрия (Na2H2P2O7 или Na4P2O7);
6. Иодид калия, 20%;
7. Нитрат аммония, 10%;
8. Крахмал, 1%.
Химизм:
Медный сплав растворяют в азотной кислоте для полного окисления меди:
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO↑ + 4Н2O
Двухвалентная медь взаимодействует в слабокислой среде с йодистым калием, выделяя эквивалентное количество свободного йода и образуя малорастворимый осадок Cu2I2:
2Cu2+ + 4KI → Cu2I2↓ + 4K+ + I2
Образование малорастворимого осадка Cu2I2 способствует практически полному протеканию реакции слева направо. Выделившийся йод оттитровывают раствором тиосульфата натрия:
I2 + Na2S2O3 → 2NaI + Na2S4O6
Окислы азота мешают определению меди, так как, окисляясь кислородом воздуха, образуют NO2, который взаимодействует с KI, выделяя свободный йод
2NO + O2 → 2NO2
NO2 + 2KI + 2HCl → 2KCl + NO↑ + I2 + H2O
В результате этой реакции снова образуется NO, которая будет каталитически ускорять реакцию иодида калия с кислородом воздуха, что приведёт к сильно завышенным результатам. Поэтому после растворения сплава необходимо полностью удалить азотную кислоту выпариванием с серной кислотой.
Определению меди мешают ионы Fe3+, As5+ и Sb5+, реагирующие с иодидом калия с выделением йода
2FeCl3 + 2KI → 2FeCl2 + I2 + 2KCl
AsCl5 + 2KI → AsCl3 + I2 + 2KCl
SbCl5 + 2KI → SbCl3 + I2 + 2KCl
При наличии в сплаве большого количества железа его необходимо предварительно отделить, небольшие количества Fe3+ связать в комплексное соединение пирофосфатом натрия. Реакции ионов As5+ и Sb5+ с KI протекают только в сильнокислой среде. Кроме того, высокая кислотность способствует окислению ионов йода кислородом воздуха:
4I─ + O2 → 2I2 + 2O2─
Всё это искажает результаты анализа, поэтому определение меди необходимо проводить в слабокислой среде, лучше в уксуснокислой.
Теоретическая часть:
Йодометрический метод определения меди является одним из наиболее точных методов и в этом отношении уступает только электровесовому методу, однако он значительно быстрее электровесового метода. Йодометрический метод может применяться для определения меди в самых различных материалах, главными из которых являются руды и сплавы.
Ход работы:
Навеску сплава (латунь, бронза и др.) 0,2-0,3г, взвешенную с точностью до 0,0002г, помещают в стакан ёмкостью 300 мл, вливают 5-10мл воды и столько же концентрированной азотной кислоты, накрывают часовым стеклом и по окончании бурной реакции нагревают до полного растворения пробы. Затем снимают часовое стекло, обмывают его дистиллированной водой, собирая промывные воды в стакан. Если анализируемый материал содержит сурьму и олово то они выпадут в осадок в виде метасурьмяной и метаоловянной кислот. В этом случае прибавляют 15мл 10%-ного раствора нитрата аммония, нагревают до начала кипения для коагуляции осадка, дают раствору отстояться 30 минут при 80-90оС и горячий раствор фильтруют через плотный фильтр с бумажной массой, собирая фильтрат в чистый стакан ёмкостью 200мл. Осадок на фильтре промывают несколько раз горячей разбавленной азотной кислотой (1:100), собирая промывные воды в тот же стакан.
Раствор подкисляют 5мл серной кислоты (пл.1,84) и выпаривают на песчаной бане до появления густых белых паров серной кислоты. Полноту удаления окислов азота проверяют стеклянной палочкой, смоченной раствором дифениламина в концентрированной серной кислоте. Если при внесении палочки в пары над стеклом посинения не наблюдается, выпаривание прекращают, в противном случае добавляют немного воды и повторяют упаривание до полного удаления окислов азота. Затем стакан охлаждают, добавляют 20-25мл воды и нагревают до полного растворения сернокислой соли меди. Раствор по каплям нейтрализуют 10%-ным раствором аммиака до появления яркого синего окрашивания. К окрашенному раствору приливают 80%-ную уксусную кислоту до исчезновения синей окраски и ещё 3-4мл. Раствор охлаждают до комнатной температуры, добавляют к нему 0,1-0,2г пирофосфата натрия, перемешивают и приливают 15-20мл 20%-ного раствора йодистого калия. Содержимое стакана хорошо перемешивают и спустя 3-5минут, титруют выделившийся йод 0,1н раствором тиосульфата натрия, добавляя в конце титрования 2-3мл раствора крахмала до перехода окраски из синей в желтовато-белую.
mнавески = Vтиосульфата Na =
Процентное содержание меди вычисляют по формуле:
ωCu =
C – концентрация раствора тиосульфата натрия, моль-экв/дм3;
V – объём раствора тиосульфата натрия, пошедший на титрование, см3;
ЭCu – моль-эквивалент меди, равный её атомному весу;
m – навеска образца сплава, г.
Техника безопасности.
1. Осторожно работать со стеклянной посудой, не использовать посуду с трещинами и острыми краями.
2. Проводить работу с кислотами только в вытяжном шкафу
3. По окончании работы привести рабочее место в порядок.
Контрольные вопросы:
1. Почему для растворения медных сплавов используют азотную кислоту? Можно ли использовать соляную и серную кислоты? Напишите реакции, которые при этом протекают.
2. Какие вещества (катионы, нейтральные молекулы) мешают определению меди йодометрическим методом?
3. Почему эквивалент меди равен его атомному весу?
4. Какая среда используется для определения меди йодометрическим методом?
5. Какие ещё существуют методы определения меди в сплавах?
6. Навеска сплава 2,2890 г после растворения переведена в мерную колбу на 250 мл. К 20,00 мл полученного раствора прибавили йодид калия и на титрование выделившегося йода было затрачено 11,30 мл раствора тиосульфата натрия
(ТNa2S2O3/Cu = 0,00484). Вычислите процентное содержание меди в сплаве.