Файл: Институт нефтепереработки и нефтехимии фгбоу во угнту в г. Салавате.docx
Добавлен: 23.11.2023
Просмотров: 52
Скачиваний: 2
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Министерство науки и высшего образования Российской Федерации
Федеральное государственное бюджетное образовательное учреждение
высшего образования «Уфимский государственный нефтяной технический
университет» (ФГБОУ ВО «УГНТУ»)
Институт нефтепереработки и нефтехимии ФГБОУ ВО УГНТУ
в г. Салавате
Кафедра «Химико-технологические процессы»
Аналитическая химия
Тема:
Отчёт по лабораторной работе № 1
ХТП-18.03.01-1.01.00 ЛР
Исполнитель:
студент гр.
Руководитель:
Доцент, к.т. наук
Салават
2023
Цель работы:Освоение методики анализа растворов электролитов методом кондуктометрического титрования и анализ среды серной кислоты и сульфата меди.
Реактивы и оборудование:
1)Н2 SO4, 0,01н раствор;
2)CuSO4, 0,01н раствор;
3)NaOH, 0,01н раствор;
4)Установка для кондуктометрического титрования.
Порядок выполнения работы:
Пипеткой на 25млотбирам испытуемый раствор, содержащий Н2 SO4 и CuSO4 и переносим в сосуд для титрования ,снабжённый мешалкой. Разбавляем раствор водой так, что бы что бы все платиновые кольца находились в растворе (до 150мл),определяем электропроводность. Запишем из бюретки снабженной хлорокальцевой трубкой ,небольшими порциями (по 0,5мл) добавляем титрант.
После добавления каждой порции и перемешивания раствора замеряют электропроводность, убедившись каждый раз ,что электропроводность стала постоянной .
Результаты измерений заносим в таблицу №1.
По полученным данным строим кондуктометрическую кривую, графическим методом устанавливаем точку эквивалентности и определяем количество миллиметров рабочего раствора, вступившего в реакции CH2SO4(V1) и CuSO4 (V2-V1)
Таблица № 1
| Объем добавленного раствора (мл) | Электропроводность раствора Ом-1 |
| 150 | 2,5 |
| 150,5 | 2,4 |
| 151 | 2,3 |
| 151,5 | 2,1 |
| 152 | 2,0 |
| 152,5 | 1,9 |
| 153 | 1,9 |
| 153,5 | 1,9 |
| 154 | 1,8 |
| 154,5 | 1,8 |
| 155 | 1,8 |
| 155,5 | 1,8 |
| 156 | 1,8 |
| 156,5 | 1,8 |
| 157 | 1,8 |
| 157,5 | 1,8 |
| 158 | 1,8 |
| 158,5 | 1,8 |
| 159 | 1,8 |
| 159,5 | 1,8 |
| 160 | 1,8 |
| 160,5 | 1,8 |
| 161 | 1,8 |
| 161,5 | 1,9 |
| 162 | 2 |
| 162,5 | 2,1 |
| 163 | 2,5 |
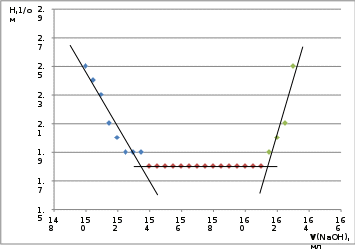
Рисунок 1 – Кондуктометрическая кривая
Содержание H2SO4 и CuSO4 в смеси рассчитывают по формулам Э CuSO4 =N СuSO4 / 2 = 159.5/2 = 79.75
T NaOH / CuSO4 = N NAOH * Э CuSO4 / 1000 = 0.1* 79.75/1000 = 0.0079.
Э H2SO4 =M H2SO4 /2 =98/2=49.
Q СuSO4=TNaOH/CuSO4 * (V2-V1)=0.0079 * (161.5-153.5)=0.0632
Q H2SO4=TNaOH/CuSO4 * V1=0.00049*153.5=0.75215.
Вывод: в ходе данной лабораторной работы основана методика анализа растворов электролитов методом кондуктометрического титрования и анализ серной кислоты и сульфата меди,где содержание H2SO4 и СuSO4 = 0,75215 и 0,0632 соответственно.