Файл: Лекции 6 химические реагентыэлектролиты Пояснить действие электролитов на глинистые растворы.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 07.12.2023
Просмотров: 16
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Вопросы по лекции 6 химические реагенты-электролиты:
1.Пояснить действие электролитов на глинистые растворы.
Действие электролитов связано с их воздействием на двойной электрический слой и гидратную оболочку, находящуюся вокруг гидратированной глинистой частицы. При низких концентрациях электролита (до порога коагуляции) происходит увеличение заряда частицы за счет попадания в диффузный и адсорбционный слои катионов и анионов диссоциированного электролита. Это приводит к увеличению заряда поверхности глинистых частиц,при этом силы взаимодействия ослабевают, меняются структурные свойства раствора. Поэтому при низких концентрациях электролит способствует усилению структурообразования. При увеличении концентрации электролита (выше порога коагуляции) происходит компенсация зарядов на поверхности глинистой частицы, диффузный слой сжимается, что приводит к коагуляции и ухудшению свойств глинистого раствора.
При высоких концентрациях:

























 коагуляция
коагуляция 















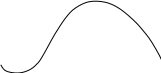
Действие электролитов на изменение параметров глинистого раствора:
Оценивается по изменению основных параметров глинистого раствора при добавлении в его состав электролита и увеличении концентрации этого электролита:


 Ф30
Ф30 Т Ф30
Т Ф30

 Т
Т 




2-3 13-15 Na2CO3, %
2.Охарактеризовать состояние глинистых частиц в трех областях по величине концентрации кальцинированной соды в растворе.
1- область стабилизции-при концентрации Na2CO3до 2-3% - область стабилизации в которой показатель фильтрации ,условная вязкость и статическое напряжение сдвига заметно снижаются:
Ф30↓; Т↓; θ↓
Связано с тем, что диссоциируемые катионы Na+и анионы CO3-- насыщают поверхность глинистой частицы, заряд частицы возрастает, и силы взаимодействия ослабевают. Раствор разжижается с закономерным снижением структурных свойств и условной вязкости . При этом хорошо диспергированные частицы глины как твердой фазы в растворе образуют плотную мало проницаемую корочку ,обеспечивающую заметное снижение показателя фильтрации.
2 -область структурообразования- при концентрации Na2CO3 до 1315% – область структурообразования: в этой области показатель фильтрации еще продолжает снижаться ,но условная вязкость и статическое напряжение сдвига возрастают Ф30↓; Т↑; θ↑
Увеличение концентрации бикарбоната натрия в растворе до 13-15% приводит к компенсации зарядов диффузного и адсорбционного (частично ) слоев и усилению сил взаимодействия между частицами глины т к большая часть молекул воды вступает во взаимодействие с увеличенным количеством диссоциированных катионов и анионов .Это приводит к тому ,что подвижность раствора уменьшается и вязкость его растет.
Усиление структурных свойств происходит за счет того, что попадая в диффузные слои кионы Na+ и анионы СО3-- приводят к компенсации заряда на поверхности глинистых частиц. Силы взаимодействия возрастают, то есть возрастают структурные свойства. В этом случае глинистые частицы соединяются между собой краевыми частями и развитыми поверхностями чешуек.Однако при этом происходит дальнейшее снижение показателя фильтрации поскольку частицы глины еще сохраняют защитную гидратную оболочку ,образуя достаточно плотную малопроницаемую корку.






3- область коагуляции -при концентрации Na2CO3 > 15% : в этой области концентрации Ф30↑; Т↓; θ↓ - снижаются структурные свойства и условная вязкость при существенном увеличении показателя фильтрации.
Дальнейшее насыщение диффузного и адсорбционного слоев вокруг глинистых частиц приводит к практически полной компенсации зарядов на их поверхностях ,что приводит к агрегатированию таких электронейтральных частиц и существенному увеличению показателя фильтрации при снижении вязкости и статического напряжения сдвига
Область, в которой увеличивается концентрация электролита, заряд глинистой частицы приближается к нулю. Выпадают из раствора агрегаты частичек. Падают структурные свойства раствора. Глинистые частички соединяются не только краевыми частями но и поверхностями чешуек-гранями :
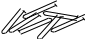
Поэтому выбору оптимальной концентрации электролита необходимо подходить осторожно, так как при приближении концентрации электролита в растворе к порогу коагуляции существенно снижаются свойства такого раствора.
3.Раскрыть назначение кальцинированной соды глинистом растворе.
-
Na2CO3 – кальцинированная сода (получается методом кальцинирования). Порошок белого цвета, хорошо растворяется в воде. Растворимость – 215 кг/м3.
Назначение:
- улучшение качества глин местного производства
;
- повышения выхода раствора из глин смешанного состава (Na+ + Ca++);
- связывание поликатионов;
- повышения рН растворов.
Са – глина исходно подвергается обработке содой:
Са-глина + Na2CO3CaCO3 + Na-глина


 Na+
Na+
 Ca+
Ca+
 Na+
Na+
Ca+
Кальциевая глина невысокого качества, так как ее частицы имеют неразвитую гидратную оболочку, катионный обмен идет неэффективно, гидратация у таких глин плохая.Поэтому введение в состав глинистого раствора кальцинированной соды способствует замещению катионов кальция в межслоевых пространствах таких глинистых частиц диссоциированными катионами натрия и приводит к модификации за счет получения натриевых глин ,которые являются глинами более высокого качества.Натриевая глина более эффективно набухает, хорошо гидратирует. Предпочтительными в практике бурения являются натриевые глины.
Кальцинированная сода необходима для связывания бивалентных катионов Са+2,которые вызывают коагуляцию глинистых растворов при перебуривании гипсов,ангидритов ,цементного камня в скважинах:
 гипс ангидрит цемент
гипс ангидрит цемент СаSO42H2O CaSO4–безводный гипс Са(ОН)2
СаSO42H2O CaSO4–безводный гипс Са(ОН)2природный гипсовый
камень
Гипс – CaSО4∙2H2O (природный гипс, камень), ангидрит – CaSO