ВУЗ: Национальный исследовательский томский политехнический университет
Категория: Учебное пособие
Дисциплина: Химия
Добавлен: 09.02.2019
Просмотров: 10343
Скачиваний: 59
36
то, при одновременном присутствии двух донорных или двух акцептор-
ных заместителей в орто-, пара-положениях или донорного и акцеп-
торного в мета-положении бензольного кольца, подобную информацию
с использованием набора перекрещенных изогнутых стрелок получить
затруднительно;
2) с помощью резонансных структур.
С точки зрения теории резонанса для молекул сопряженного харак-
тера распределение π- или р-электронной плотности нельзя описать од-
ной структурной формулой. Теория резонанса предлагает это распреде-
ление показывать с помощью нескольких структурных формул. Такие
формулы называют резонансными, или каноническими.
Чтобы отличить этот метод изображения формул от других хими-
ческих процессов, между резонансными структурами ставятся обоюдо-
острые стрелки (↔). Реальное состояние электронной плотности в мо-
лекуле считается гибридным, усредненным сравнительно со всеми ре-
зонансными структурами.
Правила написания резонансных структур
1. Резонансные структуры должны иметь одинаковый порядок свя-
зи, одинаковое пространственное строение, равное число подвижных
электронов.
2. В резонансных структурах только эти подвижные электроны
(π- и p-электроны) могут менять свои места, но не атомы.
3. Атом углерода во всех резонансных структурах должен оста-
ваться четырехвалентным.
4. Отрицательный заряд должен предпочтительнее находиться на
более электроотрицательных атомах.
5. Заряды должны быть сохранены во всех резонансных структурах.
6. Электроны всегда движутся от отрицательного заряда.
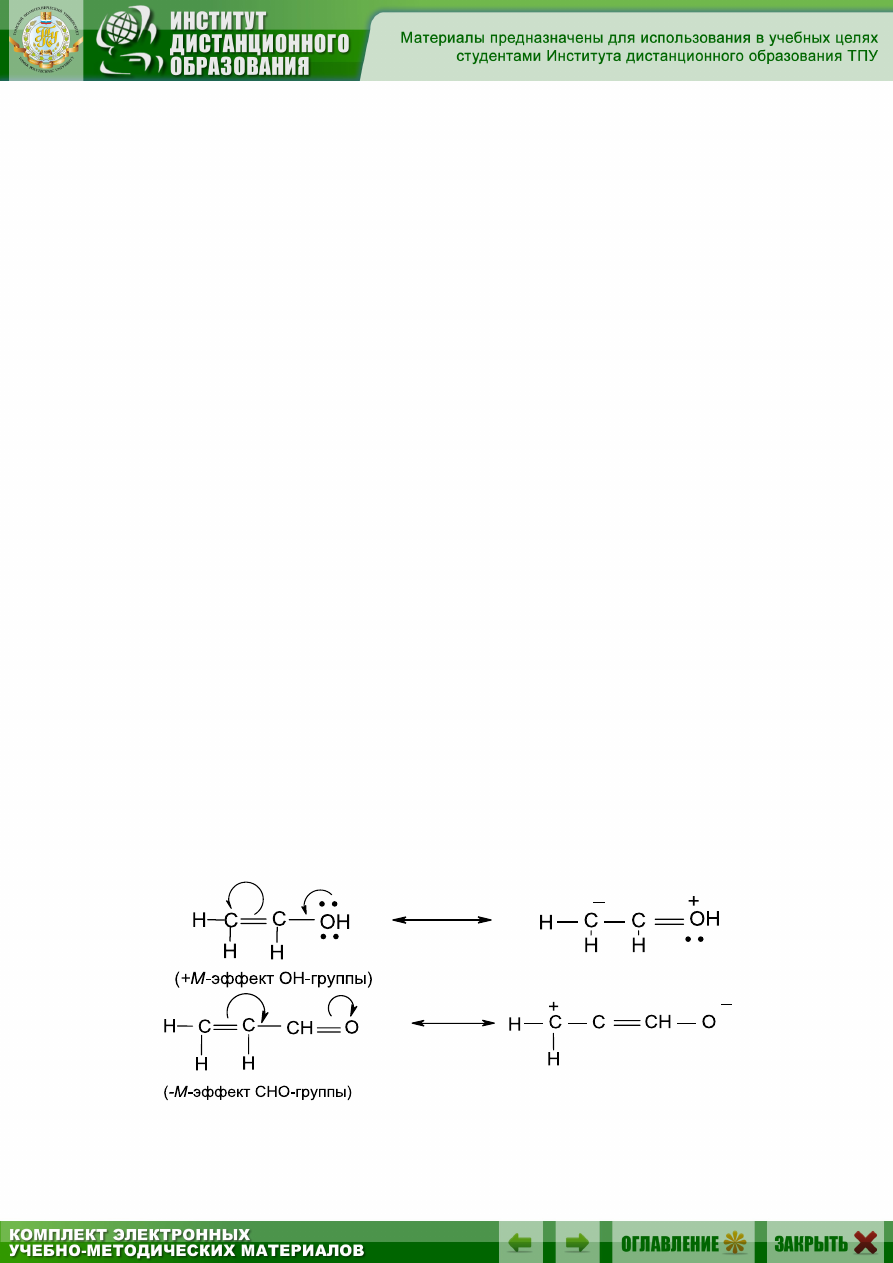
При написании резонансных структур сначала перемещают пару
π- или р-электронов:
37
Затем следует новое перемещение π- или р-электронов, если систе-
ма сопряжения протяженная (примеры 3 и 4).
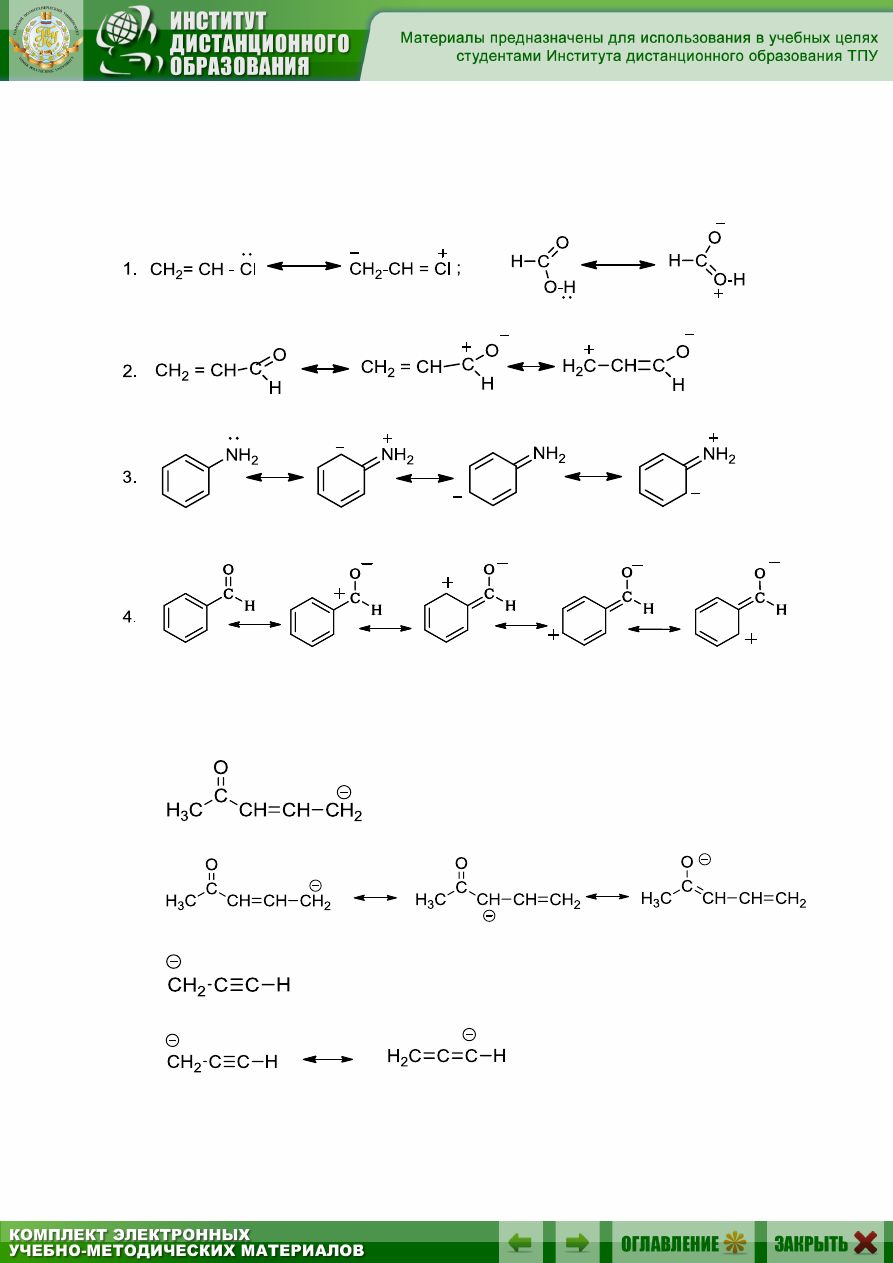
Примеры написания резонансных структур (с разделенным заря-
дом) для молекул:
Примеры написания резонансных структур:
а) для карбаниона:
38
б) для карбокатиона:
в) для радикала:
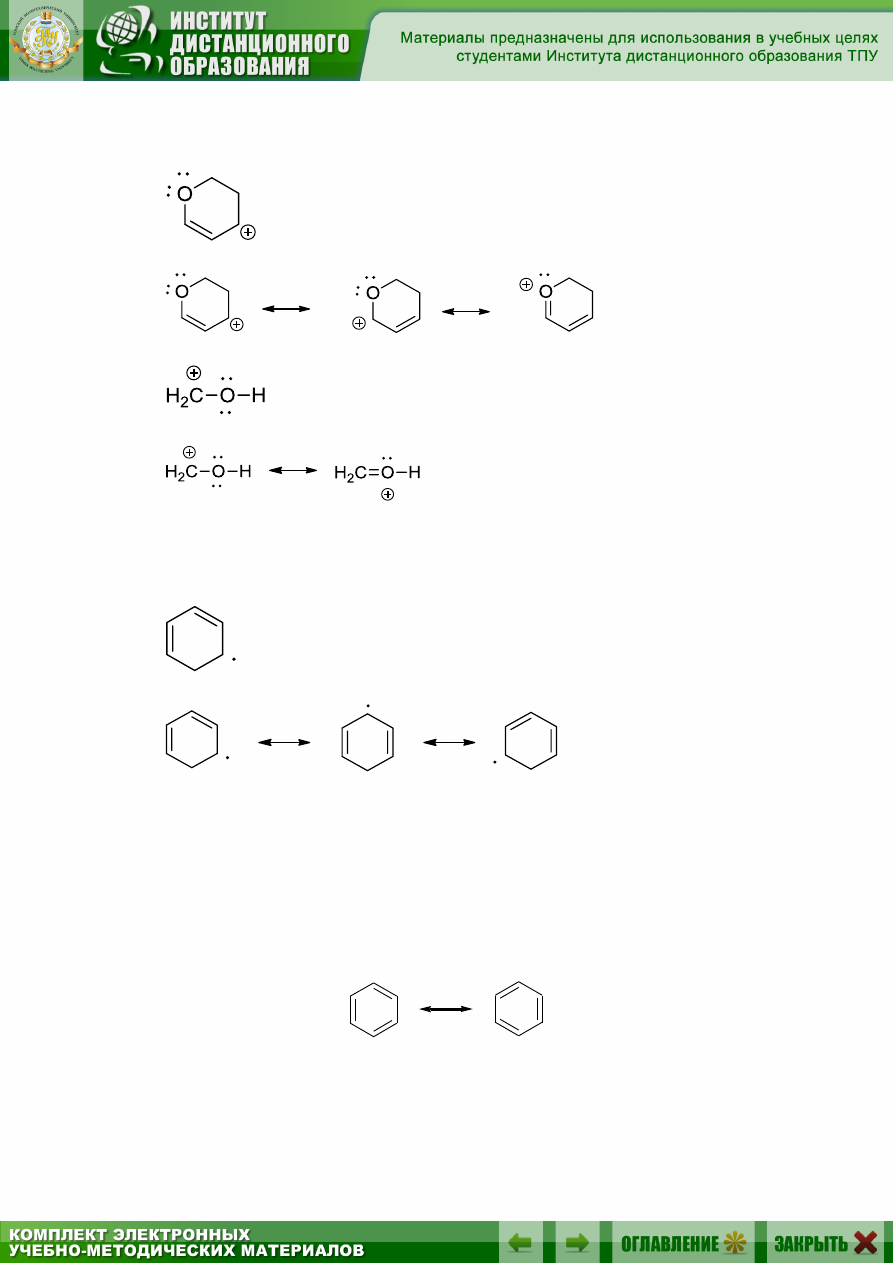
Все резонансные структуры являются условностью, реальная элек-
тронная структура представляет собой некое среднее состояние между
резонансными структурами (гибрид резонансных структур). Каждая ре-
зонансная структура вносит свой вклад в описываемую молекулу.
Например, молекула бензола представляет собой гибрид двух резо-
нансных структур Кекуле:
39
2.5.3. Электронные эффекты заместителей (донор или акцептор?)
Одни и те же заместители могут выступать как в роли донора, так
и в роли акцептора, в зависимости от окружения.
Если заместитель подает электронную плотность, то он является
электронодонорным, если заместитель оттягивает электронную плот-
ность на себя, то он является электроноакцепторным. Один и тот же
заместитель может проявлять разные электронные эффекты в зависимо-
сти от того, с каким радикалом он связан.
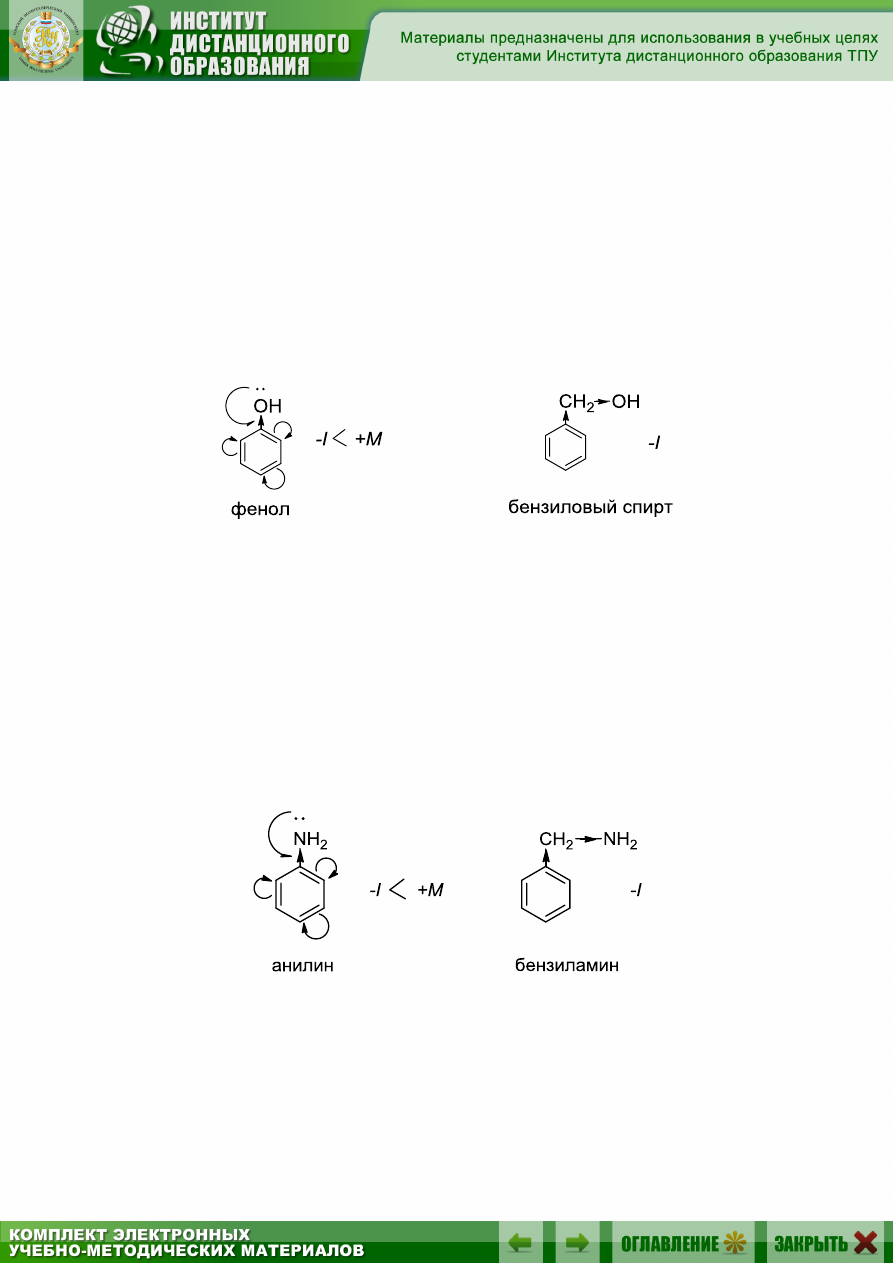
Рассмотрим фенол и бензиловый спирт:
Группа OH в феноле проявляет оба эффекта, причем +М-эффект
больше, чем –I-эффект. Следовательно, группа OH в феноле является
электронодонором.
Группа OH в бензиловом спирте проявляет только –I-эффект
(+М-эффекта нет, т.к. нет сопряжения с кольцом). Следовательно, в
данном случае группа OH является электроноакцептором.
Точно такая же картина будет наблюдаться в случае анилина и бен-
зиламина. В анилине аминогруппа выступает в роли донора, а в бензи-
ламине – в роли акцептора:
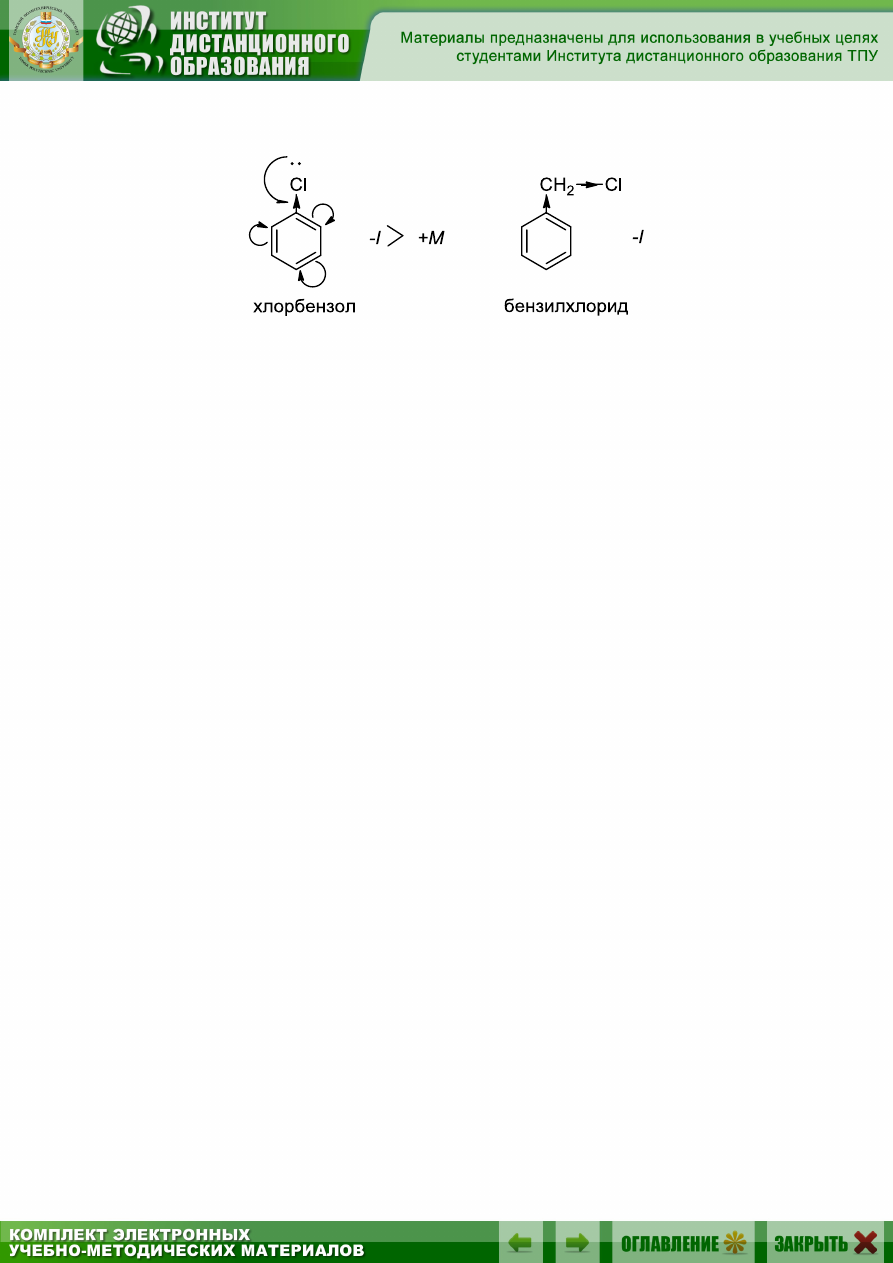
Если говорить о хлорбензоле и хлористом бензиле, то хлор в обоих
случаях выступает только как электроноакцептор, поскольку в хлорбен-
золе положительный мезомерный эффект много меньше отрицательного
индукционного:
40
Электронные эффекты позволяют качественно оценить стабиль-
ность тех или иных промежуточных частиц при написании механизмов
органических реакций; предсказать или объяснить направление реак-
ции; сравнить по силе кислоты и основания.