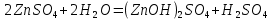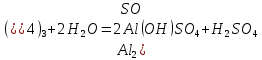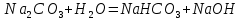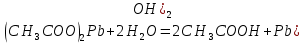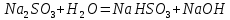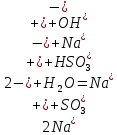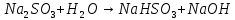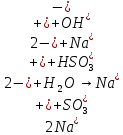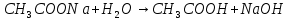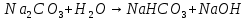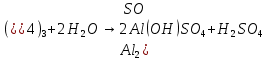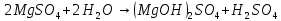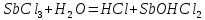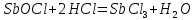Файл: Лабораторная работа 4 По дисциплине Химия (наименование учебной дисциплины согласно учебному плану).docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 10.01.2024
Просмотров: 23
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Министерство науки и высшего образования Российской Федерации

ПЕРВОЕ ВЫСШЕЕ ТЕХНИЧЕСКОЕ УЧЕБНОЕ ЗАВЕДЕНИЕ РОССИИ
Федеральное государственное бюджетное образовательное учреждение
высшего образования
«Санкт-Петербургский горный университет»

Лабораторная работа № 4
По дисциплине: Химия ______ __________________
(наименование учебной дисциплины согласно учебному плану)
Тема: «Исследование гидролиза солей.»_ _ _
Выполнил: студент гр. ГГ-22-2 ______________ /Викулина А. А./
(подпись) (Ф.И.О.)
Дата:
Проверил: ______________ / /
(должность) (подпись) (Ф.И.О.)
Санкт-Петербург
2023 г.
Цель работы: ознакомиться с процессом гидролиза солей и его следствиями, научиться составлять уравнения гидролиза.
Общие сведения.
Гидролизом называют процесс химического взаимодействия солей с водой. Продуктами гидролиза являются малодиссоциированные соединения в растворе, иногда – осадки или газы. Соответственно соли, образованные сильной кислотой и сильным основанием, не гидролизуются. К ним относятся, например, хлориды, нитраты и сульфаты щелочных металлов, стронция и бария. Различают три типа гидролизующихся солей:
Гидролиз соли, образованной сильным основанием и слабой кислотой. Гидролизуется анион слабой кислоты: А + Н2О = НА + ОН, в растворе появляются ионы ОН, поэтому среда – щелочная, рН > 7. Например, Na2CO3 образован сильным основанием NaOH и слабой угольной кислотой H2CO3. Диссоциация карбоната натрия описывается уравнением:
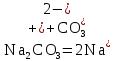 .
.С водой взаимодействует карбонат-ион по реакции:
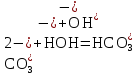
.
Распределяя катионы натрия по образующимся в ходе гидролиза анионам, получим молекулярное уравнение гидролиза:
Na2CO3 + H2O = NaHCO3 + NaOH.
Гидролиз соли, образованной слабым основанием и сильной кислотой. Гидролизуется катион слабого основания: М+ + Н2О МОН + Н+, в растворе появляются ионы Н+, поэтому среда кислая, рН < 7. Например, FeSO4 образован слабым основанием Fe(OH)2 и сильной кислотой H2SO4. Сульфат железа (II) диссоциирует по реакции:
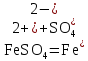 .
. С водой реагирует остаток слабого основания – катион Fe2+:
Fe2+ + HOH FeOH+ + H+.
Так как в ходе гидролиза образуются ионы H+, то среда в растворе FeSO4 будет кислой.
Молекулярное уравнение гидролиза:
2FeSO4 + 2H2O = (FeOH)2SO4 + H2SO4.
Степень гидролиза солей этих двух групп невелика, не превышает нескольких процентов. Поэтому гидролиз многозарядных ионов протекает не далее первой ступени, то есть ограничивается взаимодействием иона только с одной молекулой воды.
Гидролиз соли, образованной двумя слабыми электролитами. Гидролиз протекает как по катиону, так и по аниону: М+ + А + Н2О = МОН + НА. Например, ацетат натрия CH3COONa образован слабым основанием NH4OH и слабой кислотой CH3COOH, соответственно с водой взаимодействует и катион аммония и ацетат-ион:
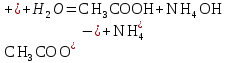
Молекулярная форма реакции:
CH3COONH4 + H2O = CH3COOH + NH4OH
Образующиеся слабые кислота и основание диссоциируют в разной степени, поэтому среда в растворе зависит от их относительной силы. Если кислота сильнее, то ее константа диссоциации больше и среда слабокислая. Если сильнее основание, то среда слабощелочная.
Степень гидролиза соли, образованной слабой кислотой и слабым основанием многократно выше, чем у солей первых двух групп, гидролизующихся только по одному иону. Если продуктами гидролиза являются труднорастворимые соединения или газы, то гидролиз протекает полностью. Пример необратимого, полного гидролиза:
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S.
Степень гидролиза солей зависит от ряда факторов, определяемых принципом Ле-Шателье.
Чем слабее кислота или основание, образующиеся в результате гидролиза
, тем выше глубина протекания процесса.
С увеличением количества воды, то есть с разбавлением раствора, степень гидролиза возрастает.
Поскольку гидролиз всегда протекает с поглощением тепла, является эндотермической реакцией, степень гидролиза повышается при нагревании раствора.
Гидролиз солей первой группы может быть подавлен добавлением кислоты, а во второй группе солей – добавлением щелочи.
При смешивании растворов солей первой и второй групп происходит взаимное усиление гидролиза.
Выполнение работы.
Опыт 1. Гидролиз солей.
| № | Формула соли | Окраска лакмуса | Окраска фенол-фталеина | pH по индикаторной бумаге | Характер раствора |
| 1 | 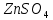 | розовый | бесцветный | 5 | кислый |
| 2 | 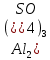 | розовый | бесцветный | 2 | кислый |
| 3 | 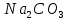 | синий | малиновый | 11 | щелочной |
| 4 | 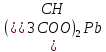 | розовый | бесцветный | 3 | кислый |
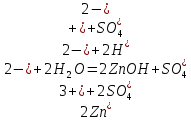
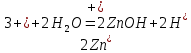
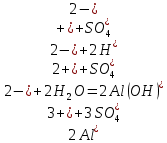
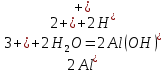
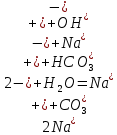
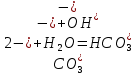
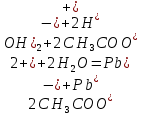
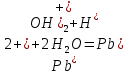
Опыт 2. Образование основных и кислых солей при гидролизе.
Б.
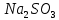 pH=8
pH=8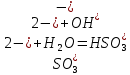
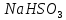 +
+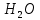 =H2SO3 + NaOH
=H2SO3 + NaOH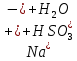 = H2SO3+
= H2SO3+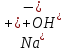
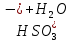 = H2SO3
= H2SO3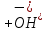
Значение pH указывает на щелочную среду раствора, значит, в нем присутствуют ионы
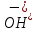 , которые образовались в результате гидролиза.
, которые образовались в результате гидролиза.NaHSO3,, сильное основание и слабая кислота.
Опыт 3. Факторы, влияющие на степень гидролиза солей.
А.
| № | Формула соли | Окраска лакмуса | Окраска фенол-фталеина | pH по индикаторной бумаг | Окраска после нагревания |
| 1 | 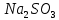 | – | бесцветный | 8 | – |
| 2 | 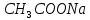 | – | малиновый | 11 | – |
| 3 | 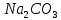 | – | малиновый | 11 | – |
| 4 |  | розовый | – | 2 | – |
| 5 | 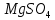 | фиолетовый | – | 5 | – |
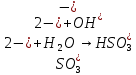
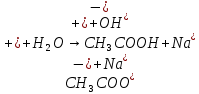
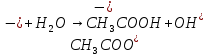
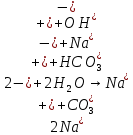
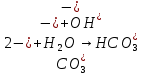
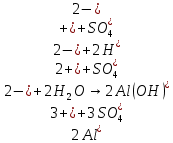

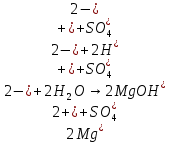
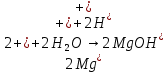
В.
Sb3++3Cl-+
 =H++ Cl-+
=H++ Cl-+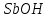 2++2 Cl-
2++2 Cl-Sb3++
 = H++
= H++ 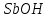 2+
2+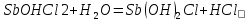
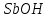 2++2 Cl-+
2++2 Cl-+ =
=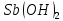 ++ Cl-+ H++ Cl-
++ Cl-+ H++ Cl-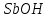 2++
2++ =
=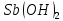 ++ H+
++ H+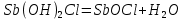
Трехступенчатый гидролиз хлорида сурьмы до образования осадка SbOCl.
Наблюдаем растворение осадка хлорида оксосурьмы.