Файл: Серная кислота и её соли, Проверка блока по теме Серная кислота и её соли.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 10.01.2024
Просмотров: 30
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
АЗОТ
Д/з:§24, РТ стр. 85-86 №7-9.
ОР: (NH4)2Cr2O7, спирт, спиртовка, спички, асбестовая сетка.
Проверочная работа по теме «Серная кислота и её соли», Проверка блока по теме «Серная кислота и её соли».
Подгруппа азота (VА группа) - азот, фосфор, мышьяк, сурьма, висмут.
НАХОЖДЕНИЕ В ПРИРОДЕ: Содержание в земной коре: азот - 0,01%, фосфор - 0,08%, мышьяк - 0,0006%, сурьма - 0,0004%, висмут - 0,00002%
Наличие трех неспаренных электронов на внешнем энергетическом уровне объясняет то, что в нормальном, невозбужденном состоянии валентность элементов подгруппы азота равна III.
У атомов элементов подгруппы азота (кроме азота - внешний уровень азота состоит только из двух подуровней - 2s и 2p) на внешних энергетических уровнях имеются вакантные ячейки d-подуровня, поэтому они могут распарить один электрон с s-подуровня и перенести его на d-подуровень. Таким образом, валентность фосфора, мышьяка, сурьмы и висмута равна V.
Возможные степени окисления:
Из-за наличия трёх неспаренных электронов азот очень активен, находится только в виде соединений. Азот проявляет в соединениях степени окисления от «-3» до «+5».
Физические свойства:
Азо́т (от греч. — безжизненный, лат. Nitrogenium). Было известно, что азот не поддерживает ни горения, ни дыхания. Хотя впоследствии выяснилось, что азот, наоборот, крайне необходим для всех живых существ.
В свободном состоянии существует в виде двухатомных молекул N2 – ковалентная неполярная связь, тройная, очень прочная, молекулярная кристаллическая решётка. Малая реакционная способность при обычной температуре (газ, без цвета, запаха, легче воздуха). В воде растворяется хуже, чем кислород.Mr(Bоздуха)/Mr(N2) = 29/28
Биологическая роль:
Азот является элементом, необходимым для существования животных и растений, входит в состав белков, аминокислот, нуклеиновых кислот, хлорофилла, гемоглобина и др. По массовой доле – 4 место после водорода, углерода и кислорода. Значительное количество связанного азота содержится в живых организмах, «мёртвой органике». В результате процессов гниения и разложения азотсодержащей органики, при условии благоприятных факторов окружающей среды, могут образоваться природные залежи полезных ископаемых, содержащие азот, например, «чилийская селитра» (нитрат натрия с примесями других соединений), норвежская, индийская селитры. Селитры используются в качестве азотных удобрений и в производстве взрывчатых веществ.
Получение:
1) в промышленности - из жидкого воздуха.
2) в лабораториичистый («химический») азот получают добавляя при нагревании насыщенный раствор хлорида аммония NH4Cl к твердому нитриту натрия NaNO2:
а) NaNO2 + NH4Cl = NaCl + N2↑ + 2H2O.
Можно также нагревать твердый нитрит аммония: NH4NO2 = N2↑+ 2H2O.
б) (NH4)2Cr2O7 = N2↑ + Cr2O3 + 4H2O демонстрационный опыт
Химические свойства:
1. С металламиобразуются нитриды:
- при нагревании с Mg и щелочноземельными, щелочными:
3Сa + N2 = Ca3N2 (при tºC)
- c Li при tºC комнатной
!!!Нитриды разлагаются водой (гидролиз): Са3N2 + 6H2O = 3Ca(OH)2 + 2NH3↑
2. С водородом:3H2 + N2 ↔ 2NH3(условия: tºC, p, kat)
3. N2 + O2 ↔ 2 NO – Q (в природе подобный процесс наблюдается при грозах или при t = 2000º C)
4. N2 + 3F2 = 2NF3
!!!Азот не реагирует с серой, углеродом, фосфором, кремнием и некоторыми другими неметаллами.
Применение:
В промышленности - для получения аммиака. Жидкий азот используют как хладагент, в медицине, особенно в косметологии. Важное значение в поддержании плодородия почв имеют азотные минеральные удобрения.
Круговорот азота в природе:
учебник стр. 144-145 – изучить самостоятельно
Закрепление:
1. Осуществите превращения по схеме: N2 → Li3N → NH3
2. В одном цилиндре находится газ азот, в другом - кислород, а в третьем - углекислый газ. Как различить эти газы?
3. В некоторых горючих газах содержится в виде примеси свободный азот. Может ли при сгорании таких газов в обыкновенных газовых плитах образоваться оксид азота (II). Почему?
4. Учебник стр. 146 упр. 2
АММИАК
Д/з:§25, РТ стр. 86-87 №3-4, 6.
ОПРОС:
1. Физические свойства, применение, получение азота.
2. Химические свойства азота.
3. Карточки индивидуальные.
4.
 Проверка РТ стр. 85-86 №7-9 - выборочно.
Проверка РТ стр. 85-86 №7-9 - выборочно.Аммиак (в европейских языках его название звучит как «аммониак») своим названием обязан оазису Аммона в Северной Африке. В жарком климате мочевина (NH2)2CO, содержащаяся в продуктах жизнедеятельности животных, разлагается особенно быстро. Одним из продуктов разложения и является аммиак. По
другим сведениям, аммиак получил своё название от древнеегипетского слова «амониан». Так называли людей, поклоняющихся богу Амону. Они во время своих ритуальных обрядов нюхали нашатырь NH4Cl, который при нагревании испаряет аммиак.
Строение молекулы:
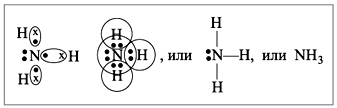
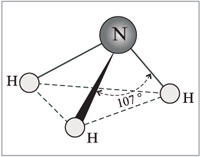
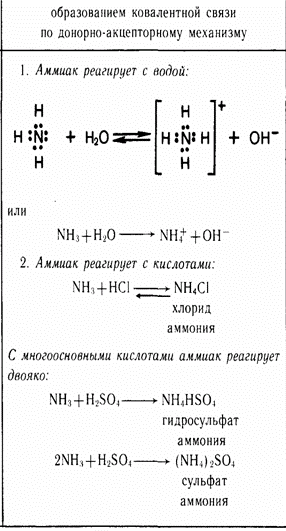
Молекула аммиака имеет форму пирамиды с атомом азота в вершине. Три неспаренных p-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s-электронами трёх атомов водорода (связи N−H), четвёртая пара внешних электронов является неподелённой, она может образовать донорно-акцепторную связь с ионом водорода, образуя ион аммония NH4+.
Физические свойства аммиака:
При н.у. — бесцветный газ с резким характерным запахом (запах нашатырного спирта), почти вдвое легче воздуха, ядовит. Растворимость NH3 в воде чрезвычайно велика — около 1200 объёмов (при 0°C) или 700 объёмов (при 20°C) в объёме воды. При кипячении растворённый аммиак улетучивается из раствора.
По физиологическому действию на организм относится к группе веществ удушающего действия, способных при ингаляционном поражении вызвать токсический отёк лёгких и тяжёлое поражение нервной системы. Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Это мы и воспринимаем как резкий запах. Пары аммиака вызывают обильное слезотечение, боль в глазах, химический ожог конъюнктивы и роговицы, потерю зрения, приступы кашля, покраснение и зуд кожи.
Получение аммиака:
В промышленности:
NH4Cl + NaOH = NH3↑ + NaCl + H2O
Внимание! Гидроксид аммония неустойчивое основание, разлагается:NH4OH ↔ NH3↑ + H2O
Собирание аммиака:
При получении аммиака держите пробирку - приёмник дном кверху, так как аммиак легче воздуха:

Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота:
N2(г) + 3H2(г) ↔ 2NH3(г)
Условия:
катализатор – пористое железо
температура – 450 – 500˚С; давление
Химические свойства аммиака:
1.Горение аммиака(при нагревании): 4NH3 + 3O2 = 2N2↑ + 6H2О
2.Каталитическое окисление аммиака(катализатор Pt – Rh, tºC):
4NH3 + 5O2 = 4NO↑ + 6H2O
3. С оксидами металлов: 2 NH3 + 3CuO = 3Cu + N2↑ + 3H2O
4. С сильными окислителями (например, Cl2):2NH3 + 3Cl2 = N2 + 6HCl (tºC)
5. 2NH3 + 3Mg = Mg3N2 + 3H2↑
Распознавание аммиака:
Применение:
По объемам производства аммиак занимает одно из первых мест; ежегодно во всем мире получают около 100 миллионов тонн этого соединения. Аммиак выпускается в жидком виде или в виде водного раствора – аммиачной воды, которая обычно содержит 25% NH3. Огромные количества аммиака далее используются для получения азотной кислоты, которая идет на производство удобрений и множества других продуктов. Аммиачную воду применяют также непосредственно в виде удобрения, а иногда поля поливают из цистерн непосредственно жидким аммиаком. Из аммиака получают различные соли аммония, мочевину, уротропин. Его применяют также в качестве дешевого хладагента в промышленных холодильных установках.
Медики используют водные растворы аммиака (нашатырный спирт) в повседневной практике: ватка, смоченная в нашатырном спирте, выводит человека из обморочного состояния. Для человека аммиак в такой дозе не опасен. Рисунок 85 стр. 151
Закрепление:
1. Осуществить превращения по схеме:
а) Азот → Аммиак → Оксид азота (II)
б) Нитрат аммония → Аммиак → Азот
в) Аммиак → Хлорид аммония → Аммиак → Сульфат аммония
2. Напишите четыре уравнения химических реакций, в результате которых образуется аммиак.
СОЛИ АММОНИЯ
Д/з:§26, блок по теме «Азот. Аммиак. Соли аммония», повт. §24-25 к проверочной работе.
ОР: фарфоровая ступка с пестиком, порошок соды (карбонат натрия) и хлорида аммония, вода, стакан химический, лакмусовая бумага.
ОПРОС:
1. Физические свойства, применение, получение аммиака.
2. Химические свойства азота, способы собирания и распознавания
3. упр. 6 стр. 152 учебник – у доски письменно.
4. Карточки индивидуальные.
5. Проверка РТ стр. 86-87 №3-4, 6 - выборочно.
6. Проведение лабораторного опыта РТ стр. 87 №7, оформить.
Соли аммония - это сложные вещества, в состав которых входят ионы аммония NH4+, соединённые с кислотными остатками.
Например, NH4Cl – хлорид аммония
NH4NO3 – нитрат аммония (NH4)2HPO4 – гидроортофосфат аммония
Физические свойства:
Кристаллические вещества, хорошо растворимые в воде.
Получение
1 способ - NH3 + HNO3 = NH4NO3
2 способ -Аммиачная вода + кислота: 2NH4OH + H2SO4 = (NH4)2SO4+ 2Н2O
Химические свойства:

Применение:
Нитрат аммония (аммиачная селитра) NH4NO3 применяют как азотное удобрение и для изготовления взрывчатых веществ — аммонитов;
Сульфат аммония (NH4)2SO4 — как дешёвое азотное удобрение;
Гидрокарбонат аммония NH4HCO3 и карбонат аммония (NH4)2CO3 — в пищевой промышленности при производстве мучных кондитерских изделий в качестве химического разрыхлителя, при крашении тканей, в производстве витаминов, в медицине;
Хлорид аммония (нашатырь) NH4Cl — в гальванических элементах (сухих батареях), в текстильной промышленности, как удобрение, в ветеринарии.