Файл: Решение Вычисляем 0 х р. и S 0 х р. для первой реакции со(г) зн 2 (г) сн 4 (г) Н.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 10.01.2024
Просмотров: 65
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
СO32− + 2 H3O+ → H2CO3 + 2 H+; H2CO3 → CO2↑ + H2O
Анион PO43− образует при взаимодействии с катионами Ва2+ осадок белого цвета:
1. 2 PO43− + 3 Ва2+ → Ba3(PO4)2↓ белый осадок растворяется в кислотах: HCl, HNO3, CH3COOH.
2.Реакция с нитратом серебра. Анионы фосфата и гидрофосфата образуют с катионами серебра в нейтральной среде желтый осадок фосфата серебра:
PO43− + 3 Ag+ → Ag3PO4↓ желтый осадок
HPO42− + 3 Ag+ → Ag3PO4↓ + H+
Осадок фосфата серебра растворяется в азотной кислоте и избытке раствора аммиака.
3.Реакция с магнезиальной смесью (MgCl2 + NH4Cl + NH4OH). Анион фосфата при взаимодействии с данной смесью образует белый мелкокристаллический осадок двойного фосфата NH4MgPO4:
Mg2+ + PO43− + NH4+ → NH4MgPO4↓ белый осадок
Осадок двойной соли растворим в кислотах.
4.Реакция с молибдатом аммония. Анионы фосфата взаимодействуют с молибдатом аммония (NH4)2MoO4 при нагревании. В результате реакции образуется желтый кристаллический осадок комплексной аммонийной соли фосфоромолибденовой кислоты: (NH4)3[PO4(MoO3)12] или (NH4)3[PMo12O40]:
PO43− + 3 NH4+ + 12 MoO42− + 24 H+ = (NH4)3[PO4(MoO3)12]↓ + 12 H2O.
желтый осадок
Осадок фосфоромолибдата аммония растворим в азотной кислоте; в растворах щелочей и аммиака; в избытке анионов фосфата с образованием желтого раствора (поэтому реакцию проводят с использованием избыточного количества реактива
Задание 32
32. В процессе очистки промышленных сточных вод происходит образование коллоидных растворов. Для их разрушения и коагуляции обычно применяются растворы электролитов. Если исходные сточные воды содержали поверхностно-активные вещества на основе солей триалкиламмония общей формулы
| Al(NO3)3 | (NH4)2Cr2O7 | Na3PO4 | Na2CO3 |
Решение
Исходные сточные воды содержали поверхностно-активные вещества на основе солей триалкиламмония общей формулы
(R3NH+ )2SO4-2 ↔ 2 R3NH+ + SO4-2
Коагулирующее действие оказывает ион, заряд которого противоположен заряду коллоидной частицы.
Правило Шульце – Гарди: величина порога коагуляции данного коллоидного раствора зависит от заряда иона–коагулятора, причем, чем выше заряд этого иона, тем ниже величина порога коагуляции.
Значения порогов коагуляции для одно-, двух- и трехзарядных ионов примерно обратно пропорциональны 6–й степени их зарядности.
| Ba(NO2)2 | K2Cr2O7 | Сr(NO3)3 | H3PO4 |
Наибольший заряд имеет анион PO4-3 ,следовательно, раствор кислоты H3PO4 будет обладать наибольшей коагулирующей способностью
Задание 43
43. Для осаждения большинства ионов тяжелых металлов из сточных растворов часто применяется гидроксид кальция (гашеная известь). Если годовой объем очищаемой воды равен 3000 м3, а содержание в нем ионов Fe3+ составляет 140 мг/дм3, то с учетом 10%-го избытка реагента, необходимого для полного осаждения, расход гидроксида кальция составит __916____ кг в год. (Ответ привести с точностью до целых; Ar(Fe) = 56.)
Решение
Уравнение реакции осаждения катионов железа Fe3+ будет следующее:
2Fe3+ + 3Ca(OH)2 = 2Fe(OH)3↓ + 3Ca+2
М(Ca(OH)2 = 40+ 17*2 = 74 г/моль
По уравнению реакции на осаждение
112 г железа Fe3+ расходуется 3*74 г гашенной известиCa(OH)2
На (140*3000*1000/1000) * 110(%) г ----------------- х г
Х = 140*3000*3*74*1,1/112*1000 = 915,75кг
Задание 54
54. Наиболее технологичным и эффективным способом выделения металлов из растворов является электролиз. Если годовой объем очищаемой воды равен 1000 м3, а содержание в нем ионов Pd3+ в виде анионных комплексов составляет 7,8 мг/дм3, то время, необходимое для выделения всего палладия электролизом при силе тока 11,9 А и выходе по току 100 %, составит __21___ суток. (Ответ привести с точностью до целых; Ar(Pd) = 106; F = 96500 Кл/моль.)
Решение
Количественная характеристика процессов электролиза определяется законами, установленными Фарадеем. Закон Фарадея выражается следующим уравнением: m = Э*I*t/F.
Здесь m— масса образовавшегося или подвергшегося превращению вещества; Э — его эквивалентная масса (г/моль); I — сила тока (а); t — время (сек); F — постоянная Фарадея (96500 Кл/моль), т. е. количество электричества, необходимое для осуществления электрохимического превращения одного эквивалента вещества.
Pd3+ + 3e = Pd0
Э(Pd3+) = M(Pd3+)/3=106/3 = 35,3г/моль
m (Pd) = 7,8 мг/дм3* 1000*1000м3/1000 =7800(г)
m (Pd) = Э*I*t/F = 35,3*11,9*t/ 96500 = 7800(г)
t = 7800*96500/35,3*11,9*60*60 = 497,7 час.
t= 497,7 час/24 = 20,7 суток
Задание 65
65. Какой из катионов: Fe3+, Ca2+, Al3+ или Hg2+, содержится в растворе, если:
-
в ходе реакции взаимодействия его раствора с карбонатом натрия образуется осадок, исчезающий при добавлении раствора кислоты; -
при взаимодействии его раствора с гидроксидом калия раствор мутнеет; -
при взаимодействии его раствора с ортофосфорной кислотой выпадает осадок белого цвета; -
при взаимодействии его раствора с бихроматом калия раствор мутнеет и становится желтоватым.
Для выполнения эксперимента в каждую пробирку добавляли только один из реагентов, находящихся в склянках. Подтвердите наличие иона соответствующими уравнениями реакций (если возможно - в молекулярном и ионном виде).
Решение
Рассмотрим 2-ой признак: при взаимодействии раствора катиона с ортофосфорной кислотой выпадает осадок белого цвета.
Так как фосфаты катионов Fe3+ и Hg2+ имеют желтую Hg3(PO4)2 и слабо-желтую окраску(FePO4), то, видимо, эти катионы отсутствуют.
Ca2+ + PO4-3 = Ca3(PO4)2 ↓ осадок белого цвета
Al3+ + PO4-3 = AlPO4 ↓ осадок белого цвета
Согласно 1-ому признаку: в ходе реакции взаимодействия его раствора с карбонатом натрия образуется осадок, исчезающий при добавлении раствора кислоты, определяемый катион не может быть Al3+ , поскольку карбонат алюминия в растворе не существует, а гидролизуется полностью с выделением углекислого газа.
Ca2+ + СO3-2 = CaСO3 ↓ осадок белого цвета
Образуется осадок, исчезающий при добавлении раствора кислоты:
в молекулярном и ионном виде:
2CaСO3 ↓ +2 HCl = Ca(HСO3)2 + CaCl2 осадок CaСO3 ↓ растворяется при добавлении кислоты, например, HCl. Образуется кислая растворимая соль кальция Ca(HСO3)2
в ионном виде:
2CaСO3 ↓ + 2 H+ = 2 HСO3- + 2 Ca+2
Остается Ca2+. Этот катион образует при взаимодействии его раствора с бихроматом калия осадок желтого цвета, и раствор становится желтоватым (соответствует 3-ему признаку).
Ca2+ + CrO4-2 = CaCrO4 ↓
Растворимость CaCrO4 в воде низкая — около 2,27 % (при 19 °С), кристаллическое вещество желтого цвета.
Ответ: Ca2+
Задание 76
76. В чем заключается особенность прямого титрования в сравнении с другими типами титрования? При проведении кислотно-основного титрования 15 мл раствора гидроксида натрия неизвестной концентрации раствором соляной кислоты с молярной концентрацией эквивалента 0,10 моль/л экспериментально определили объем титранта. Он составил 10,5 мл. Рассчитайте массу гидроксида натрия, содержащуюся в 1 л этого раствора. (Ответ приведите в г с точностью до десятых, например 4,2.)
Решение
В любом методе титриметрического анализа существует несколько способов титрования. Различают прямое титрование, обратное титрование и титрование по замещению.
При прямом титровании к раствору определяемого вещества добавляют по каплям титрант до достижения точки эквивалентности.
Схема титрования: X + R = P.
Прямое титрование предполагает непосредственное прибавление титранта к раствору пробы.
νХ = νR
где νХ и νR – количества молей эквивалентов Х и R.
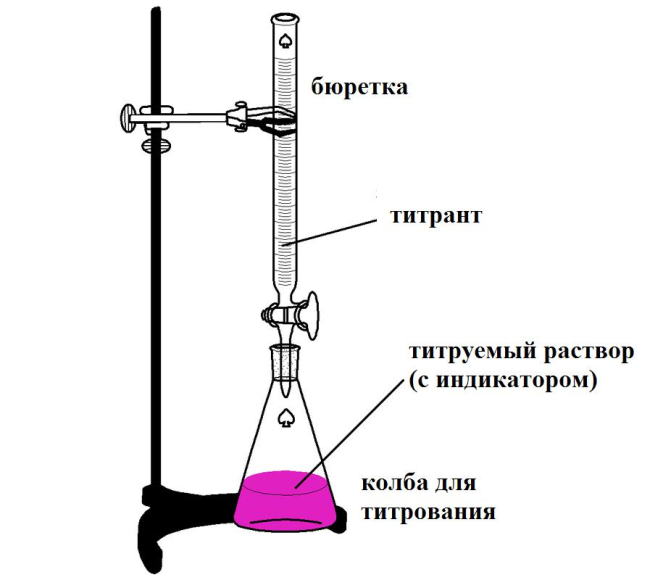
Прямое титрование - удобный и самый распространенный вариант титриметрии. Он более точен, чем другие. Ведь случайные погрешности в основном возникают при измерении объема растворов, а в данном способе титрования объем измеряют только один раз. Однако прямое титрование возможно далеко не всегда. Многие реакции между Х и R идут недостаточно быстро, и после добавления очередной порции титранта в растворе не успевает установиться равновесие. Иногда прямое титрование невозможно из-за побочных реакций или ввиду отсутствия подходящего индикатора. В подобных случаях применяют более сложные схемы обратного или заместительного титрования.
Закон эквивалентов для прямого титрования:
C(1/z) Х VХ = C(1/z) RVR
Количество (массу) определяемого вещества, содержащееся в исследуемом растворе, вычисляют, используя закон эквивалентов (для прямого титрования)
mХ= C(1/z)R VR M(1/z)Х ٠10-3 , (3)
где C(1/z)R – молярная концентрация эквивалента[1] титранта, моль/дм3;
VR – объем титранта, см3;
M(1/z) Х – молярная масса эквивалента определяемого вещества;
C(1/z)Х – молярная концентрация эквивалента определяемого вещества, моль/дм3;
VХ – объем определяемого вещества, см3
Задача
NaOH + HCl = NaCl + H2O
C(1/z) Х VХ = C(1/z) RVR
15 мл*Х = 10,5*0,10
См(NaOH) = 10,5*0,10 /15 = 0,07моль/л
Э(NaOH) = M(NaOH) = 40г/моль
m(NaOH) = 0,07*40г/моль = 2,8 г
Ответ: 2,8 г
Задание 87
87. В процессе получения железа в промышленности возможно использование реакции угля с оксидом железа (III) Fe2O3 + 3C = 2Fe + 3CO Теплота, необходимая для осуществления процесса, обеспечивается горением углерода. Если энтальпии образования оксида железа (III), угарного и углекислого газов равны: –822,16, –111 и –394 кДж/моль соответственно, то для получения 1120 кг железа потребуется _509___ кг углерода. (Потерями углерода на побочные процессы пренебречь; ответ привести с точностью до целого значения; Ar(Fe) = 56.)
Решение
Горение угля, реакция: С + О2 = СО2, при этом выделяется такое количество тепла:
0(СО2). = -394 кдж/моль
Реакция Fe2O3 + 3C = 2Fe + 3CO +Q идет с поглощениемтепла
0х.р. = 3 f0CO - fFe2O30 = - 3*111+ 822,16 = +489,16 кдж/моль
Q =-0