Файл: растырандар Сакипов Н. З., Беркутбаева Р. А., Сугирбекова А. К. Дрістік кешен Физика пні бойынша бб тобы.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 11.01.2024
Просмотров: 235
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Сыртқы потенцалдық өрістегі бөлшектер үшін Больцман таралуы:
Мұндағы
Жер тартылыс өрісінде П=mgh сонда
n=n
Дененің кеңістіктегі орнын толық анықтайтын тәуелсіз координаттар санын еркіндік дәреже саны (i) д.а.
Ол бір атомды молекула (материалдық нүкте) үшін і=3
Екі атомды молекула үшін і=5
Үш және одан көп атомды молекула үшін і=6
Әрбір еркіндік дәрежесіне кТ/2 энергия келеді,
Еркіндік дәрежесі і болған молекуланың энергиясы
E=
Идеал газдың ішкі энергиясы.
U=
Мұндағы v=m/M-зат мөлшері.
Заттың меншікті жылу сиымдылығы -1кг затты 1К-ге қыздыруға кететін жылулық мөлшері c=dQ/mdT (5.17)
Молярлық жылу сыйымдылығы C
Олар арасындағы байланыс C
Газдың тұрақты қысымдағы жылу сиымдылығы (Ср) мен тұрақты көлемдегі жылу сиымдылығы (Сv) арасындағы байланыс
Cp=Cv+R (5.20)
Бұл Майер теңдеуі
Идеал газ үшін
C
Молекула физикасы мен термодинамикада бұл қатынас көп пайдаланылады.
Термодинамиканың 1 бастамасы
-ішкі энергия өзгерісі,А-сыртқы күштерге қарсы орындалатын жұмыс (5.23)-тің дифференциялдық түрі
dQ=dU+dA (5.24)
Изохоралық процесс – V=const болса
Изобаралық процесс – P=const болса
Изотермиялық процесс – T=const болса
Жүйе мен қоршаған орта арасында жылулық алмасу болмаса (dQ=0) процесс адиабаттық деп аталады.
Адиабаттық процесс теңдеуі: (Пуассон теңдеуі)
Цикл деп жүйе көп күйлер арқылы өтіп бастапқы күйге келетін процесті айтады.
Егер циклде оң жұмыс орындалса (
Термодинамикалық оң және теріс бағытта жүре алатын және бұл процесс жүргенде қоршада да жүйеде де ешқандай өзгерістер болмаса мұндай процесс қайтымды деп аталады. Бұл шарттар орындалмаса процесс қайтымсыз деп аталады.
Екі изотермадан және екі адиабатадан тұратын циклді Карно циклі деп атайды, оның пайдалы әсер коэффициенті (п.ә.к.)
мұндағы
Карно теоремасы: бірдей қыздырғыш пен тоңазытқыш температураларға ие болған барлық периодты істеуші жылу машиналарының ішінде қайтымды процеспен істеуші машиналар ең үлкен п.ә.к.-іне ие болады.
Изотермиялық процессте дененің алған жылуының (Q) жылу беруші дененің температурасына (Т) қатнасы келтірілген жылу мөлшері деп аталады.
Дифференциалы
болған күй функциясын энтропия деп атайды.
Қайтымды процестер үшін жабық жүйеде энтропия өзгеруі
Қайтымсыз процестер үшін
Клаузиус теоремасы бойынша жабық жүйенің энтропиясы тек өседі (қайтымсыз процестер үшін) немесе тұрақты болып қалады (қайтымды процестер үшін)
Егер жүйе 1 күйден 2 күйге тепе-теңдік өткенде энтропия өзгеруі
(5.30)
Идеал газ үшін
адиабаттық процесс үшін dQ=0 болғандықтан
Термодинамиканың ІІ бастамасы:
Жабық жүйеде кез келген қайтымсыз процесте жүйенің энтропиясы тек өседі (жабық жүйедегі өтетін процестерде энтропия кемімейді).
Бұл бастаманың тағы екі тұжырымдары:
Кельвин тұжырымы: Қыздырғыштан алған жылуды соған эквивалентті жұмысқа өту жалғыз нәтижесі болатын дөңгелек процесс жүруі мүмкін емес.
Клаузиус тұжырымы: жалғыз нәтижесі кемірек ысытылған денеден көбірек ысытылған денеге жылулық беру болатын дөңгелек процесс жүруі мүмкін емес.
Жүйе күйінің термодинамикалық ықтималдылығы (W) деп макроскопиялық жүйенің берілген күйі жүйеге асу әдістер санын айтады(анықтама бойынша
мұндағы к-Больцман тұрақтысы.
Термодинамиканың ІІІ бастамасы (Нернст-Планк теоремасы) барлық денелердің энтропиясы тепе-теңдік күйде температура Кельвин нуліне жақындағанда нульге ұмтылады:
ЛЕКЦИЯ №6
Тасымалдау құбылысы. Нақты газдар.
-
Тасымалдау құбылысының жалпы сипаттамасы. -
Соқтығысудың орташа саны және газ молекуласының еркін жүру жолының орташа ұзындығы. -
Ван-дер-Ваальс теңдеуі. -
І-ші және ІІ-ші текті фазалық ауысулар.
Тасымалдау құбылыстарына кеңістікте энергия тасымалдау – жылуөткізгіштік, масса тасымалдау – диффузия, импульс тасымалдау – ішкі үйкеліс құбылыстары жатады.
Егер газдың бір бөлігінде молекулалардың орташа кинетикалық энергиясы басқа бөліктеріне қарағанда көбірек болса онда уақыт өтуімен молекулалардың бір – бірімен соқтығысу себебінен олардың орташа кинетикалық энергиялары теңдеседі – демек температуралары теңеседі – бұл жылуөткізгіштік.
Энергияның жылулық түрінде тасымалдауы Фурье заңына бағынады
мұндағы
мұнда
Молекулалардың еркін жүру жолының орташа ұзындығы
Молекулалардың соқтығысуының орташа саны
мұндағы
Бір – бірімен түйіскен екі газ, сұйықтықтың кейде қатты денелер бөлшектерінің бір-біріне өтіп, араласуы диффузия құбылысы болып табылады.
Біртекті газ үшін диффузия Фик заңына бағынады:
тығыздық градиенті,
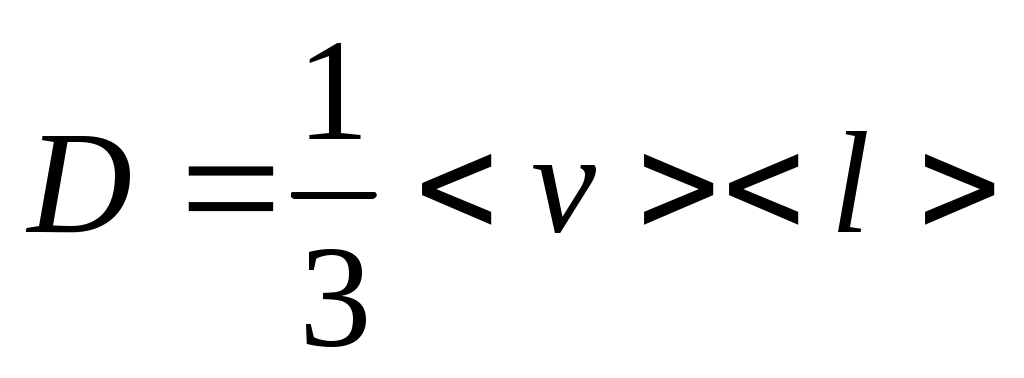
Ішкі үйкеліс әртүрлі жылдамдықтағы газ (сұйықтық) қабаттары арасында молекулалар алмасу нәтижесінде пайда болады.
Ішкі үйкеліс күші Ньютон заңы бойынша:
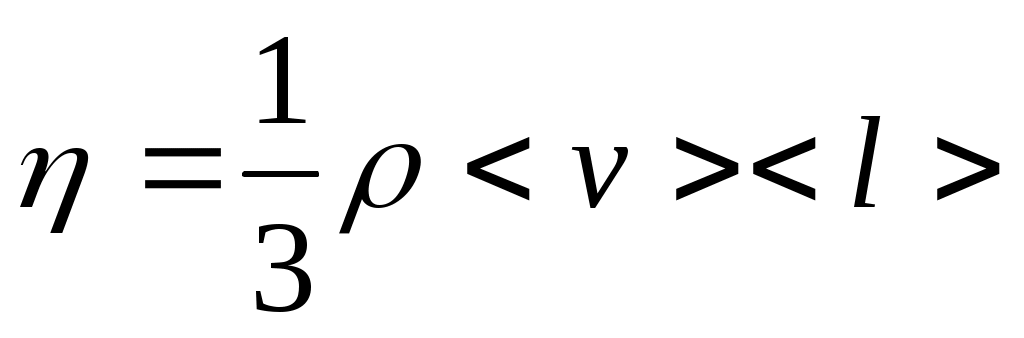 (5.7)
(5.7)Нақты газдарды сипаттайтын теңдеу Клапейрон - Менделеев теңдеуі жуықталған тендеу болып табылады. Ол жеткілікті төмен қысымдар кезінде орындалады жоне де қысым неғүрлым аз болса, оның орындалу дәлдігі солғүрлым жоғары. Біз идеал газды өзара әрекеттеспейтін молекулалардан түратын газ деп алдық, ал молекулалардың өздері материалдық нүктелер болып табылады дедік, яғни біз олардың молшерлерін (колемдерін) ескергеніміз жоқ. Шын мөнісінде молекулалардың меншікті көлемдері де, олардың арасында өзара өрекеттесу күштері де бар. Бүлар әсіресе газдың қысымы жоғарылап, молекулалар тығызырақ орналасқан кезде күштірек біліне бастайды. 16>