Файл: Учебное пособие по химии для учащихся 10 классов, обучающихся в лицеях фдп рниму под редакцией проф. Теплова В. В.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 12.01.2024
Просмотров: 1197
Скачиваний: 9
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
47. При добавлении какого газа к смеси равных объёмов этана и бутана плотность её по азоту не изменится?
48. Определите плотность по водороду газовой смеси, если известно, что пропана в ней в 2 раза больше, чем бутана; этана в 2 раза больше, чем пропана, а метана в 2 раза больше, чем этана.
49. Определите массовую долю метана в смеси с пропаном, если плотность по водороду данной смеси равна 12,8.
50. Карбид алюминия обработали разбавленным раствором соляной кислоты. Выделился газ объёмом 3,36 л (н.у.) . Реакция прошла с выходом 100%. Какая масса карбида алюминия была взята для проведения реакции?
51. 65,6 г ацетата натрия смешали с 40 г гидроксида натрия и прокалили. Рассчитайте объём выделившегося газа (н.у.), если реакция прошла с выходом 100%.
52. Рассчитайте массу хлороформа, которую можно получить из 124 кг етана при 90% выходе.
53. В результате бромирования пропана было получено 246 г бромпропана при 100% выходе. Сколько пропана прореагировало при этом?
54. При хлорировании 31,36 л ( н.у.) метана было получено 196,9 г смеси трихлорметана и тетрахлорметана. Определите массовые доли продуктов хлорирования метана.
55. При хлорировании 101г хлорметана образовалась смесь дихлорметана и трихлорметана в молярном соотношении 1:2. Вычислите объём хлороводорода (н.у.), выделившегося в ходе реакции.
56. Рассчитайте массу тетрахлорида углерода, который можно получить при хлорировании метана объёмом 13,44 л (н.у.) хлором, объём которого равен 78,4л (н.у). Выход продукта составляет 70% от теоретически возможного.
57. Определите объём кислорода, необходимый для сжигания 23 г газовой смеси, состоящей из метана и этана, если плотность газовой смеси по одному из её компонентов равна 0,767.
58. Смесь этана и бутана, средняя молярная масса которой равна 40 г/моль, сожгли. Определить объем полученного углекислого газа, если для сжигания этой смеси потребовалось 28 л кислорода.
59. Для сжигания 10 л ( н.у.) смеси пропана и этана потребовалось
47 л ( н.у.) кислорода. Определите состав смеси алканов
( в %% по объёму).
60. Определите объём кислорода ( при н.у.), который потребуется для сжигания 18 г газовой смеси, состоящей из метана и водорода, с плотностью по водороду 4.
61. Определите объём кислорода ( при н.у.), который потребуется для сжигания газовой смеси, состоящей из водорода и этана с плотностью по гелию равной 1,2: а) 100 л газовой смеси; б)100 г газовой смеси.
62. Определите массовую долю углерода в смеси, состоящей из метана и пропана, если плотность по гелию данной смеси равна 9,2.
63. Определите молекулярную формулу вещества, содержащего
(в %% по массе) 12,78% углерода, 2,13% водорода и 85,09% брома. Плотность паров этого вещества по воздуху рана 6,48.
64. 2-метилбутан пропустили над нагретым платиновым катализатором. При этом плотность газовой смеси уменьшилась на 12%. Определите состав полученной газовой смеси (в % по объему) и выход в реакции дегидрирования.
65. Для сгорания некоторого алкана требуется объём кислорода в 11 раз больший, чем объём паров данного углеводорода при тех же условиях. Определите формулу алкана.
66. При сгорании алкана массой 5,8 г образуется углекислый газ объёмом 8,96 л (н.у.). Какой объём кислорода (н.у.) потребуется для реакции?
67. Продуктами горения углеводорода массой 17,6г являются оксид углерода (IV) и вода массой 28,8 г. Какой объём кислорода был затрачен в процессе горения?
68. Смешали 2,24 л (н.у.) метана и 25 л (н.у.) воздуха. Смесь подожгли. Вычислите объёмные доли веществ после конденсации паров воды.
69. Смешали 3 г этана и 100 л (н.у.) воздуха. Смесь подожгли. Вычислите бъёмные доли веществ после конденсации паров воды.
70. Сколько металлического натрия необходимо для получения по методу Вюрца 0,25 моль этана?
71. При нагревании бромметана массой 3,85г с металлическим натрием массой 1,15г получили этан, объём которого равен 358,4 мл (н.у.). Определите выход продукта реакции.
72. Из реакционной смеси, полученной при взаимодействии алкана с бромом, с помощью дистилляции была выделена жидкость, атомное соотношение элементов в которой составляет С : Н : Br = 6 : 13 : 2. Назовите алкан, полностью охарактеризуйте жидкость и сделайте предположение о других возможных продуктах реакции. Ответ поясните.
Глава 3. АЛКЕНЫ
Алкены – углеводороды, в молекуле которых имеется одна связь C=C. Первые три члена ряда С2 – С4 - газообразные вещества, от С5- С17 – жидкости, С18 – и выше – твердые вещества.
Электронные орбитали атомов углерода, образующих двойную связь, находятся в состоянии sp2-гибридизации. Атомы углерода соединены одной σ- и одной π – связями: sp3 sp3 sp 2 sp2
CH3− CH2 − CH = CH2 (бутен-1)
Для алкенов возможна структурная и пространственная изомерия(геометрическая).
Структурные изомеры:
СH3−CH2− CH2−CH=CH2 СH3−CH2 − CH=CH−CH3
пентен-1 пентен-2
СH3− CH − CH=CH2 СH3− CH −C=CH2
| |
CH3 CH3
3-метилбутен-1 2-метилбутен-1
СH3 − C=CH − CH3
|
CH3
2-метилбутен-2
Пространственные изомеры:
H H H C2H5
\ / \ /
С = С С = С
/ \ / \
CH3 C 2H5 СН3 Н
цис-пентен-2 транс-пентен-2
Алкены с концевой двойной связью и алкены, имеющие одинаковые заместители у sp2 – гибридизированного атома углерода, пространственных изомеров не имеют.
3.1. Получение алкенов
1. Крекинг и пиролиз нефтепродуктов
2. Каталитическое (Ni, Pt, Pd) дегидрирование алканов при нагревании
С4Н10
3. Из галогенпроизводных, действуя спиртовым раствором щелочи:
спирт
CH3 − CН − CH − CH3 + КОН
| | |
СН3 Br СН3
4. Из спиртов в присутствии кислоты при нагревании:
Н+
CH3 − CH 2 − CH2 − ОН
Н+
СH3 − CН(ОН) − CH2−CH3
Отщепление воды и галогеноводородов происходит по правилу Зайцева: атом водорода отщепляется от наименее гидрогенизированного атома углерода, т.е. атома, который связан с меньшим числом атомов водорода.
5. Из дигалогенпроизводных под действием активных двухвалентных металлов(Zn, Mg) при нагревании.
CH3−CН−CH −СН2−СН3 + Zn
| |
Br Br
3.2. Химические свойства алкенов
1. Для алкенов характерны реакции электрофильного присоединения(ионного) АЕ , которые протекают с разрывом π- связи.
а) Гидрирование каталитическое (Ni, Pt, Pd) при нагревании :
CH3−CН = CH2 + Н2
б) Галогенирование ( Hal2- Cl2, Br2, I2): Br Br
CCl4 или Н2О | |
CH3−C=CH2 + Br2
| |
CH3 CH3
в) Гидрогалогенирование - присоединение HHal( HCl, HBr, HI)
CH3−C=CH−CH3 + HBr
| |
CH3 CH3
г) Гидратация -присоединение воды в кислой среде при нагревании:
OH
|
CH3−C=CH−CH3 + H2O
| |
CH3 CH3
Присоединение галогеноводородов и воды в основном протекает по правилу Марковникова: атом водорода присоединяется к наиболее гидрогенизированному атому углерода, т.е. к атому, который связан с большим числом атомов водорода. Но есть исключения из этого правила.
CH2−CH=CH2 + HCl
| |
NO2 NO2
CH2=CH−COOH + HBr
|
Br
2. Реакции полимеризации:
t
n CH3−CH=CH2
AlCl3 |
СН3
3. Реакции окисления
а) реакции мягкого окисления водным раствором перманганата калия
-1 -2 +7 0 -1
3 CH3−CH=CH2 + 2 KMnO4 + 4 H2O
+2MnO2 | |
OH OH
-1 0
C - 1 е → C
-2 -1 процесс окисления
C - 1 е → C
+7 +4
Mn + 3 е → Mn процесс восстановления
Эта реакция обесцвечивания раствора перманганата калия является качественной реакцией на алкены, как и реакция обесцвечивания бромной воды.
б) действие жестких окислителей ( азотной кислоты, перманганата калия и дихромата калия в кислой среде) приводит к разрыву молекулы алкена по месту расположения двойной связи с образованием кислот и кетонов:
CH3CH=CH + 2KMnO4 + 3H2SO4
CH3COOH + CO2 + 2MnSO4 + K2SO4 + 4H2O
CH3−C(CH3) = CH –CH3 + K2Cr2O7 + 4H2SO4
CH3−C(O)СН3 + CH3COOH + Cr2(SO4)3 + 4H2O + K2SO4
ацетон
в каталитическое окисление кислородом:
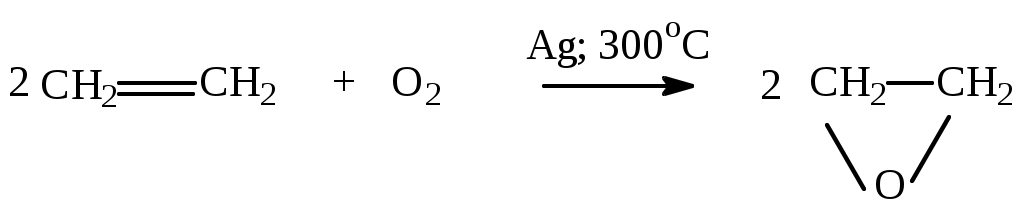
г) реакции горения
CnH2n + 3n/2 O2
3.3. Примеры решения задач
Пример 12. Газовую смесь, состоящую из этена и водорода и имеющую плотность по водороду 3,6, пропустили над нагретым никелевым катализатором. При этом образовалась газовая смесь с плотностью по водороду 4,23. Определить выход в реакции гидрирования и состав полученной газовой смеси (в % по объему).
Решение:
Поскольку в условии задачи заданы только относительные значения
( т.е. величины, не зависящие от количества вещества – относительная плотность) и необходимо определить также относительные величины
( состав, выход в реакции), для упрощения расчетов зададимся каким-либо абсолютным значением.
1) Пусть количество моль исходной смеси n(см1) =1 моль,
Исходная газовая смесь(смесь 1): С2H4 и H2
2) Вычислим среднюю молярную массу этой смеси
Мср. (см1)= D(см1)∙М(Н2) = 3,6 ∙ 2 = 7,2 г/моль,
3) Тогда масса смеси (1):
m(см1) = М (см1) ∙ n(см1) = 7,2 ∙ 1 = 7,2 г.
4) Пусть n(С2H4)= х моль; n(H2)= у моль.
Составим систему уравнений и решаем её:
х + у = 1 x = 0,2
28 х + 2у = 7,2 y = 0,8
Таким образом, исходная смесь состоит из 0,8 моль С2H4 и 0,2 моль H2.
5) После реакции гидрирования:
С2H4 + H2 = С2H6
получим смесь (2): С2H4, H2 и С2H6.
Вычислим среднюю молярную массу этой смеси
Мср. (см2)= D(см2)∙М(Н2) = 4,23 ∙ 2 = 8,46 г/моль.
6) Поскольку, согласно закону сохранения массы, общая масса веществ, вступающих в химическую реакцию, равна общей массе продуктов реакции; масса газовой смеси в результате гидрирования не меняется,
m(см1) = m (см2) = 7,2 г.
7) Вычислим количество вещества конечной газовой смеси (смеси 2):