Файл: Дрі Химиялы жне фармацевтикалы технологияны негізгі процестерін жіктеу. Химиялы ндірісті отайландыру.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 12.01.2024
Просмотров: 753
Скачиваний: 1
СОДЕРЖАНИЕ
Сорғыштың негізгі параметрлері:
Ас тұзы бар ерітіндіден тұзды бөлу үшін, суды қыздырады. Су буланады да, тұз түбінде қалады:
Арал теңізінің жағалауында бұндай тұз көп мөлшерде кездеседі:
Бұл тұз теңіз суының құрамында еді. Кейін су буланып, тұз қайта кристалданып жерде қалды.
Суды қыздырып, буға айналдырып, басқа жерде су буын суытып қайтадан суға айналдыруға болады:
Бұны айдау әдіс деп атайды. Бұл әдістің тағы бір аты - дистилдеу әдісі.
Қоспалардың құрамына және қасиетіне қарай әр түрлі бөлу әдістері қолданылады.
Магнитпен қоспдадан бөлу әдісі.
Суспензияны құр -қатты заттарды сұйық көлемге теп тегіс таратуды қамтамасыз ету;
Қыздыру мен салқындатудың интенсификациясы;
Салмақ ауысу интенсификациясы араластыру жүйесінде (еріту, сілтілеу).
Механикалық- бұлғылауышпен араластыру, аппаратта араласатын оратмен айналады.
Үрдістің тиімділік көрсеткіші- Қоспадағы алынатын заттың концентрациясы.
Механикалық араластыру үрдісінің теориялық маңызы
Критерий Рейнольдса Reм (19.2)
мұнда dм - бұлғылаушының диаметрі, м;
n - бұлғылаушының айналу жылдамдығы, айн /с;
r - сұйықтық тығыздығы, кг/м^3;
Nм -бұлғылаумен жұмыс істеуге кететін қуаттылық, вт;
m - динамикалық тұтқырлық Па*с;
Механикалық араластыру үрдісінің технологиялық –құрылымыдық шамасын есептеу әдісі
1. Бұлғылау түрін таңдау оның диаметрі dм, аппарат өлшемі Daпп и Hапп.
2. Аппаратың түрі мен өлшеміне байланысты коэффициент Сt анықтаймыз.
3. Бұлғылаудың айналу санын анықтайды:
5. Сызба бойынша KN= f(Reм) тауып алады KN.
6. т Nм 2 теңдеуден тауып алады:
7. Құрылғыны айналдыратын өткізгішттің қуаттылығын есептейді Nдв:
Мұнда К- құрылғыны араластыратын және аппаратың құрылымын есептейтін түзету коэффициенті;
Бастапқы компонент бойынша материалдық баланс
Барлық заттар бойынша материалдық баланс
(19.8) және (19.9) алатынымыз:
Басқарылатын айнымалылар – Ссм және hсм.
Сұйық орталарды араластырудың негізгі үш тәсілі болады:
1) механикалық - әртүрлі құрылысты араластырғыштар жәрдемімен;
2) пневматикалық - сығылған ауа немесе инертті газдар жәрдемімен;
3) циркуляциялық - насостар немесе соплалар жәрдемімен.
1) салыстырмалы түрде көп энергия шығыны;
1) механикалық - әртүрлі құрылысты араластырғыштар жәрдемімен;
2) пневматикалық - сығылған ауа немесе инертті газдар жәрдемімен;
3) циркуляциялық - насостар немесе соплалар жәрдемімен.
1) салыстырмалы түрде көп энергия шығыны;
Центрифугалау дегеніміз - центрифугалық күш әсерінен суспензиялар мен эмульсияларды бөлу процесі.
Электрлік тазарту - электр күштерінің әсерінен газды тазарту.
2.Бөлу процесстерінің түрлері?
Адсорбция процесі өндірісте газдарды құрғатуда және тазалауда, ерітінділерді тазалауда және мөлдірлендіруде, булы немесе газды қоспаларды ажыратуда (мысалы, ауадағы ұшқыш еріткіштерді немесе газдарды) және т.б. кеңінен қолданылады.
Адсорбция екі түрлі болады: физикалық және химиялық (хемосорбция).
Физикалық адсорбция адсорбат және адсорбент молекулаларының арасындағы Ван-дер-Ваальс күші әсерінен өзара тартылуы нәтижесінде өтеді де, химиялық әрекеттеспейді.
Химиялық адсорбцияда сіңірілетің зат молекулалары арасында химиялық байланыс болады. Булар сіңірілгенде адсорбент кеуектері будың конденсатымен (сұйықпен) толтырылады (капилярлық конденсация).
Адсорбент ретінде заттың массасының бірлігінде үлкен меншікті бетке ие болатын кеуекті қатты заттар пайдалынады. Адсорбенттердің кеуектерінің (капиллярлық каналдарының) диаметрі бойынша макрокеуектер (d210-4 мм), өтпелі кеуектер (d = 610-6 210-4 мм) және микрокеуектер (d 6 10-6 мм) болып бөлінеді. Адсорбция процесі кеуектер өлшемдерімен анықталады.
Макрокеуектердің меңшікті беті аз, сондықтан олардың қабырғасына өте аз зат сіңіріледі. Олар сіңірілетің молекулалар үшін тасымалдау канал ролін атқарады. Өтпелі кеуектердің өлшемдері сіңірілетің молекулалар өлшемдерінен үлкен болады және адсорбция процесінде заттың қабаттары пайда болады. Қабаттың қалындығы бір молекулаға (мономолекулалық алсорбция) бірнеше молекулаға (полимолекулалық адсорбция) тең болуы мүмкін. Микрокеуектердің өлшемдері сіңірілетің заттың молекуласына жақын болады және адсобцияда олардың көлемі толтырылады. Осының салдарынан микрокеуектердің бетіңде сіңірілген заттың қабаты болады деген болжамның физикалық мәні болмайды.
Адсорбенттер олардың масса немесе көлем бірлігіндегі адсорбаттың концентрациясымен анықталатын, сіңіргіштік қабілетімен (активтігімен) сипатталады. Сіңіргіштік қабілеті температураға, қысымға және сіңірілетін заттын концентрациясына байланысты болады. Адсорбенттер статикалық және динамикалық сіңіргіштігпен сипатталады.
Біраз уақыт жұмыс істегеннен кейін адсорбент сіңірілетін затты толығымен сіңіре алмайды. Сондықтан адсорбент қабатынан сіңірілетін заттың өтуі байқала бастайды. Осы сәттен бастап сіңірілетің заттың аппараттан шығатын газды қоспадағы концентрациясы тепе-тендік орныққанға дейін көбейеді.
Адсорбция басталғаннан сіңірілетін заттын өтуіне дейінгі уақыт аралығында адсорбенттің масса (немесе көлем) бірлігімен сіңірілген заттың мөлшері, оның динамикалық сіңіргіштігін анықтайды.
Адсорбция басталғаннан тепе-тендік орныққанға дейнгі уақыт аралығығында адсорбенттің масса (немесе көлем) бірлігімен сіңірілген заттың мөлшері, оның статикалық сіңіргіштігін анықтайды.
Динамикалық сіңіргірштік барлық уақыт статикалық сіңіргіштен аз болады, сондықтан адсорбент мөлшері динамикалық сіңіргіштігі бойынша анықталады.
Өндірісте кеңінен қолданылатын адсорбенттер:
Силикагель -кремний қышқылының гелі. Меншікті беті – 400770 м2/г. Түйіршіктер өлшемі 0,27 мм; үйінді тығыздығы - 100800 кг/м3. Силикагель негізінен газдарды құрғату үшін қолданылады. Артықшылығы: жанбайтындығы, механикалық беріктігі.
Активті көмір -құрамында көмірі бар заттар (қазынды көмір, ағаш, сүйектер және т.б.) құрғақ айдау жолымен алынады. Меншікті беті – 6001700 м2/г. Түйіршіктер өлшемі 15 мм; үйінді тығыздығы - 350450 кг/м3 . Әрекетті көмірлер органикалық заттарды жақсы сіңіреді. Кемшілігі: жанғыштығы, сондықтан жоғары температураларда пайдалануға болмайды.
Цеолит. Адсорбент ретінде негізінен синтетикалық цеолиттер қолданылады. Цеолиттердің кеуктері жүқа оның қимасы молекула өлшеміне жақын болады; кеуктердің өлшемі біркелкі. Цеолиттердің суды сіңіргіштік қабілеті жоғары, сондықтан, газдарды және сұйықтарды құрғатуда, тазалауға қолданылады. Түйіршіктер өлшемі - 25 мм.
Адсорбция процестерің өткізуге арналған адсорберлердің төмендегі түрлері болады:
1) адсорбент қабаты қозғалмайтын;
2) адсорбент қабаты қозғалмалы (жылжымалы);
3) адсорбент қабаты жалған сұйылған.
Адсорбент қабаты қозғалмайтын адсорберлердің құрылымы қарапайым болып, мерзімді әрекетте жұмыс істейді.
Мұндай аппараттар мерзімді әрекетте жұмыс істейді және процес төрт сатыдан құралады:
1.Адсорбция;
2.Десорбция (адсорбентті су буымен регенерациялау);
3.Адсорбентті құрғату (ыстық ауамен);
4.Адсорбентті суыту (суық ауамен).
Үздіксіз әрекетті қондырғы кемінде екі аппараттан құралады: Біреуінде адсорбция, ал еіншісінде десорбция өткізіледі. Аппараттарды ауыстырып қосу автоматтандырылған.
Сұйық немесе қатты заттардың қоспасынан бір немесе бірнеше заттарды таңдап ерітетін еріткіштер (экстрагенттер) жәрдемімен айырып алу процесі экстракция деп аталады. Экстракциялық процестердің екі түрі болады: Сұйық-сұйық жүйелеріндегі (сұйық фазалы) экстракция; қатты дене сұйық жүйелеріндегі (қатты фазалы) экстракция.
Экстракция процестері қоспалардан қымбат бағалы заттардың айырып алуда, сұйықтарды тазалауда және қатты денелерден заттарды ажыратуда немесе оларды тазартуда кеңінен қолданылады.
Сұйық фазалы экстракция мұнай-химия және химия өндірісінің салаларында органикалық синтез өнімдерін және сирек элементтерді таза күйінде алуда, ағынды суларды тазалауда және т.б. қолданады.
Көпшілік жағдайда экстракция процесі ректификация процесінен бұрын өткізіледі. Бұл кезде қоспаларды ректификациямен ажыратуға жұмсалатын жылу мөлшерін көп азайтады.
Сұйық-сұйық жүйелерінің тепе-теңдігі арқылы экстракт пен рафинаттағы ажыратылатын құрастырушының шекті концентрацияларын анықтайды. Тепе-теңдік концентрация мәндері таралу коэффициенті m немесе экстракция изотермиясы Уf =F(X) бойынша анықталады.
Экстракттағы ажыратылатын құрастырушының тепе-теңдік концентрациясының (У*) осы құрастырушының рафинаттағы тепе-теңдік концентрациясына (Х) қатынасы таралу коэффициенті деп аталады:
m= У*/Х,
m-нің мәні бойынша еріткіштің экстракциялық қабілетін анықтайды:
m-қаншалықты көп болса, еріткіштің ажыратылатын құрастырушыны айыру қабілеті соншалықты көп болады. Экстракцияланатын жүйедегі m-нің мәні 1-ден 10000 дейін болады.
Еріткіштің айырғыш қабілеті экстракцияның ажырату факторымен анықталады:
β=m 1/m2=У1Х2 /У 2 Х1 =У 1 /У2 :Х1 /Х2
Нақты жағдайларда β-ның мәні 2-ден аз болмау керек. Ажырату факторы (β) экстракттағы тепе-теңдік концентрациялар қатынасының рафинаттағы тепе-теңдік концентрациялар қатынасынан қанша есе көп екендігін көрсетеді.
Ертінділер және балқымалардан қатты фазаның кристалл күйінде бөлініп шығу процесі кристалдану процесі деп аталады. Химия өндірісінде кристалдану процесі тұздар және таза қатты заттар өндіруде қолданылады.
Ертінділердегі кристалдану процесі қатты заттың шектеулі ерігіштігіне негізделген. Аса қаныққан ерітінділерден еріген заттың артықша мөлшері кристалданып бөлінгенде ерітінді қаныққан болады. Бұл ертіндіні қалдық ертінді /маточный раствор/ деп атайды. Қалдық ерітіндіні кристалдан центрифугалау және т.б. тәсілдермен ажыратады.
Қаныққан ерітіндінің концентрациясы температура көбейген сайын артады және еріген зат пен еріткіштің қасиеттеріне байланысты болады.
Көптеген қатты заттардың ерігіштігі температура көбейген сайын артады, ал кейбір заттардың ерігіштігі азаяды.
Кристалдану процесі екі сатыдан құралады: кристалдану орталықтарынаң пайда болуы және қристалдардың өсуі. Кристалдану центрлері аса қаныққан ерітінділерде өздігінен пайда болуы мүмкін. Бұл кезде екі процесте (центрдің пайда болуы және кристалдың өсу) бірдей өтеді.
Егер центрлердің пайда болуы жылдамдағы оның өсу жыладамдығынан көп болса, онда қөптеғен майда кристалдар пайда болады. Егер өсу жылдамдығы центрлер пайда болу жылдамдығынан көп болса, ірі кристалдар пайда болады. Кристалдану процесінің жылдамдығы ерітіндінің аса қанығу дәрежесіне, араластыру қарқындылығына және т.б. байланысты болады.
Кристалдардың қасиетіне төмеңдегі факторлар әсер етеді: кристалдар пішіні, оның өлшемі мен фракциялық құрамы және алынатын қристалдың тазалығы.
Кристалдар пішіні кристалданатын заттың табиғатымен анықталады және ерітіндідегі қоспаларға байланысты болады. Мысалы, таза су ерітіндісімен хлорлы калий куб пішіңді, ал ерітіндіде мочевина болса - октаэдрлі куб пішінді кристалданады. Кристалдардың өлшемі олардың өсу жылдамдығына байланысты.
Температура және ерітінді концентрациясының шегін азайтқанда майда кристалдар азаяды да, кристалдардың фракциялық құрамын өзгертеді. Майда кристалдардың сыртқы беті үлкен болғаңдықтан, оларда қалдық ерітінді көп қалып қояды, яғни кристалдардың тазалығы азаяды. Өте таза кристалдар алу үшін оларды қайтадан кристалдандырады.
Оларадағы қалған ерітінді жуу және кептіру арқылы шығарады. Кристалдану тәсілдері және кристаллизаторлар түрлері
Кристалданудын төмендегі тәсілдері жиі қолданылады:
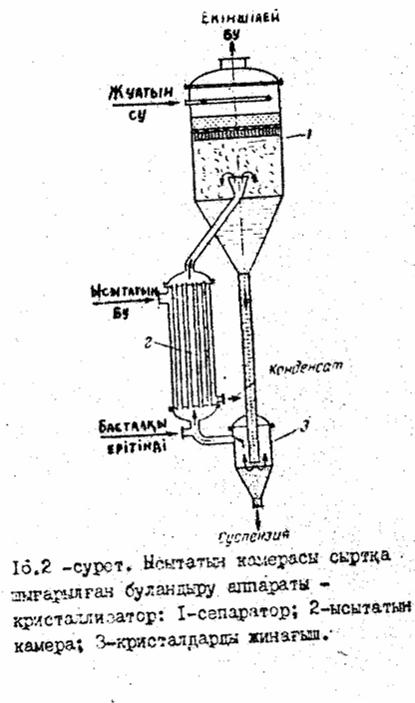
1) Еріткіштің бір бөлігін шығару арқылы кристалдау. Бұл тәсілде еріткіштің бір бөлігі буландыру аппаратында буланады да, ерітінді аса қанығып, осы аппаратта кристалданады. Ерітіндіде кристалдардың пайда болуына байланысты буландыру аппараттарының құрылысына өзгерістер енгізіледі. 16.2-суретте ысытатын камерасы сыртқа шығарылған буландыру аппараты - кристаллизатор көрсетілген. Жылу мөлшерін азайту мақсатында процесті көп корпусты қоңдырғыда өткізеді.
Материалдан ылғалды буландыру арқылы шығару процесі кептіру деп аталады. Кептіруде материалға жылу беріледі және нәтижесінде ылғал буланады. Кептірілетін материалдарға жылуды беру тәсіліне байланысты кептірудің төмендегі түрлері болады:
Конвективті кептіру- кептірілген материал мен кептіргіш агенттің (ысытылған ауа, оттық газдар және т.б.) тікелей жанасуы арқылы;
Контактілі кептіру- жылу тасымалдағыштан кептірілетін материалға жылу қабырға арқылы беріледі;
Радиациялық кептіру -инфроқызыл сәулелердің жылуы арқылы;
Диэлектрикті кептіру
-жоғары жиілікті электр тоғының жылуы арқылы;
Сублимациялық кептіру терең вакуумда тоңазыту күйінде кептіру.
Конвективті кептіруде кептіргіш агент материалға жылу береді және өзімен бірге буланған ылғалды алып кетеді, яғни ол жылу және ылғал тасымалдағыш ролін атқарады. Ылғал газ құрғақ газ және су буы қоспасынан тұрады. Ылғал газ орнына ылған ауаны қабылдап, оның физикалық қасиеттерін қабылдаймыз. Ылғал төмендегі негізгі қасиеттермен сипатталады:
1.Абсолютті ылғалдылық 1 м3 ылғал ауадағы су буының мөлшерімен анықталады. Техникалық есептеулерде ылғал ауа идеал газ заңына бағынады деп есептеуге болады.
2.Салыстырмалы ылғалдылық немесе ауаның қанығу дәрежесі берілген шарттағы 1 м3 ылғал ауадағы су буыныңмассасының осы көлемде мүмкіндігінше көп бола алатын су буының массасына (қаныққан бу тығыздығына) тең:
3. Ылғал мөлшері 1 кг құрғақ ауаға сәйкес келетін су буының мөлшерін көрсетеді
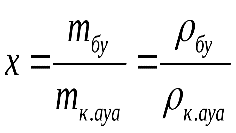
Кептірілетін материалдың мөлшері бойынша материалдық баланс кептірудің конвективті, контактілі және басқа түрлеріне бірдей болады.
Кептіруге берілетін материалдың жалпы мөлшері бойынша материалдық баланс:
Абсолютті құрғақ материалдың мөлшері бойынша материалдық баланс:
Кептіргіштерді есептегенде кептіру жылдамдығын анықтау керек. Материал бетінің бірлігінене буланған ылғал мөлшері кептірудің жылдамдығы деп аталады, яғни
Кептіру жылдамдығы масса алмасу процесінің жылдамдығы сияқты масса өтудің негізгі теңдеуінен анықталады:
Бақылау сұрақтары
1.Диффузиялық коэффициент және молекулярлық диффузия коэффициенттерін процесі неге байланысты?
2.Термодиффузия дегеніміз не?