ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 12.01.2024
Просмотров: 44
Скачиваний: 4
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Областное государственное автономное
профессиональное образовательное учреждение
«Новгородский химико-индустриальный техникум»
15.02.14 Оснащение средствами автоматизации технологических
процессов и производств (по отраслям)
(код, название профессии)
КУРСОВАЯ РАБОТА
Тема: Химические источники тока
Учебная дисциплине: Основы электротехники и электроники
Пояснительная записка
Руководитель работы ________ Студент гр. 1 АТП Голубев Кирилл
Гулецкий Евгений Николаевич Михайлович
______________________________
(должность, фамилия, инициалы) (фамилия, имя, отчество)
______________________________
(подпись) (подпись)
______________________________
(дата)
Великий Новгород
2023
ЗАДАНИЕ
НА ВЫПОЛНЕНИЕ КУРСОВОЙ РАБОТЫ
Специальность 15.02.14 Оснащение средствами автоматизации технологических процессов и производств (по отраслям)
Группа 1 АТП
Студент Голубев Кирилл Михайлович
Тема курсовой работы: Химические источники тока
Исходные данные к работе:
Справочная литература
Нормативная документация
Содержание пояснительной записки:
Введение.
1) История химических источников тока; 2) Принцип работы химического источника тока; 3) Устройство аккумуляторной батареи; 4) Классификация аккумуляторов
5) Расчетная часть
6) Охрана труда
Заключение.
Список литературы.
Графическая часть
Схема аккумулятора
Дата выдачи задания
Дата сдачи готовой работы
Руководитель выпускной
работы Е.Н. Гулецкий
(подпись) (расшифровка подписи)
Студент К.М. Голубев (подпись) (расшифровка подписи)
СОДЕРЖАНИЕ
Введение………………………………………………………….4
1) История химических источников тока……………………....5
2) Принцип работы химического источника тока……………..8
3) Устройство аккумуляторной батареи………………………12
4) Классификация аккумуляторов…………………………..…17
5) Расчетная часть………………………………………..……..21
6) Охрана труда…………………………………………………31
Заключение……………………………………………………...34
Список литературы……………………………………………..35
ВВЕДЕНИЕ
Химические источники тока - это устройство, в котором химическая энергия активных веществ при протекании окислительно-восстановительных процессов превращается непосредственно в электрическую энергию. Химические источники тока подразделяются на первичные источники, или элементы, и вторичные, или электрические аккумуляторы. Элементы могут использоваться до тех пор, пока в них есть запас активных веществ, обеспечивающих образование электрической энергии. При полном израсходовании этих веществ элементы становятся непригодными для дальнейшего использования. Аккумуляторы могут служить непосредственно долгое время. При использовании активных веществ при разряде. Эти вещества могут вновь образовываться при пропускании через аккумулятор в обратном направлении постоянного электрического тока от другого источника. Такой процесс регенерации израсходованных активных веществ называется процессом заряда аккумулятора. Области применения аккумуляторов постоянно расширяются вместе с развитием новой техники и новых технологий. Они применяются в различных областях народного хозяйства, военной промышленности, авиации, железнодорожном и автомобильном транспорте, многочисленных электронный устройств, в ракетной технике и быту.
1) ИСТОРИЯ ХИМИЧЕСКИХ ИСТОЧНИКОВ ТОКА
Первый химический источник тока был изобретён итальянским учёным Алессандро Вольта в 1800 году. Это был элемент Вольта - сосуд с солёной водой с опущенными в него циноквой и медной пластинками, соединенных проволокой. Затем учёный собрал батарею из этих элементов, которая в последствии была названа Вольтовым столбом. Это изобретение использовали другие учёные в своих исследованиях. Так, например, в 1802 году русский академик В.В. Петров сконструировал Вольтов столб из 2100 элементов для получения электрической дуги. В 1836 году английский химик Джон Дэниель усовершенствовал элемент Вольта, поместив цинковый и медный в раствор серной кислоты. Эта конструкция стала называется "элементом Даниэля" [1]. В 1854 году немецкий военный врач Вильгельм Зинстеден наблюдал следующий эффект: при пропускании тока через свинцовые электроды, погруженные в разведенную серную кислоту, положительный электрод покрывался двуокисью свинца PbO2, в то время как отрицательный электрод не подвергался никаким изменениям. Если такой элемент замыкали потом накоротко, прекратив пропускание через него тока от постоянного источника, то в нем появлялся постоянный ток, который обнаруживался до тех пор, пока вся двуокись свинца не растворялась в кислоте. Таким образом, Зинстеден вплотную приблизился к созданию аккумулятора, однако он не сделал никаких практических выводов из своего наблюдения. Только пять лет спустя, в 1859 году, французский инженер Гастон Планте случайно сделал то же самое открытие и построил первый в истории свинцовый аккумулятор. Этим было положено начало аккумуляторной техники. Аккумулятор Планте состоял из двух одинаковых свинцовых пластин, навитых на деревянный цилиндр. Друг от друга они отделялись тканевой прокладкой. Устроенный таким образом прибор помещали в сосуд с подкисленной водой и соединяли с электрической батареей. Спустя несколько часов, отключив батарею, можно было снимать с аккумулятора достаточно сильный ток, который сохранял в течение некоторого времени свое постоянное значение. Существенным недостатком аккумулятора Планте была его небольшая емкость - он слишком быстро разряжался. Вскоре Планте заметил, что емкость можно увеличить специальной подготовкой поверхности свинцовых пластин, которые должны быть по возможности более пористыми. Чтобы добиться этого, Планте разряжал заряженный аккумулятор, а затем опять пропускал через него ток, но в противоположном направлении. Этот процесс формовки пластин повторялся многократно в течение приблизительно 500 часов и имел целью увеличить на обеих пластинах слой окиси свинца. До тех пор, пока не была изобретена динамо-машина, аккумуляторы представляли для электротехников мало интереса, но когда появилась возможность легко и быстро заряжать их с помощью генератора, аккумуляторы получили широчайшее распространение. В 1882 году Камилл Фор значительно усовершенствовал технику изготовления аккумуляторных пластин. В аккумуляторе Фора формирование пластин происходило гораздо быстрее. Суть усовершенствования Фора заключалась в том, что он придумал покрывать каждую пластину суриком или другим окислом свинца. При заряжении слой этого вещества на одной из пластин превращался в перекись, тогда как на другой пластине вследствие реакции получалась низкая степень окисла. Во время этих процессов на обеих пластинах образовывался слой окислов с пористым строением, что способствовало скоплению выделяющихся газов на электродах. В начале XX века усовершенствованием аккумулятора занялся Томас Эдисон, который хотел сделать его более приспособленным для нужд транспорта. В результате были созданы железно-никелевые аккумуляторы с электролитом в виде едкого калия, т.н. щелочные аккумуляторы. В 1903 году начинается производство новых портативных аккумуляторов, которые получили широкое распространение в транспорте, на электростанциях и в небольших судах. Сначала корпуса аккумуляторов были деревянными, потом эбонитовыми. Аккумуляторные батареи формировались из нескольких элементов, каждый из которых имел рабочее напряжение около 2,2 вольт. Для шестивольтовых аккумуляторов в одном корпусе последовательно соединялись три элемента, для 12-вольтовых - шесть, для 24-вольтовых - двенадцать. Для легковых автомобилей 6-вольтовая электросистема была общепринятой почти полвека, и только в 50-х годах произошел массовый переход на 12 вольт. Эбонитовые корпуса батарей с торчащими наружу или залитыми мастикой перемычками между элементами постепенно уступили место более легким и прочным полипропиленовым. Пионером в применении синтетических материалов для корпусов аккумуляторов выступила в 1941 году австрийская фирма Baren, а полипропилен начала использовать американская фирма Johnson Controls в середине 60-х. В конструкции свинцово-кислотных аккумуляторов произошли и другие изменения, повлиявшие на их параметры и срок службы.
2) ПРИНЦИП РАБОТЫ ХИМИЧЕСКОГО ИСТОЧНИКА ТОКА
Кислотные аккумуляторы представляют собой сосуд, заполненный электролитом соответствующей плотности, т. е. раствором серной кислоты H2SO4 в дистиллированной воде, в который погружен блок пластин из чистого свинца Рb и блок пластин из перекиси свинца РbО2. Вследствие постоянно происходящей диссоциации молекул кислоты в электролите заряженного аккумулятора имеются ионы водорода Н2 (катионы) и ионы кислотного остатка SO4 (анионы). Если пластины аккумулятора замкнуть на некоторое сопротивление, то через него потечет ток. Отрицательно заряженные ионы SO4 будут стремиться к пластинам из чистого свинца, заряженным положительно. Ионы водорода, имеющие положительный заряд, будут стремиться к отрицательным пластинам, содержащим двуокись свинца. Пластины из свинца принято называть отрицательными, а из двуокиси свинца положительными. При разрядке кислотного аккумулятора происходят следующие химические реакции:
- у отрицательной пластины Pb + SO4 = PbSO4
- у положительной пластины РbО2 + H2+H2SO4=PbSO4+2H2O
Из рассмотренных химических реакций видно, что при разрядке кислотных аккумуляторов на всех пластинах выделяется сернокислый свинец PbSO4 и уменьшается концентрация электролита (вследствие диссоциации кислоты и выделения воды). Сернокислый свинец обладает двумя недостатками. Во-первых, при интенсивном образовании сернокислого свинца возможно коробление или выпучивание пластин, а также "высыпание" из пластин активной массы, так как объем сернокислого свинца больше объема исходных продуктов, из которых он образуется. Во-вторых, сернокислый свинец по истечении некоторого времени кристаллизуется в нерастворимое вещество. Часть пластины, которая оказалась покрытой кристаллизовавшимся сернокислым свинцом, не участвует в химических реакциях. Вследствие этого снижается полезная емкость аккумулятора. Такое явление носит название сульфатации кислотных аккумуляторов. Для того чтобы избежать явления сульфатации, кислотные аккумуляторы не следует хранить в незаряженном состоянии, нельзя допускать недозарядку аккумуляторов. При коротком замыкании в результате бурной химической реакции и интенсивного выделения сернокислого свинца происходит коробление пластин кислотного аккумулятора. Зарядка аккумуляторов производится от внешнего источника электроэнергии, генератора постоянного тока или выпрямителя. При зарядке к отрицательным пластинам направляются ионы водорода, а к положительным - ионы кислотного остатка. В результате возникают следующие химические реакции:
- у отрицательной пластины PbSO4 + H2 = Pb + H2SO4
- у положительной пластины PbSО4+2Н2О + SO4 = РbO2 + 2Н2 + 2H2SO4
Следовательно, при зарядке аккумуляторов происходит разложение сернокислого свинца на исходные продукты, а также восстановление концентрации электролита. Очевидно, что окончанием зарядки аккумуляторов можно считать такой момент, когда весь сернокислый свинец разложился и концентрация электролита восстановилась до нормальной. При дальнейшей зарядке потребляемая аккумулятором электрическая энергия будет расходоваться на разложение воды, имеющейся в электролите. Вода разлагается на водород и кислород. Кислород, как наиболее активный газ, производит окисление металлов, имеющихся в аккумуляторе. Водород выделяется в атмосферу. Поэтому на поверхности электролита появляются пузырьки, создающие впечатление "кипения" электролита. В смеси с воздухом водород образует взрывчатый гремучий газ, который должен быть немедленно удален из аккумуляторного помещения. ЭДС не включенного на разрядку кислотного аккумулятора, принимается в среднем равной 2,1 В независимо от размеров аккумулятора. Напряжение, создаваемое аккумулятором на зажимах, определяется уравнениями:
- при разрядке U = E-Iраз*r
- при зарядке U=E+Iзар*r
где Е - ЭДС аккумулятора; Ipаз, Iзар - соответственно ток разрядки и зарядки аккумулятора; r - внутреннее сопротивление аккумулятора. Кислотные аккумуляторы имеют небольшое внутреннее сопротивление, поэтому напряжение на зажимах аккумулятора незначительно снижается даже при больших токах нагрузки. В среднем сопротивление кислотного аккумулятора составляет 0,005 Ом и является величиной, зависящей от плотности электролита, а также от габаритов аккумуляторов (чем больше габариты, тем меньше сопротивление). С уменьшением плотности электролита, т. е. с увеличением степени разряда, ЭДС кислотных аккумуляторов уменьшается, а внутреннее сопротивление увеличивается. Вследствие этого напряжение аккумулятора в начале разрядки понижается незначительно, а к концу падает быстро. В настоящее время применяются в основном две разновидности щелочных аккумуляторов: кадмиево-никелевые и железо-никелевые. Электролитом их является раствор едкого калия КОН в дистиллированной воде (плотность электролита 1,19 1,21). В качестве активной массы положительных пластин служит гидрат окиси никеля Ni(OH)3, а активной массы отрицательных - губчатый кадмий Cd. При разрядке аккумулятора анионы щелочного остатка ОН стремятся к пластинам из чистого кадмия. Избыточные электроны кислотного остатка направляются во внешнюю цепь и к пластинам из гидрата окиси никеля, где они нейтрализуются катионами калия. Таким путем создается разрядный ток аккумулятора. При разрядке щелочного аккумулятора происходят следующие химические реакции:
- у отрицательной пластины Cd + 2OH = Cd(OH)2
- у положительной пластины Ni (ОН)3 + К = Ni(OH) + КОН
Из данных реакций видно, что при разрядке щелочного аккумулятора кадмий переходит в гидроокись кадмия Cd(OH)2, а трехатомный гидрат окиси никеля Ni(OH)3 - в двухатомную гидроокись никеля Ni(ОН)2. Эти вещества не обладают отрицательными свойствами, поэтому щелочные аккумуляторы не требуют тщательного ухода в эксплуатации, могут быть длительно незаряженными, мало разрушаются при коротки замыканиях. При зарядке щелочных аккумуляторов катионы калия движутся к отрицательным пластинам, а анионы щелочного остатка - к положительным. При зарядке происходят следующие химические реакции:
- у отрицательной пластины Cd(OH)2 + 2K = 2KOH+Cd
- у положительной пластины Ni(OH)2 + OH = Ni(OH)3
При разрядке, и при зарядке щелочных аккумуляторов плотность электролита остается постоянной, так как диссоциация едкого калия на ионы К и ОН компенсируется образованием КОН. После переработки всех веществ, участвующих в химических реакциях, при зарядке щелочных аккумуляторов происходит разложение воды электролита и "кипение" аккумулятора.
3) УСТРОЙСТВО АККУМУЛЯТОРНОЙ БАТАРЕИ
Аккумуляторные батареи с отдельными крышками (рис. 3.1) собирают в одном многоячеечном корпусе - моноблоке, выполненном из эбонита или другой кислотостойкой пластмассы, разделенном перегородками на отдельные камеры-ячейки (банки), по числу аккумуляторов в батарее. В каждую из ячеек помещен блок, состоящий из чередующихся положительных и отрицательных электродов, разделенных сепараторами. Он представляет собой отдельный аккумулятор напряжением 2 В. Пространство между дном моноблока и верхними кромками фиксирующих электроды опорных призм служит для накаливания шлама - осадка, образующегося в процессе эксплуатации вследствие оплывания частиц активной массы положительных электродов. Когда объем шламового пространства заполняется, происходит замыкание нижних кромок разноименных электродов и аккумулятор теряет работоспособность.
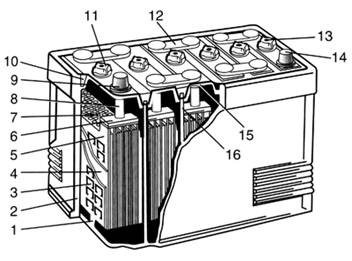
Рисунок 3.1 - Аккумуляторная батарея с отдельными крышками: 1- опорные призмы; 2- моноблок; 3- отрицательный электрод; 4- сепаратор; 5- положительный электрод; 6- межэлементные соединения; 7- щиток; 8- борн; 9- положительный вывод; 11- пробка; 13- вентиляционное отверстие; 14- отрицательный вывод; 15- крышка; 16- перегородки Электроды состоят из активной массы, нанесенной на токоотвод решетчатой конструкции - решетку. Сепараторы разделяют участвующие в электрохимических превращениях реагенты, а также обеспечивают возможность диффузии электролита от одного электрода к другому. Сторона сепаратора, обращенная к положительному электроду для облегчения доступа электролита к поверхности активной массы, выполнена ребристой. Борн, который служит наружным токоотводом аккумулятора, последовательно соединяет соседние аккумуляторы между собой в батарею. К выводным борнам крайних аккумуляторов батареи привариваются полюсные выводы и, служащие для соединения батареи с внешней электрической цепью. Положительный и отрицательный выводы имеют разный диаметр, что позволяет исключить возможность переполюсовки при подключении АКБ к бортовой цепи автомобиля. В верхней части электродного блока устанавливают щиток, предохраняющий верхние кромки сепараторов от повреждения при замерах уровня и плотности электролита. Каждый аккумулятор после установки электродного блока в камеру-ячейку моноблока закрывают сверху отдельной пластмассовой или эбонитовой крышкой. В ней выполняют по два отверстия с втулками для выводных борнов электродного блока. Между ними расположено резьбовое отверстие для заливки электролита и периодического обслуживания аккумулятора в процессе эксплуатации. После заливки электролита резьбовое отверстие закрывают пробкой из полиэтилена, имеющей небольшое вентиляционное отверстие, предназначенное для выхода газов при эксплуатации. Для герметичной укупорки новых сухозаряженных батарей в верхней части пробки над вентиляционным отверстием выполнен глухой прилив. Для обеспечения нормальной эксплуатации этот прилив, после заливки электролита в батарею, необходимо срезать. Благодаря специфическим свойствам термопластичной пластмассы появились аккумуляторные батареи с общей крышкой в моноблоке из сополимера пропилена с этиленом, устройство которых показано на рис. 3.2 В моноблоке установлены электродные блоки, состоящие из разноименных электродов и, разделенных сепараторами. Эти блоки соединены между собой при помощи укороченных межэлементных соединений через отверстия в перегородках моноблока. Крышка сделана единой на все шесть аккумуляторов батареи. Свойства термопластичной пластмассы позволили применить для герметизации АКБ с общей крышкой метод контактно-тепловой сварки, обеспечивающий сохранение герметичности как по периметру, так и между отдельными аккумуляторами в широком диапазоне температур (от −50°C до 70°C).
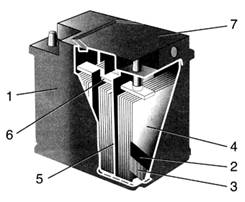
Рисунок 3.2 - Аккумуляторная батарея с общей крышкой: 1-моноблок; 2-отрицательный электрод; 3-положительный электрод; 4- сепаратор; 5-перегородка; 6-межэлементные соединения; 7-крышка Недостатки традиционных свинцовых батарей обусловлены тем, что содержащаяся в сплаве положительных токоотводов сурьма постепенно, по мере их коррозии, через раствор переходит на поверхность отрицательного электрода. Осаждение большого количества сурьмы на поверхности отрицательной активной массы снижает напряжение на электродах батареи, при котором начинается разложение воды на водород и кислород. Поэтому, в конце зарядного процесса и при небольшом перезаряде, происходит бурное газовыделение, сопровождающееся "кипением" электролита вследствие электролитического разложения входящей в него воды. За последние 20-25 лет, по мере развития технологии и совершенствования оборудования, появилось несколько разновидностей батарей так называемого "необслуживаемого" исполнения. Их основная отличительная особенность - использование сплавов с пониженным содержанием сурьмы или вовсе без нее для производства токоотводов. Усовершенствование конструкции при создании необслуживаемых АКБ заключается еще и в том, что для увеличения запаса электролита без изменения высоты батареи, один из аккумуляторных электродов помещают в сепаратор-конверт, который изготовлен из микропористого полиэтиленового материала с низким электросопротивлением. В этом случае замыкание электродов различной полярности, при отсутствии сбоев в работе сборочного оборудования, практически исключено. Поэтому опорные призмы становятся ненужными, и блок электродов можно установить прямо на дно ячейки моноблока. В результате та часть электролита, которая раньше находилась в шламовом пространстве между призмами и не принимала участия в работе аккумулятора, теперь находится над электродами и пополняет его запас, расходуемый при эксплуатации батареи. Первоначально такие батареи начали выпускать в США на базе свинцово-кальциевого сплава (0,07-0,1% Ca; 0,1-0,12% Sn; остальное - Pb) для токоотводов, положительного и отрицательного электродов. Это снизило газовыделение, что обеспечило эксплуатацию АКБ без доливки воды в течение как минимум двух лет. Расход воды у этих батарей так мал, что конструкторы убрали из крышек отверстия для доливки воды и сделали батареи полностью необслуживаемыми. При этом самозаряд батарей замедлился более чем в 6 раз. Однако, при нескольких глубоких разрядах такие АКБ быстро теряют емкость и их стартерные характеристики резко снижаются, из-за чего они не нашли широкого распространения в Европе и России. В это же время в США появились батареи системы "кальций плюс" (гибридные) с содержанием до 1,5-1,8% сурьмы и 1,4-1,6% кадмия в положительном токоотводе и свинцово-кальциевым отрицательным токоотводом. Характеристики этих батарей по расходу воды и саморазряду вдвое лучше, чем у малосурьмяных, но все еще не такие хорошие, как у свинцово-кальциевых. К началу 80-х годов производство необслуживаемых батарей стало быстро развиваться в странах Европы. Но там пошли по пути применения сплавов с пониженным до 2,5-3,0% содержанием сурьмы. Однако, у таких АКБ расход воды и саморазряд в 2-3 раза выше, чем у батарей с кальциевыми токоотводами. Позже и в Европе появились так называемые гибридные батареи. Наконец, в конце 90-х годов и в США, и в Западной Европе началось производство батарей с токоотводами из свинцово-кальциевого сплава с добавкой новых легирующих компонентов, в том числе серебра, которые не боятся глубоких разрядов. Следует отметить, что эксплуатация батарей без отверстий для доливки воды требует более точной работы системы энергосбережения автомобиля, а также более внимательного отношения автовладельцев к состоянию и исправной работе электрооборудования. В первую очередь это касается натяжения ремня привода генератора и исправности самого генератора, а также регулятора напряжения. Отрицательно сказывается на состоянии батарей последнего поколения и наличие утечек тока в системе электрооборудования или сигнализацию. Подавляющее большинство АКБ, поступающих в Россию из стран Европы, выпускают, как правило, в гибридном исполнении, либо с токоотводами обеих полярностей из свинцово-кальциевых сплавов. При изготовлении сухозаряженных батарей многие производители применяют для электродов обеих полярностей малосурьмяные сплавы с содержание сурьмы 1,6-1,8%.
4) КЛАССИФИКАЦИЯ АККУМУЛЯТОРОВ
По типу аккумуляторы разделяют в зависимости от их химсостава, который влияет на их эксплуатационные свойства:
-
никель-кадмиевые (Ni-Cd) – наиболее старый тип аккумуляторных батареек, отличается необходимостью соблюдения цикла «полный разряд» – «полный заряд» (имеют эффект памяти) и чувствительны к холоду (плохо отдают энергию на морозе), но могут хранится разраженными и отличаются низким саморазрядом, сейчас используются в основном в электроинструменте
-
никель-металл-гидридные (Ni-MH) – очень распространенный тип простых и дешевых компактных аккумуляторных батареек, эффект памяти и чувствительность к холоду несколько ниже, чем у никель-кадмиевых аккумуляторов, но их нужно хранить заряженными и у них выше саморазряд, сейчас они используются в основном в радиотелефонах
-
литий-ионные (Li-Ion) – более современный тип аккумуляторов, почти не подвержены эффекту памяти (снижению емкости), что позволяет заряжать их в любое время и необязательно разряжать до конца, чувствительность к холоду есть, но не критична, нужно поддерживать заряд при хранении, они часто используются в фотоаппаратах
-
литий-полимерные (Li-Pol) – облегченный вариант литий-ионных аккумуляторов, обладающий теми же свойствами, но со значительно меньшим весом, что нашло применение в компактных мобильных устройствах и дронах
-
свинцово-кислотные (SLA) – большие мощные аккумуляторы, способные быстро отдавать огромную энергию (силу тока), что используется в пусковых установках двигателей (стартерах) и источниках бесперебойного питания, требуют периодической подзарядки во время хранения
Аккумуляторные батареи:
Для обеспечения нормального функционирования техники применяются аккумуляторы разных типоразмеров. Основная сфера их использования – питание мелких устройств бытового назначения. Аккумуляторные батарейки используются для самых различных устройств – радио мышек, клавиатур, фотоаппаратов, простых фонариков, часов, другой мелкой электроники.
Они имеют различные типоразмеры:

-
AA (пальчик) – наиболее распространенный формат круглых батареек длиной 5 см, напряжением 1.2 В и емкостью 1000-3000 мАч
-
AAA (мини-пальчик) – также широко распространены, имеют длину 4.4 см, такое же напряжение 1.2 В, но меньшую емкость 500-1500 мАч
-
РР3 (крона) – более редкая прямоугольная батарейка с напряжением 9 В, используется в некоторых электроприборах (например, мультиметрах)
Существуют и другие, более редкие форматы аккумуляторных батареек:
-
CS (Sub C) – короткая круглая батарейка
-
C (R14) – средняя круглая батарейка
-
D (R20) – большая круглая батарейка
Они мало распространены и используются в некоторых специфических устройствах и старых фотоаппаратах.
Автомобильные аккумуляторы
Это большие обслуживаемые кислотно-свинцовые батареи с жидким электролитом. Они способны быстро отдавать огромный ток, но необходимо следить за их зарядом и уровнем электролита (доливать по необходимости). Хранить свинцовый аккумулятор разряженным нельзя, так как где-то через полгода он выйдет из строя.
Аккумуляторы для ИБП
Аккумуляторы для компьютерных ИБП призваны обеспечить недлительное питание техники в случае временного отключения электричества. Они также являются свинцово-кислотными, но в отличие от автомобильных необслуживаемыми, а электролит в них загущенный в виде геля, что предотвращает утечки. В остальном эти аккумуляторы подобны автомобильным, они могут быстро отдать большой ток и требуют периодической подзарядки. В разных ИБП используются аккумуляторы с разным напряжением (12 или 24 В), разной емкости (7, 9, 12 Ач) и разного физического размера. Также есть модели, в которые устанавливается несколько соединенных вместе батарей. Аккумуляторы в ИБП для газового котла и другой ответственной техники, отличаются большей емкостью по сравнению с моделями, применяемыми при работе компьютерного оборудования. Ведь они рассчитаны на поддержание функционирования отопительных приборов на протяжении суток и более. Такие аккумуляторы часто являются внешними и подключаются к ИБП с помощью специальных клемм, а сами ИБП должны выдавать напряжение в форме чистой синусоиды, что важно для электронасосов, используемых в системах отопления и другой чувствительной к форме напряжения техники.
Промышленные аккумуляторы
Обычно огромные батареи большой емкости. Могут быть разного напряжения, в том числе высоковольтные.
5) РАСЧЕТНАЯ ЧАСТЬ
Активные вещества положительных и отрицательных пластин обладают определенными потенциалами относительно электролита. Разность этих потенциалов определяет ЭДС аккумулятора, которая не зависит от количества активного вещества в пластинах. ЭДС аккумулятора зависит в основном от плотности электролита, эта зависимость определяется эмпирической формулой:
E = 0, 85 + d,
где d – плотность электролита в порах активной массы пластин. Напряжение аккумулятора при заряде больше, чем величина ЭДС, на величину внутреннего падения напряжения:
UЗ = E + IЗ ∙ r0,
где r0 – внутреннее сопротивление аккумулятора, а при разряде соответственно:
UР = E – IР ∙ r0.
У разряженного свинцового аккумулятора плотность составляет d = 1, 17, тогда Е = 0, 85 + 1, 17 = 2, 02 В. У заряженного аккумулятора d = 1, 21, тогда Е = 0, 85 + 1, 21 = 2, 06 В => ЭДС разряженного аккумулятора при отключенной нагрузке мало отличается от ЭДС заряженного аккумулятора. При заряде аккумулятора, его напряжение заряда составляет 2, 3 – 2, 8 В. Напряжение разряда составляет примерно 1, 8 В.
Емкость свинцового аккумулятора:
Номинальная емкость определяется при десятичасовом разряде до напряжения 1, 8 В, при температуре электролита 25°С. Номинальная емкость свинцового аккумулятора составляет 36 А/ч. Этой емкости соответствует ток разряда IР = Q/10 = 3, 6 А.
Если изменить ток разряда IР и температуру электролита, то изменится и его емкость. Повышение температуры окружающей среды способствует повышению емкости, но при температуре 40°С происходит коробление положительных пластин и резко увеличивается саморазряд аккумулятора, поэтому для нормальной эксплуатации аккумулятора должна поддерживаться температура + 35°С – 15°С.
Номинальная емкость при температуре 25°С и десятичасовом разряде определяется формулой:
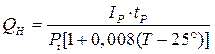
где Pt – коэффициент использования активной массы аккумулятора, %;
Т – фактическая температура электролита при разряде.
Внутреннее сопротивление аккумулятора:
Возьмем свинцовый кислотный аккумулятор с емкостью 1 А*час и с номинальным напряжением 12 В. В полностью заряженном состоянии аккумулятор имеет напряжение примерно U = 13 В. Какой ток I потечет через аккумулятор, если к нему подключить резистор с сопротивлением R=1 Ом? Нет, не 13 ампер, а несколько меньше - около 12.2 А. Почему? Если мы измерим напряжение на аккумуляторе, к которому подключен резистор, то увидим, что оно примерно равно 12.2 В - напряжение на аккумуляторе упало из-за того, что скорость диффузии ионов в электролите не бесконечно велика.
Электрики в своих расчетах привыкли составлять электрические цепи из элементов с несколькими полюсами. Условно, можно и аккумулятор представить в виде двухполюсника с ЭДС (электродвижущей силой - напряжением без нагрузки) E и внутренним сопротивлением r. При этом предполагается, что часть ЭДС аккумулятора падает на нагрузке, а другая часть - на внутреннем сопротивлении аккумулятора. Иначе говоря, предполагается, что верна формула:
E = ( R + r ) * I
Теперь, вернувшись к нашему примеру, мы можем примерно определить внутреннее сопротивление аккумулятора 12 В, 1 А*час на постоянном токе.
r = ( E - U ) / I = (13В - 12.2В ) / 1А = 0.7 Ом.
Отдача аккумулятора:
Аккумуляторы характеризуются также отдачей по энергии и току. Отдача по энергии равна отношению энергии, полученной при разряде, к энергии, затраченной на заряд аккумулятора: ηэн=Aраз/Aзар.
Для свинцового аккумулятора ηэн=70%, а для железо-никелевого ηэн=50%.
Отдача по току равна отношению количества электричества, полученного при разряде, к количеству электричества, израсходованного при заряде: ηт=Qраз/Qзар.
Свинцовые аккумуляторы имеют ηт=90%, а железоникелевые ηт=70%.
ηэн=Aраз/Aзар =(Uр∙Iр∙tр)/(Uз∙Iз∙tз )=Uр/Uз ∙ηт.
Отдача по энергии равна отдаче по току ηт, умноженной на отношение напряжения разряда к напряжению заряда. Так как отношение Uр/Uз <1, то ηэн<ηт.
Аккумулятор заряжался 10 ч током Iз=1,5 А, а разряжался 20 ч током Iр=0,7 А. Какова отдача по току?
Qр=Iр∙tр=0,7∙20=14 А•ч; Qз=Iз∙tз=1,5∙10=15 А•ч; ηт=Qр/Qз =14/15=0,933=93%.
Аккумулятор заряжается током 0,7 А в течение 5 ч. Как долго он будет разряжаться током 0,3 А при отдаче по току ηт=0,9
Израсходованное на заряд аккумулятора количество электричества равно: Qз=Iз∙tз=0,7∙5=3,5 А•ч.
Количество электричества Qр, отдаваемое при разряде подсчитаем по формуле ηт=Qр/Qз , откуда Qр=ηт∙Qз=0,9∙3,5=3,15 А•ч.
Время разряда tр=Qр/Iр =3,15/0,3=10,5 ч.
Аккумулятор емкостью 20 А•ч был полностью заряжен в течение 10 ч от сети переменного тока через селеновый выпрямитель. Положительный вывод выпрямителя при заряде подключается к положительному выводу аккумулятора. Каким током аккумулятор заряжался, если отдача по току ηт=90%? Каким током аккумулятор может разряжаться в течение 20 ч.
Ток заряда аккумулятора равен: Iз=Q/(ηт∙tз )=20/(10∙0,9)=2,22 А. Допустимый ток разряда Iр=Q/tр =20/20=1 А.
Аккумуляторная батарея, состоящая из 50 элементов, заряжается током 5 А. ЭДС одного элемента батареи 2,1 В, а его внутреннее сопротивление rвн=0,005 Ом. Какое напряжение имеет батарея? Какую э. д. с. должен иметь зарядный генератор с внутренним сопротивлением rг=0,1 Ом?
ЭДС батареи равна: Eб=50∙2,1=105 В.
Внутреннее сопротивление батареи rб=50∙0,005=0,25 Ом. ЭДС генератора равна сумме э. д. с. батареи и падений напряжения в батарее и генераторе: E=U+I∙rб+I∙rг=105+5∙0,25+5∙0,1=106,65 В.
Аккумуляторная батарея состоит из 40 элементов с внутренним сопротивлением rвн=0,005 Ом и э. д. с. 2,1 В. Батарею заряжают током I=5 А от генератора, э. д. с. которого 120 В, а внутреннее сопротивление rг=0,12 Ом. Определить дополнительное сопротивление rд, мощность генератора, полезную мощность заряда, потери мощности в добавочном сопротивлении rд и потери мощности в батарее.
Дополнительное сопротивление найдем с помощью второго закона Кирхгофа:
Eг=Eб+rд∙I+rг∙I+40∙rв∙I;
rд=(Eг-Eб-I∙(rг+40∙rв))/I=(120-84-5∙(0,12+0,2))/5=34,4/5=6,88 Ом.
Так как ЭДС батареи при заряде увеличивается (ЭДС элемента в начале заряда равна 1,83 В), то в начале заряда при неизменном добавочном сопротивлении ток будет больше 5 А. Для поддержания неизменным тока заряда необходимо изменять дополнительное сопротивление.
Потери мощности в дополнительном сопротивлении ∆Pд=rд∙I^2=6,88∙5^2=6,88∙25=172 Вт.
Потери мощности в генераторе ∆Pг=rг∙I^2=0,12∙25=3 Вт.
Потери мощности во внутреннем сопротивлении аккумуляторной батареи ∆Pб=40∙rвн∙I^2=40∙0,005∙25=5 Вт.
Мощность генератора, отдаваемая во внешнюю цепь, Pг=Eб∙I+Pд+Pб=84∙5+172+5=579 Вт.
Полезная мощность заряда Pз=Eб∙I=420 Вт.
Как известно, расчет потребленной мощности производится в Вт, а емкость батареи для ИБП – в А·ч. Чтобы рассчитать требуемую емкость аккумуляторов для питания той или иной техники, необходимо произвести некоторый пересчет. Для лучшего понимания рассмотрим конкретный пример. Допустим, имеется критичная нагрузка 500 Вт, требующая резервирования в течение 3 часов. Так как величина накопленной энергии зависит не только от емкости батареи, но и ее напряжения, для расчета делим общую мощность резервируемого оборудования на их рабочее напряжение (часто путают с напряжением холостого хода полностью заряженной батареи). Для стандартного 12В аккумулятора, величина необходимой емкости батареи составит:
Q= (P· t) / V· k
где Q – необходимая емкость аккумулятора, А·ч;
P – имеющаяся нагрузка, Вт;
V – напряжение каждой аккумуляторной батареи, В;
t – время резервирования, ч;
k – коэффициент использования емкости аккумуляторов (количества электрической энергии, допустимой к использованию потребителями).
Необходимость введения коэффициента k обусловлена возможностью неполного заряда АКБ. Вдобавок к этому, сильный (глубокий) разряд, следующий после небольшого количества рабочих циклов заряда и разряда, ведет к преждевременному износу и выходу из строя батареи. К примеру, если новый аккумулятор разряжать на 30% от его общей емкости, после чего сразу производить его зарядку, способен выдержать около 1000 подобных циклов. В случае если величина разряда уменьшится до 70%, то количество данных циклов снизится примерно на 200.
Итого, получаем, что для питания данной нагрузки в течение указанного периода времени потребуется:
Q= 500·3/ 12·0,7 = 178,6 А·ч.
Это минимально необходимая емкость аккумуляторных батарей для рассматриваемого случая. В идеале лучше брать источник энергии с небольшим запасом (около 20%) для того, чтобы каждый раз не разряжать его полностью – это поможет сохранить рабочие характеристики батареи в течении как можно большего периода времени.
Q= 178,6·1,2 = 214,3 А·ч.
Время резерва питания определяется прежде всего двумя параметрами: мощностью полезной нагрузки и общей ёмкостью всех аккумуляторных батарей. Однако следует отметить, что зависимость времени резерва от этих параметров не линейная. Но для быстрой примерной оценки времени резерва можно использовать простую формулу.
T = E * U / P (часов),
где Е — ёмкость аккумуляторов, U — напряжение аккумуляторов, Р — мощность нагрузки всех подключаемых приборов.
Уточненный способ расчёта времени резерва бесперебойника
Для уточнения расчёта времени резерва дополнительно вводятся специальные коэффициенты: КПД инвертора, коэффициент разряда аккумулятора, коэффициент доступной ёмкости в зависимости от температуры окружающей среды.
С учётом этих коэффициентов формула расчета принимает следующий вид.
T = E * U / P * KPD * KRA * KDE (часов),
где KPD (коэффициент полезного действия инвертора) находится в диапазоне 0,7—0,8,
KRA (коэффициент разряда аккумуляторов) находится в диапазоне 0,7—0,9,
KDE (коэффициент доступной ёмкости) находится в диапазоне 0,7—1,0.
Коэффициент доступной ёмкости имеет сложную зависимость от значения температуры и скорости прикладывания нагрузки. Чем холоднее температура воздуха, тем ниже коэффициент доступной ёмкости. Чем медленнее расходуется энергия батарей, тем больше значения коэффициента доступной ёмкости.
1. Зависимость емкости аккумулятора от тока его разряда.
В основе данной зависимости лежит следующий факт: когда защищаемая нагрузка подключается к аккумулятору без использования преобразователя, то величина тока, потребляемого батареей неизменна. При этом время функционирования подключенных электропотребителей определится, как отношение отбираемой емкости к потребляемому току. В более привычном виде данная формула записывается следующим образом:
Q = I·T
где Q – емкость аккумулятора, А·ч (мА·ч);
I – постоянный ток разряда аккумулятора, А;
T – время разряда батареи, ч.
Если имеем дело с большими величинами потребляемого тока, то реальные показатели мощности зачастую ниже номинальных, указанных в паспорте.
2. Зависимость емкости аккумулятора от энергии
Сегодня среди пользователей достаточно распространенным является мнение о том, что емкость аккумуляторной батареи является величиной, полностью характеризующей его электрическую энергию, накопленной АКБ заряженной на 100%. Это утверждение является не совсем корректным. Здесь еще необходимо сделать оговорку на то, что способность накапливать энергию у батареи напрямую зависит от ее напряжения и чем оно будет выше, тем большее количество энергии сможет накопить аккумулятор. На самом деле электрическая энергия определяется как произведение показателей тока заряда, напряжения батареи и времени протекания этого тока:
W= I·U·T
где W – энергия накопленная батареей, Дж;
U – напряжение аккумулятора, В;
I – постоянный ток разряда аккумулятора, А;
T – время разряда батареи, ч.
Исходя из того, что произведение тока и времени заряда дает нам емкость АКБ (как было рассмотрено выше), то получается, что электрическая энергия аккумулятора находится путем перемножения номинального напряжения батарее и ее емкости:
W= Q·U
где W – энергия накопленная батареей, Вт·ч;
Q – емкость аккумулятора, А·ч;
U – напряжение аккумулятора, В.
При последовательном подключении нескольких аккумуляторов одинаковой емкости, общий показатель данной связки равен сумме емкостей всех АКБ, входящий в ее состав. В таком случае энергия полученного аккумуляторного блока определится, как произведение электроэнергии одной батареи на их количество.
3. Понятие энергетической емкости аккумулятора
Не менее полезным для потребителя показателем аккумуляторных батарей является их энергетическая емкость, измеряемая в таких единицах, как Вт/элемент. Данное понятие характеризует способность аккумулятора за определенный непродолжительный период времени, который чаще всего составляет не более 15 минут, в режиме постоянной мощности. Наибольшее распространение данный показатель получил в США, но в последнее время набирает популярность и среди потребителей многих других стран. Для приближенного расчета емкости аккумуляторной батареи, измеряемой в А·ч по величине его энергетической емкости в Вт/элемент для периода 15 минут, пользуются формулой:
Q = W/4
где Q – емкость аккумулятора, А·ч;
W – энергетическая емкость аккумулятора, Вт/элемент.
4. Понятие резервной емкости аккумулятора
Для автомобильных аккумуляторов выделяют еще одну характеристику – резервную емкость, которая говорит о способности батареи питать электрооборудование движущегося авто, когда штатный генератор транспортного средства не работает. Данный параметр также больше известен в США и называется «reserve capacity». Он измеряется в минутах разряда батареи величиной тока в 25 А. Для приблизительной оценки номинальной емкости аккумулятора по его показателю резервной емкости, указной в минутах, необходимо воспользоваться формулой:
Q = T/2
где Q – емкость аккумулятора, А·ч;
T – резервная емкость аккумулятора, мин.
6) ОХРАНА ТРУДА
1. Аккумуляторное помещение должно быть заперто на замок. Работникам, осматривающим эти помещения и выполняющим в них работу, ключи выдаются на общих основаниях.
2. Запрещается курение в аккумуляторном помещении, вход в него с огнем, пользование электронагревательными приборами, аппаратами и инструментами, которые могут дать искру, за исключением выполнения работ, указанных в пункте 35.11 Правил.
На дверях аккумуляторного помещения должны быть сделаны надписи "Аккумуляторная", "Огнеопасно", "Запрещается курить" или вывешены соответствующие знаки безопасности о запрещении использования открытого огня и курения.
3. В аккумуляторных помещениях приточно-вытяжная вентиляция должна включаться перед началом заряда и отключаться не ранее чем через 1,5 часа после окончания заряда.
4. В каждом аккумуляторном помещении должны быть:
стеклянная или фарфоровая (полиэтиленовая) кружка с носиком (или кувшин) емкостью 1,5 - 2 л для составления электролита и доливки его в сосуды;
нейтрализующий 2,5-процентный раствор питьевой соды для кислотных батарей и 10-процентный раствор борной кислоты или уксусной эссенции (одна часть на восемь частей воды) для щелочных батарей;
вода для обмыва рук;
полотенце.
5. На всех сосудах с электролитом, дистиллированной водой и нейтрализующими растворами должны быть сделаны соответствующие надписи, указаны наименования.
6. Кислота должна храниться в стеклянных бутылях с притертыми пробками, снабженных бирками с названием кислоты. Бутыли с кислотой и порожние бутыли должны находиться в отдельном помещении при аккумуляторной батарее. Бутыли следует устанавливать на полу в корзинах или деревянных обрешетках.
7. Все работы с кислотой, щелочью и свинцом должны выполнять специально обученные работники.
8. Стеклянные бутыли с кислотами и щелочами должны переносить двое работников. Бутыль вместе с корзиной следует переносить в специальном деревянном ящике с ручками или на специальных носилках с отверстием посередине и обрешеткой, в которую бутыль должна входить вместе с корзиной на 2/3 высоты.
9. При приготовлении электролита кислота должна медленно (во избежание интенсивного нагрева раствора) вливаться тонкой струей из кружки в фарфоровый или другой термостойкий сосуд с дистиллированной водой. Электролит при этом все время нужно перемешивать стеклянным стержнем или трубкой либо мешалкой из кислотоупорной пластмассы.
Запрещается приготовлять электролит, вливая воду в кислоту. В готовый электролит доливать воду разрешается.
10. При работах с кислотой и щелочью необходимо надевать специальную защитную одежду, средства защиты глаз, рук и ног от химических факторов. Куски едкой щелочи следует дробить в специально отведенном месте, предварительно завернув их в мешковину.
11. Работы по пайке пластин в аккумуляторном помещении разрешаются при следующих условиях:
пайка разрешается не ранее чем через 2 часа после окончания заряда. Батареи, работающие по методу постоянного подзаряда, должны быть за 2 часа до начала работ переведены в режим разряда;
до начала работ помещение должно быть провентилировано в течение 1 часа;
во время пайки должна выполняться непрерывная вентиляция помещения;
место пайки должно быть ограждено от остальной батареи негорючими щитами;
во избежание отравления свинцом и его соединениями должны быть приняты специальные меры предосторожности и определен режим рабочего дня в соответствии с инструкциями по эксплуатации и ремонту аккумуляторных батарей. Работы должны выполняться по наряду.
12. Обслуживание аккумуляторных батарей и зарядных устройств должно выполняться специально обученными работниками, имеющими группу III.
ЗАКЛЮЧЕНИЕ
В работы, были рассмотрены принципы работы, классификация и значение химических источников тока. Химические источники тока имеют огромное значение для развития науки, для освоения космоса, и развития общества. Наиболее перспективным типом ХИТ являются элементы с литиевым анодом. Значение химических источников тока очевидно, потому как мы используем их в повседневной жизни, трудно представить себе фотоаппараты, мобильные телефоны, карманные персональные компьютеры и т.п. подключенные к электросети, ограничивающие свободу человека. Современная наука стремится к созданию компактных и надежных приборов, сопровождающих человека в его жизни, химические источники тока играют в это немаловажную роль.
СПИСОК ЛИТЕРАТУРЫ
1) Аккумуляторы // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
2) Войнаровский П. Д. Электрические аккумуляторы // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
3) Шеханов Р.Ф., Ершова Т.В. Химические источники тока: лабораторный практикум/ Иван. гос. хим.-технол. ун-т. Иваново, 2008
4) https://ru.wikipedia.org/wiki/Электрический_аккумулятор
5) https://www.bibliofond.ru/view.aspx?id=822519#text
6) https://studfile.net/preview/6745064/
7) https://studopedia.ru/13_124289_elektricheskie-harakteristiki-kislotnih-akkumulyatorov.html
8) http://electricalschool.info/ecalc/1296-akkumuljatory.-primery-raschetov.html#:
:text=Аккумуляторы%20характеризуются%20также%20отдачей%20по,электричества%2C%20израсходованного%20при%20заряде%3A%20ηт%3DQраз%2FQзар
никель-кадмиевые (Ni-Cd) – наиболее старый тип аккумуляторных батареек, отличается необходимостью соблюдения цикла «полный разряд» – «полный заряд» (имеют эффект памяти) и чувствительны к холоду (плохо отдают энергию на морозе), но могут хранится разраженными и отличаются низким саморазрядом, сейчас используются в основном в электроинструменте
никель-металл-гидридные (Ni-MH) – очень распространенный тип простых и дешевых компактных аккумуляторных батареек, эффект памяти и чувствительность к холоду несколько ниже, чем у никель-кадмиевых аккумуляторов, но их нужно хранить заряженными и у них выше саморазряд, сейчас они используются в основном в радиотелефонах
литий-ионные (Li-Ion) – более современный тип аккумуляторов, почти не подвержены эффекту памяти (снижению емкости), что позволяет заряжать их в любое время и необязательно разряжать до конца, чувствительность к холоду есть, но не критична, нужно поддерживать заряд при хранении, они часто используются в фотоаппаратах
литий-полимерные (Li-Pol) – облегченный вариант литий-ионных аккумуляторов, обладающий теми же свойствами, но со значительно меньшим весом, что нашло применение в компактных мобильных устройствах и дронах
свинцово-кислотные (SLA) – большие мощные аккумуляторы, способные быстро отдавать огромную энергию (силу тока), что используется в пусковых установках двигателей (стартерах) и источниках бесперебойного питания, требуют периодической подзарядки во время хранения
AA (пальчик) – наиболее распространенный формат круглых батареек длиной 5 см, напряжением 1.2 В и емкостью 1000-3000 мАч
AAA (мини-пальчик) – также широко распространены, имеют длину 4.4 см, такое же напряжение 1.2 В, но меньшую емкость 500-1500 мАч
РР3 (крона) – более редкая прямоугольная батарейка с напряжением 9 В, используется в некоторых электроприборах (например, мультиметрах)
CS (Sub C) – короткая круглая батарейка
C (R14) – средняя круглая батарейка
D (R20) – большая круглая батарейка