Файл: Получение биологически активных веществ с помощью культуры клеток растений.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 12.01.2024
Просмотров: 53
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
ПОЛУЧЕНИЕ БИОЛОГИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ
С ПОМОЩЬЮ КУЛЬТУРЫ КЛЕТОК РАСТЕНИЙ
Лекарственные растения играют значительную роль в фармацевтической промышленности. Известно около 20000 веществ, которые получаются только из растений, возникает проблема сохранения растений. И тут на помощь приходит биотехнология.
Культуры клеток высших растений используются:
1) как модель при изучении регуляции метаболизма в клетках и тканях целого растения;
2) для получения биологически активных веществ
• получение уже известных веществ, присущих интактному растению (никотин, кодеин, хинин, диосгенин, сапонины);
• синтез новых продуктов из трудно выращиваемых растений (коробочки мака снотворного используют как источники получения морфина, но в культуре клеток этого растения образуется алкалоид сангвинарин, усиливающий перистальтику кишечника и повышающий секрецию слюны. Другой пример – кора хинного дерева содержит алкалоиды, обладающие антипротозойным действием, но в культуре клеток этого растения накапливаются антрахиноны);
• использование культуры клеток как мультиферментных систем для биотрансформации химических веществ.
3) для получения безвирусных растений(с помощью микроклонального размножения)
4) клеточная инженерия и селекция (получение новых форм и сортов растений, перенос «чужих» генов в растительные клетки и получение трансгенных растений) – с 1980-х годов.
Пример: перенос гена гиосциамин-6-b-гидроксилазы из белены (Hyoscyamus niger L.) в растения красавки (Atropa belladonna L.) превратил продуцент атропина в продуцент скополамина). Этот фермент катализирует реакцию превращения рацематной смеси алкалоидов гиосциамина (атропин) в 6-b-оксигиосциамин с последующей его 6,7-эпоксидацией в скополамин.
Преимущества получения БАВ с помощью культуры клеток:
-
стандартность накапливаемого сырья; -
независимость от влияния климатических, сезонных и географических условий; -
стабильность выпуска продукции в течение года; -
устраняется проблема истощения почв;
4) получение фитомассы, полностью свободной от гербицидов, тяжелых металлов
и др.;
5) возможность промышленного производства экзотических и малодоступных растений.
6) более высокий выход вторичных метаболитов
Промышленный способ выращивания изолированных культур дает возможность за короткий срок 30-45 суток получать значительный объем ценного лекарственного сырья.
Можно привести пример такого известного растения, по преданиям способного продлить жизнь и молодость, как женьшень (Panax). Из его корня выделяют комплекс тритерпеновых сапонинов (панаксозиды), которые обладают адаптогенным (повышают неспецифическую сопротивляемость организма к вредным воздействиям) и общетонизирующим действием [9]. Запасы дикорастущего женьшеня малы, для него характерны очень медленные рост и развитие. Годовой прирост корня дикорастущего растения составляет в среднем 1 г. В условиях выращивания женьшеня на плантациях сбор рекомендуется производить только на шестом году его произрастания (к этому времени накапливается достаточно БАВ), при этом «корень жизни» сильно истощает почву, и повторно его можно высаживать не ранее чем через 10 лет. А в культуре клеток растительной ткани панаксозиды можно извлекать в достаточном количестве уже на 15-25-тый день роста. В качестве дополнительного бонуса – по токсичности препараты, получаемые из каллусного сырья, менее опасны.
Что такое культура клеток растений? Если очень упрощенно – представьте, что вы взяли несколько растительных клеток и поместили на питательную среду, по аналогии с тем как микробиологи выращивают бактерии. Как будет выглядеть полученное нами «растение в пробирке»? Отличается ли его внешний вид от обычного (интактного) растения? Чаще всего – да. Сравните следующие две фотографии. На обеих – табак обыкновенный, интактное растение (рис. 1) и каллусная культура (рис. 2).

Рисунок 1. Табак обыкновенный

Рисунок 2. Каллусная культура табака обыкновенного
Краткая историческая справка
Работы по изолированию культур, когда зародыши вычленялись из семени и выращивались в искусственных условиях, принадлежат Блоцишевскому (1876), Брауну и Моррису (1892), Боннэ и Саксу
(1893).
Первые попытки культивировать изолированные клетки и ткани растений были предприняты в конце XIXв немецкими учеными (Хаберландтом, Фехтингом, Рехингером). Они пытались выращивать кусочки тканей растений, помещая их на влажную поверхность фильтра в растворе сахарозы. Пытались выращивать ткани растений, использую растительные соки и экстракты (т.е. питательные среды природного происхождения). Первые опыты были неудачными, т.к. транспорт и метаболизм питательных веществ у целого растения и изолированных клеток существенно отличается.
Хаберланд выдвинул гипотезу о тотипотентности, которая впоследствии была подтверждена экспериментально.
Тотипотентность (от лат. totus – весь, целый, potentia – сила, возможность) – это способность клетки путём деления дать начало любому клеточному типу организма. Теоретически любая живая растительная клетка потенциально способна развиваться в организм, из которого была изолирована и культивировалась в определенных условиях.
Впервые каллусная культура была получена в 1902 году Хаберландом. Он научился культивировать отдельные клетки в течение некоторого времени. Но он выбрал для экспериментов зеленые фотосинтезирующие клетки (высокодифференцированные, он считал, что содержащие хлорофилл клетки полностью обеспечивают себя питательными веществами, необходимыми для роста и жизнедеятельности, но ошибся).
Далее начался поиск адекватных питательных смесей и условий, необходимых для культивирования растительных клеток. Только в начале XX в ученые стали использовать синтетические сбалансированные среды. Основа – среды, используемые для выращивания целых растений.
Уайт и Готре в 30-х гг ХХ в показали, что изолированные органы и ткани могут расти в культуре неограниченно долгое время, если их пересаживать на свежую питательную среду через каждые 4-6 недель (пассирование). Такую же способность наблюдал Уайт для клеток опухолевого происхождения.
Первыми лекарственными растениями, которые исследовали в культуре ткани, были барвинок розовый и белена черная. В 1947 Уайт и Готре экспериментально доказали способность культуры ткани белены к синтезу алкалоидов (накапливались в каллусной массе и среде культивирования).
Получения первичного каллуса
Каллус (от лат. callus – толстая кожа, мозоль) – недифференцированная ткань, возникающая путем неорганизованной пролиферации (размножения клеток делением) дедифференцированных (потерявших специализацию) клеток органов растений.
Каллусная ткань образуется:
• при травмах растений. Эта ткань защищает место ранения, может накапливать питательные вещества для регенерации. Функционирует непродолжительное время.
• в результате пролиферации внутренних тканей экспланта из-за нарушения гормонального баланса. Растущий каллус разрывает слои ткани и развивается на поверхности.
Фазы ростового цикла в суспензионной культуре
Ростовая кривая (модельная) имеет S-образную форму. Различают следующие фазы ростового цикла:
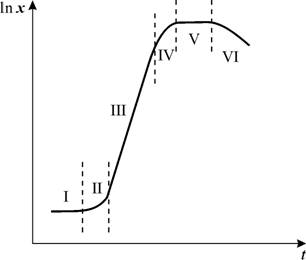
-
Латентная фаза (лаг-фаза) – клетки не размножаются, отсутствует их видимый рост, но происходит активное поглощения воды и питательных веществ. -
Экспоненциальная фаза (логарифмическая, фаза роста) – увеличение количества клеток за счет их интенсивного деления. -
Линейная фаза – очень короткая – скорость роста постоянна. -
Фаза замедленного роста (ранняя стационарная фаза) –средний размер клеток продолжает возрастать; отмечается гетерогенность клеточной популяции и начало синтеза вторичных метаболитов. -
Стационарная фаза – культуральная среда истощается (надо проводить пассирование). В этой фазе – максимум синтеза вторичных метаболитов. -
Фаза деградации клеток (отмирание). Метаболизм прекращается, т. к. энергетические запасы клеток оказываются исчерпанными. При промышленном синтезе, еще до наступления фазы отмирания, ферментацию останавливают.
Деление клеток, приводящее к увеличению клеточной биомассы, и синтез вторичных метаболитов разобщены во времени. Накопление вторичных метаболитов возрастает в фазе замедленного роста клеточной популяции и достигает максимума в стационарной фазе.
Максимум синтеза некоторых алкалоидов – в фазе экспоненциального роста (максимум митотической активности) – исключение.
Источников получения каллусов
эксплантат
– это группа клеток, отделенная от материнского организма.
Изолированные культуры каллусов получают из различных органов растений (корни, побеги, листья) или из определенного типа клеток (эндосперма, пыльца). Для обеспечения максимальной генетической стабильности клонируемого материала в качестве исходного экспланта используют молодые слабодифференцированные ткани (кончики молодых стеблей и корней, пазушные почки, зародыши, части молодых проростков).
Для выращивания культур необходимы высокопродуктивные клетки растения. Так для выращивания родиолы розовой более перспективными являются клетки корневой системы.
Технология получения каллуса
Обычно эксплантат представляет собой вырезанные маленькие кусочки растительной ткани (2-4 мм), которые находятся в подходящем биологическом состоянии (они молоды, здоровы). Этот растительный материал
• тщательно моют,
• стерилизуют гипохлоридом натрия, 96% спиртом или 0,1% сулемы (HgCl2),
• тщательно промывают дистиллированной водой
• помещают на синтетическую агаризованную питательную среду. Сосуды закрывают ватно-марлевыми тампонами.
Для образования каллуса и роста ткани сосуды переносят в темное помещение, где строго поддерживают определенный режим. Для большинства культур: температура +24-260, а влажность 65-70%. Через 2-3 недели на раневой поверхности образуется первичный каллус.
Стерилизация питательной среды. Изолированные клетки растений могут успешно расти только при отсутствии конкуренции с микроорганизмами (поэтому все работы по культивированию надо производить в асептических условиях). Если в состав питательной среды входят термолабильные вещества – их фильтруют и добавляют в охлажденную простерилизованную среду.
Проверим вашу интуицию, что произойдет с культурой клеток через время? Ведь она развивается в ограниченном пространстве на питательной среде и лишена доступа к земле. Правильно – из-за нехватки питательных веществ клетки начнут стареть и отмирать. Чтобы этого избежать, надо проводить пассирование, т.е. через 4-6 недель пересеивать клетки на свежую питательную среду. При регулярном пассировании способность к делению может поддерживаться в течение десятков лет. Необходимость пассирования для культур клеток показали американец Ф. Уайт и француз Р. Готре в 30-х гг ХХ в. Уайт занимался выращиванием изолированных корней томатов и показал, что корневая меристема может расти неограниченно долго во времени, если ее периодически пересаживать на свежую питательную среду. Культура некоторых его клонов поддерживалась около 30 лет.