ВУЗ: Казанский национальный исследовательский технический университет
Категория: Задание
Дисциплина: Не указана
Добавлен: 30.10.2018
Просмотров: 865
Скачиваний: 14
МИНОБРНАУКИ РОССИИ
Нижнекамский химико-технологический институт (филиал)
федерального государственного бюджетного образовательного учреждения
высшего образования
«Казанский национальный исследовательский технологический университет»
Кафедра химической технологии органических веществ
КОНТРОЛЬНЫЕ ЗАДАНИЯ
ПО ДИСЦИПЛИНЕ
«Оборудование заводов основного органического и нефтехимического синтеза»
ДЛЯ СТУДЕНТОВ,
ОБУЧАЮЩИХСЯ ЗАОЧНО
ПО СПЕЦИАЛЬНОСТИ
«ХИМИЧЕСКАЯ ТЕХНОЛОГИЯ ОРГАНИЧЕСКИХ ВЕЩЕСТВ»
Разработал ст. преподаватель кафедры ХТОВ Хуснутдинова Г.Р.
Нижнекамск 2018
Требования к выполнению и оформлению контрольных
заданий
Вариант контрольного задания выбирается в соответствии с порядковым номером зачетной книжки студента.
Перед тем как приступить к выполнению контрольного задания, студент должен проработать рекомендуемую литературу. Контрольная работа оформляется в письменном виде в тетрадях. Вопросы и ответы должны быть написаны в том порядке, в котором они стоят в задании. Отвечать на вопросы следует кратко, точно, исчерпывающе. Произвольные сокращения не допускаются. В конце контрольной работы приводится список использованной литературы.
Рекомендуемая литература
|
Основные источники информации |
|
1.Потехин, В.М. Основы теории химических процессов технологии органических веществ и нефтепереработки [Электронный ресурс] / В.М. Потехин, В.В. Потехин.- СПб.: Лань, 2014. - 887 с. - Режим доступа: http://e.lanbook.com/view/book/53687 , по паролю.- ЭБС «Лань» |
|
2. Харлампиди Х.Э. Общая химическая технология. Методология проектирования химико-технологических процессов [Электронный ресурс]. - СПб.: Лань, 2013. - 448 с. – Режим доступа: http://e.lanbook.com/view /book/37357/ по паролю.- ЭБС « Лань » |
|
3. Кузнецова И.М. Общая химическая технология. Основные концепции проектирования ХТС [Электронный ресурс] / И.М. Кузнецова, Харлампиди Х. Э., В.Г. Иванов [и др.]. — СПб.: Лань, 2014. — 381 с. – Режим доступа: http://e.lanbook.com/view/book/45973/ по паролю.- ЭБС « Лань » |
|
|
|
Дополнительные источники информации |
|
1. Ямалиева Л.Г. Технологические процессы и производства: метод. рекомендации и контрол. задания /Л.Г.Ямалиева,Д.Н.Латыпов.-Нижнекамск: НХТИ, 2011.-46 с.(1 шт.) |
|
2. Основные процессы и аппараты химической технологии: пособие по проектированию/ Г.С.Борисов, В.П.Брыков, Ю.И.Дытнерский и др.;под ред.Ю.И.Дытнерского.-3-е изд.,стер. .-М.:Альянс,2007.-496 с.:ил. |
|
3. Дьяконов, С.Г. Теоретические основы проектирования промышленных аппаратов химической технологии на базе сопряжения физического и математического моделирования: монография/С.Г.Дьяконов, В.В.Елизаров, В.И.Елизаров; КГТУ.-Казань:Изд-во Казанского Гос.Ун-та,2009.-456 с. |
|
4. Лащинский, А.А. Основы конструирования и расчета химической аппаратуры: справочник/ А.А.Лощинский, А.Р.Толчинский.-3-е изд.,стер.-М.:Альянс,2008.-752с. |
|
5. Оборудование и автоматизация перерабатывающих производств: учеб. для вузов/ А.А.Курочкин, Г.В.Шабурова, А.С.Гордеев, А.И.Завражнов.-М.: Колосс, 2007.-591с.:ил.- (Учебники и учеб.пособия для вузов). |
|
6. Журнал прикладной химии : науч.журн. / учредитель: РАН.- СПб.: Наука, 2005-2017. |
|
7. Известия ВУЗ. Химия и химическая технология : науч.-техн. журн. / учредитель: ФГБОУ ВПО «Ивановский государственный химико-технологический университет».- Иваново, 1988-2017. |
Контрольная работа (домашняя) (9 семестр)
1 вариант
Задание 1. Составить материальный баланс реактора каталитического окисления метанола кислородом воздуха. Процесс осуществляется на серебряном катализаторе. Производительность реактора 80 т.т/год по формальдегиду. Избирательность процесса превращения метанола в формальдегид - 0,78. Степень превращения метанола - 0,93. Содержание метанола в спирто-воздушной смеси - 45% об. Мольное соотношение продуктов в продукционном газе НСООН:СО2:СО:СН4 равно 0,4:0,6:1,5:1,3. Установка работает в течение 355 дней в году.
Целевые реакции процесса:
CH3OH → HCHO + H2
CH3OH + 0,5 O2 → HCHO + H2O
Побочные реакции процесса:
CH3OH → СO + 2H2
CH3OH + Н2 → СН4 + H2O
CH3OH + O2 → НСOОН + H2O
CH3OH + 1,5 O2 → СO2 + 2H2O
Задание 2. Составить тепловой баланс реактора окисления метанола, если:
2.1 процесс осуществляется в реакторе адиабатического типа. Спирто-воздушная смесь на входе в реактор имеет температуру 100 0С. Потери в окружающую среду составляют 5% от количества подводимой теплоты.
2.2 процесс осуществляется в трубчатом реакторе изотермического типа при температуре 110 0С. Начальная температура: спирто-воздушной смеси составляет 110 0 С, органического теплоносителя (дифенил) 95 0С. Температура органического теплоносителя на выходе из реактора 115 0С. Потери в окружающую среду составляют 2% от количества подводимой теплоты.
|
Участники реакции |
ΔНf, кДж/моль |
СР, Дж/моль·К |
|
CH3OH |
-201 |
44,13 |
|
HCHO |
-115,9 |
35,39 |
|
Н2 |
0 |
28,83 |
|
H2O |
-241,81 |
33,61 |
|
СO |
-110,53 |
29,14 |
|
СН4 |
-74,85 |
35,71 |
|
НСOОН |
-424,76 |
99,04 |
|
СO2 |
-393,51 |
37,11 |
|
O2 |
0 |
29,37 |
|
дифенил |
182,09 |
162,34 |
2 вариант
Задание 1. Составить материальный баланс реактора алкилирования бензола этиленом производительностью 140 т.т в год по этилбензолу-ректификату. Эффективное время работы установки 350 дней в году. Содержание этилбензола в этилбензоле-ректификате 99,9 % масс. Исходное мольное соотношение бензол : этилен равно 5 : 1. Расход катализатора А1С13 на 1 т. товарного этилбензола равен 4 кг. Расход активатора хлористого этила на 1 т. товарного этилбензола 3 кг. Потери этилбензола - 3 % масс. Потери этилена: с отдувками 1,0 % масс. от количества связанного этилена. Количество образующихся побочных продуктов −500 кг/ч.
Целевая реакция процесса:
С6Н6 + С2Н4 → С6Н5С2Н5
С2Н5СI + С6Н6 → С6Н5С2Н5 + НСI
Побочные реакции процесса:
С6Н6 + 2С2Н4 → С6Н4(С2Н5)2
Задание 2. Составить тепловой баланс алкилатора, если:
2.1 процесс осуществляется в реакторе адиабатического типа. Исходная реакционная смесь имеет температуру 65 0С. Потери в окружающую среду составляют 2% от количества подводимой теплоты. Температура в реакторе поддерживается в пределах 70-80 0С, за счет испарения бензола. Рассчитать количество испарившегося бензола. Теплота испарения бензола 135 кДж/моль.
2.2 процесс осуществляется в реакторе изотермического типа со встроенным змеевиковым теплообменником. Исходная реакционная смесь имеет температуру 65 0С, начальная температура теплоносителя (вода) 50 0С. Потери в окружающую среду составляют 3% от количества подводимой теплоты. Температура в реакторе поддерживается в пределах 70-80 0С.
|
Участники реакции |
ΔНf, кДж/моль |
СР, Дж/моль·К |
|
Бензол |
82,93 |
81,67 |
|
Этилен |
52,30 |
43,56 |
|
Хлорэтан |
-111,72 |
62,72 |
|
Этилбензол |
29,79 |
128,41 |
|
Диэтилбензол |
|
|
|
Хлористый водород |
-92,31 |
29,14 |
3 вариант
Задание 1. Составить материальный баланс хлоратора в производстве хлорбензола, определить селективность процесса и степень превращения бензола, если производительность установки равна П т/сут. по хлорбензолу. Состав жидких продуктов (% масс.) следующий: бензол -65,0; хлорбензол - 32,0; дихлорбензол - 2,5; трихлорбензол - 0,5. Технический хлор содержит 98 % основного вещества. Технический бензол содержит 2,5 % примесей.
Целевая реакция процесса хлорирования:
![]()
Побочные реакции:
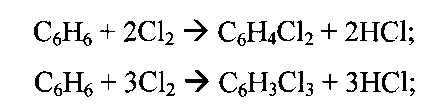
Задание 2. Составить тепловой баланс хлоратора бензола, если
-
процесс осуществляется в реакторе изотермического типа при
температуре 70 °С. Температура хладагента на входе в реактор 30" С
Потери в окружающую среду составляют 1,5% от количества подводимой
теплоты. -
процесс осуществляется в реакторе адиабатического типа при
температуре испарения бензола. Потери тепла в окружающую С££Ду
составляют 2 % от количества подводимой теплоты. Начальная
температура 65 °С.
4 вариант
Задание 1. Составить материальный баланс реактора для производства фенола кумольным способом, если производительность установки равна 50 т/сут. по фенолу. Выход изопропилбензола из бензола составляет 90% от теоретического, а фенола из изопропилбензола - 93%. Технический пропилен имеет следующий состав 30 % (масс.) пропилена, 70 % (масс.) пропана. Технический бензол содержит 5 % (масс.) толуола.
Реакция получения изопропилбензола:
С6Н6 + С3Н6 → С6Н5С3Н7
Реакция окисления изопропилбензола в гидроперекись:
С6Н5С3Н7 + О2 → С6Н5С3Н6ООН
Реакция разложения гидроперекиси с образованием фенола и ацетона:
С6Н5С3Н6ООН → С6Н5ОН +(СН3)2СО
Задание 2. Составить тепловой баланс реактора получения фенола, если:
2.1 процесс осуществляется в реакторе адиабатического типа. Сырье поступает с температурой 75 0С. Потери тепла в окружающую среду составляют 2% от количества подводимой теплоты.
2.2 процесс осуществляется в реакторе изотермического типа при температуре 90 0С. Температура хладагента на входе в реактор 45 0С. Потери в окружающую среду составляют 3% от количества подводимой теплоты. Температура хладагента на выходе из реактора составляет 75 0С.
|
Участники реакции |
ΔНf, кДж/моль |
СР, Дж/моль·К |
|
Бензол |
82,93 |
81,67 |
|
Пропилен |
20,41 |
63,89 |
|
Изопропилбензол |
|
|
|
Гидроперекись ИПБ |
|
|
|
Фенол |
-164,85 |
134,70 |
|
Ацетон |
-217,57 |
74,90 |
|
Кислород |
0 |
29,37 |
5 вариант
Задание 1. Составить материальный баланс реактора для производства окиси этилена прямым каталитическим окислением этилена кислородом. Производительность установки 200 т.т. в год товарной окиси этилена. Эффективное время работы установки 350 дней в году. Состав исходной газовой смеси (% об.): этилен - 3; кислород - 7, азот - остальное. Конверсия этилена 11%. Селективность процесса окисления 80% масс. Технический этилен содержит 2% примесей. Мольное соотношение между побочными продуктами 6,3:1,2.
Реакция получения окиси этилена:
С2Н4 + 0,5О2 → С2Н4О
Побочные реакции:
С2Н4 + 3О2 → 2СО2 + 2Н2О
С2Н4 + 0,5О2 → С2Н4О
Задание 2. Составить тепловой баланс реактора получения окиси этилена, если:
2.1 процесс осуществляется в реакторе изотермического типа. Рабочая температура 200 0С, температура хладагента (воды) на входе в реактор 165 0С. Рассчитать количество образующегося пара (r=2,138·106 кДж/моль – теплота парообразования). Температура фазового перехода 210 0С. Потери в окружающую среду составляют 1,5% от количества подводимой теплоты.
2.2 процесс осуществляется в реакторе изотермического типа. Рабочая температура 210 0С, температура хладагента (дифенила) на входе в реактор 150 0С, на выходе 198 0С. Потери в окружающую среду составляют 1,5% от количества подводимой теплоты.
|
Участники реакции |
ΔНf, кДж/моль |
СР, Дж/моль·К |
|
H2O |
-241,81 |
33,61 |
|
СO2 |
-393,51 |
37,11 |
|
O2 |
0 |
29,37 |
|
С2Н4 |
52,30 |
43,56 |
|
Окись этилена |
-52,63 |
48,50 |
|
Ацетальдегид |
-166,00 |
54,64 |
|
Дифенил |
182,09 |
162,34 |
6 вариант
Задание 1. Составить материальный баланс реактора очистки пропилена от МАПД методом гидрирования метилацетилена и пропадиена производительностью 110 т.т. в год по пропилену. Установка работает в течение 355 дней в году. Состав метилацетиленовой пропадиеновой фракции на входе в реактор: метилацетилена - 4%, пропадиена - 2%, пропилена - 54% масс, остальное пропан. Селективность процесса гидрирования 0,95. Конверсия: на первой стадии 90%, второй 25%, третьей 18 %. Потери пропилена 3%. Соотношение водород: МАПД равно 1,5:1 моль.
Реакция гидрирования метилацетилена и пропадиена:
С3Н4 + Н2 → С3Н6
С3Н4 + Н2 → С3Н6
Побочные реакции:
С3Н6 + Н2 → С3Н8
Задание 2. Составить тепловой баланс реактора получения пропилена, если:
2.1 процесс осуществляется в реакторе адиабатического типа. Сырье поступает на первую секцию с температурой 100 0С. Потери тепла в окружающую среду составляют 2% от количества подводимой теплоты.
2.2 процесс осуществляется в реакторе изотермического типа при температуре 90 0С. Температура хладагента (водяного конденсата) на входе в реактор 60 0С. Потери в окружающую среду составляют 3% от количества подводимой теплоты. Тепло снимается за счет испарения парового конденсата при давлении 1 ат.
|
Участники реакции |
ΔНf, кДж/моль |
СР, Дж/моль·К |
|
Метилацетилен |
|
|
|
Пропадиен |
192,13 |
58,99 |
|
Пропилен |
20,41 |
63,89 |
|
Водород |
0 |
28,83 |
|
Пропан |
-103,85 |
73,51 |
7 вариант
Задание 1. Составить материальный баланс реактора получения стирола производительностью по стиролу-ректификату 140 т.т. в год. Общая конверсия метилфенилкарбинола 90%: на первой ступени 70. Общая селективность процесса дегидратации МФК в стирол 0,96, причем: 0,02 - процесс образования ацетофенона; 0,02 – процесс образования бензальдегида. Параллельно с основным процессом дегидратации, протекают процессы деалкилирования этилбензола, окисления бензальдегида в бензойную кислоту. Конверсия процесса деалкилирования 0,7; процесса окисления бензальдегида 0,5. Разбавление МФК водяным паром (в пересчете на МФК) 1: 1,5 вес. Эффективное время работы установки 350 дней в году. Состав фракции МФК подаваемой на дегидратацию:
|
Наименование компонентов |
% вес. |
|
Этилбензол Бензальдегид Ацетофенон Метилфенилкарбинол |
0,01 0,04 28,24 71,71 |
|
Итого: |
100,00 |
Реакция получения стирола:
С6Н5−НСОН−СН3 → С6Н5−СН=СН2 + Н2О
Побочные реакции:
С6Н5−НСОН−СН3 → С6Н5−СО−СН3 + Н2
С6Н5−НСОН−СН3 + 0,5О2→ С6Н5−СНО + СН3ОН
С6Н5−НСО + 0,5О2→ С6Н5−СООН
С6Н5−СН2−СН3 →СН2=СН2 + С6Н6
Задание 2. Составить тепловой баланс i-ступени превращения, если:
2.1 процесс осуществляется в реакторе адиабатического типа. Начальная температура сырья поступающего на реакционную секцию составляет 350 0С. Потери тепла в окружающую среду составляют 2% от количества подводимой теплоты.
|
Участники реакции |
ΔНf, кДж/моль |
СР, Дж/моль·К |
|
МФК |
-158,79 |
192,8 |
|
Стирол |
147,57 |
128,07 |
|
Вода |
-241,81 |
33,61 |
|
Ацетофенон |
-163,24 |
136,8 |
|
Водород |
0 |
28,83 |
|
Кислород |
0 |
29,37 |
|
Бензальдегид |
45,89 |
- |
|
Метан |
-74,85 |
35,71 |
|
Бензойная кислота |
-385,14 |
145,18 |
|
Этилбензол |
29,79 |
128,41 |
|
Этилен |
52,30 |
43,56 |
|
Бензол |
82,93 |
81,67 |
8 вариант
Задание 1. Производительность установки по товарному эфиру составляет 50 т.т. в год. Годовой фонд рабочего времени 8400 часов. Мольное соотношение метанол/изобутилен 1,075:1 Общая конверсия изобутилена составляет 93%, на первой стадии 75%, на второй 37%. Селективность превращения изобутилена в МТБЭ - 99,0%, изобутилена в диизобутилен -0,6%, изобутилена в ТМК - 0,4%. Потери МТБЭ - 0,5 % от всего образовываемого МТБЭ.
Реакция синтеза метилтретбутилового эфира:
i-С4Н8 + СН3OH → С4Н9ОСН3
Побочные реакции:
i-С4Н8 + H2O → C4H9OH (образование ТМК)
2 i-С4Н8 → С8Н16 (образование диизобутилена).
Задание 2. Составить тепловой баланс реактора получения эфира, если:
2.1 процесс осуществляется в реакторе адиабатического типа. Сырье поступает на первую секцию с температурой 80 0С. Потери тепла в окружающую среду составляют 2% от количества подводимой теплоты.