Файл: Планконспект урока по химии тема урока Аммиак 9 класс.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 12.01.2024
Просмотров: 72
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
СОДЕРЖАНИЕ
I. Организационный момент (2 мин.)
6. Какова схема круговорота азота в природе?
7. Расскажите о двойственном названии элемента №7.
8. Кто и в каком году открыл азот?
III. Мотивационно - ориентировочный этап (5 мин.)
Итак, вещество, о котором пойдёт речь на нашем уроке – аммиак.
Давайте попробуем частично воспроизвести картину давних лет.
Механизм донорно-акцепторной связи:
Для молекул аммиака характерно связывание их между собой в ассоциации за счет водородных связей
ПЛАН-КОНСПЕКТ УРОКА ПО ХИМИИ
Тема урока: «Аммиак»
9 класс
Цель урока: изучение строения молекулы аммиака, его физических и химических свойств, роли аммиака в жизни человека и его применение
Задачи урока:
-
обучающие: изучить состав и строение молекулы аммиака, его физические и химические свойства, способы получения в лаборатории и промышленности, применение; познакомить с водородной связью и донорно-акцепторным механизмом образования ковалентной связи. - развивающие: развитие логического и аналитического мышления, развитие критического мышления, самостоятельности и способности к рефлексии, обеспечение системности учения, а так же развитие терминологического мышления; умения ставить и разрешать проблемы, анализировать, сравнивать, обобщать и систематизировать, бережного отношения к здоровью человека
-
воспитательные: воспитание положительной мотивации учения, правильной самооценки, чувства ответственности, уверенности и требовательности к себе, продолжить воспитание толерантности при работе в группе.
Тип урока: Изучение нового материала с элементами повторения и закрепления ранее изученного.
Методы работы: Диалогические, экспериментально – исследовательские.
План урока:
Организационный момент (2 мин)
Опрос-повторение (5 мин.)
Мотивационно-ориентировочный этап (5 мин.)
Операционно – исполнительский этап.(23 мин.) по плану (записывается на доске по мере объяснения).
Проверка усвоения знаний (7 мин.).
Подведение итогов урока. Рефлексия. Домашнее задание.(3 мин.)
Оборудование:
-
Таблица растворимости веществ. -
Периодическая система Д.И.Менделеева. -
Раствор аммиака. -
Соляная кислота. -
Индикатор фенолфталеин. -
Серная кислота. -
Лабораторная посуда.
Этапы урока.
I. Организационный момент (2 мин.)
Учитель проверяет готовность учащихся к уроку, организует начало урока. Отмечает отсутствующих. Объявление темы урока, задач, беседа с целью выявления знаний учащихся об аммиаке (Что они уже знают об аммиаке) (слайд 1-2)
II.Опрос-повторение (5 мин.)
Проведение проверки знаний: 3 ученика идут к доске; 5 учеников получают письменные задания на месте по карточкам. Остальные учащиеся отвечают на вопросы устно, со своих рабочих мест.
Вопросы - и задания для фронтальной проверки.
1. Характеристика азота по положению в Периодической системе элементов Д. И. Менделеева
2. Модель атома азота
3. Простое вещество азот
4. Почему молекулярный азот химически инертен, а атомарный – химически активен?
5. Азот в природе.
6. Какова схема круговорота азота в природе?
7. Расскажите о двойственном названии элемента №7.
8. Кто и в каком году открыл азот?
III. Мотивационно - ориентировочный этап (5 мин.)
Создание проблемной ситуации
Вводное слово учителя
Эта история произошла во время I мировой войны. Английский крейсер вел преследование поврежденного в бою немецкого эсминца. Цель была почти достигнута, как вдруг между кораблями появилось плотное белое облако дыма. Экипаж крейсера почувствовал удушливый запах, раздражающий горло и легкие. Крейсер был вынужден дать задний ход и выйти из дымового облака. Уже после обнаружили, что пострадали не только люди, но и металлические части корабля. Сегодня я хочу познакомить вас с этим удивительным веществом, имеющим необыкновенные свойства. Запах этого газа знаком каждому - даже тем, кто совсем далёк от химии. Кое – что о его свойствах тоже всем известно.Итак, вещество, о котором пойдёт речь на нашем уроке – аммиак.
Давайте попробуем частично воспроизвести картину давних лет.
Это вещество имеет древнюю историю. Арабские алхимики получали из оазиса Амон, находившегося около храма, бесцветные кристаллы. Они звали вещество «нушадир», его растирали в ступках, нагревали – и всякий раз получался едкий газ. Сначала его именовали аммониак, а потом сократили название до «аммиак».
В средние века этот газ называли почему-то «щелочной воздух», а его раствор и поныне называется «нашатырный спирт».
Давайте, ребята, проведем небольшое исследование и решим, откуда у этого газа столь необычные свойства и названия.
IV. Операционно – исполнительский этап(23 мин.)
Формула аммиака – NH3, т.е. это водородное соединение азота.
Объяснение:
Атом азота образует с атомами водорода 3 ковалентные полярные связи (т.к. электроотрицательность азота больше, чем у водорода) за счет своих трех неспареных электронов; Неподеленная электронная пара атома азота способна участвовать в образовании четвертой ковалентной связи по донорно-акцепторному механизму с атомами, имеющими вакантную орбиталь;
Механизм донорно-акцепторной связи:
H
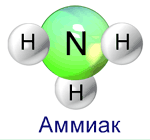
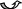 3N: + H+ = [NH4]+ образуется ион аммония
3N: + H+ = [NH4]+ образуется ион аммония Для молекул аммиака характерно связывание их между собой в ассоциации за счет водородных связей
Л.о № 1. Моделирование молекулы аммиака (из стержневых шариков)
Ответьте на вопрос:
-
Какую пространственную форму имеет молекула аммиака? (Молекула аммиака имеет форму правильной пирамиды: в углах треугольника находятся атомы водорода, а в вершине пирамиды – атом азота. Угол между связями Н-N-Н равен 107.)
Физические свойства:
Изучите запах аммиака в склянке.
-
Имеет ли раствор специфический запах? (Характерный резкий запах) -
Какого цвета исследуемый раствор? (Аммиак бесцветный газ)
Температура кипения аммиака - -33.40С, он сжижается, а при-77.80 С превращается в твёрдое белое вещество
Аммиак хорошо растворим в воде: при 20 С в 1 объёме воды растворяется до 700 объёмов аммиака.
Д
 .О. «Фонтан» При растворении в воде образуется гидроксид аммония – основание, поэтому фенолфталеин окрашивает раствор в малиновый цвет.
.О. «Фонтан» При растворении в воде образуется гидроксид аммония – основание, поэтому фенолфталеин окрашивает раствор в малиновый цвет.Постановка проблемы. Почему аммиак очень хорошо растворяется в воде?
Учащиеся выписывают из учебника определение водородной связи
и примеры веществ
Аммиак – ядовит.
Химические свойства:
-
Демонстрационный эксперимент:
Проводят опыт, потирая друг о друга стеклянные палочки, одна смочена раствором аммиака, а другая – раствором соляной кислотой. Что вы наблюдаете?( Дым.)
Теперь бы вы смогли объяснить англичанам, почему между кораблем и судном противника появился едкий «дым», образовался хлорид аммония.
(записываем в опорный конспект и оформляем на доске химическое уравнение между соляной кислотой и аммиаком)
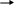 NН3 +НСI NН4 СI (образование солей аммония, удобрения)
NН3 +НСI NН4 СI (образование солей аммония, удобрения)-
Взаимодействие с оксидами ( Н2О) Оформление в опорном конспекте и оформление на доске.
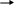 NН3 +НОН NН4 ОН Нашатырный спирт
NН3 +НОН NН4 ОН Нашатырный спирт-
Взаимодействие с серной кислотой (оформление опорного конспекта и оформление на доске)
N
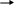
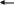 Н3 + Н2 SО4 N Н4 НSО4 Недостаток гидросульфат аммония
Н3 + Н2 SО4 N Н4 НSО4 Недостаток гидросульфат аммония-
Аммиак горит в кислороде (оформление опорного конспекта и оформление на доске)
4
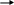 NН3 + 3О2 2N2 + 6Н2О
NН3 + 3О2 2N2 + 6Н2О Применение:
-
Производство азотной кислоты. -
Для получения аммиачной воды. -
Производство азотных удобрений. -
В медицине, в быту. -
В холодильных установках. -
Для паяния. -
Взрывчатых веществ.
-
Проверка усвоения знаний (7 мин.)
-
При синтезе аммиака промышленным способом, азот объёмом 50 л. (н.у.) прореагировал с водородом, взятом в избытке. Выход продукта составил 50%. Рассчитайте объём и массу полученного аммиака. -
Какая масса хлорида аммония получится при взаимодействии 3 моль аммиака с соляной кислотой? -
Какой объём кислорода потребуется для сжигания 34 г. аммиака?
4
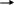
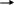
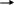
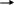
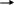
.Азот аммиак оксид азота (II ) нитрат аммония аммиак азот
5.Напишите четыре уравнения химических реакций, в результате которых образуется аммиак.
6. Составьте уравнения следующих реакций и назовите продукты:
-
2NH3 + H2SO4 → -
NH3 + H2SO4 →
-
NH3 + H3PO4 → -
2NH3 + H3PO4 → -
3NH3 + H3PO4 →
Ответ:
-
2NH3 + H2SO4 →(NH4)2SO4
сульфат аммония
-
NH3 + H2SO4 →NH4НSO4
гидросульфат аммония
-
NH3 + H3PO4 →NH4Н2РO4
дигидрофосфат аммония
-
2NH3 + H3PO4 →(NH4)2НРO4
гидрофосфат аммония
-
3NH3 + H3PO4 →(NH4)3РO4
-
Подведение итогов урока. Рефлексия. Домашнеезадание.(3 мин.)
Учитель организует фронтальную беседу по рефлексии итогов урока.
Объясняет домашнее задание:
§25,упр. 1-5.
Получение аммиака выучить самостоятельно.
Технологическая карта урока химии в 9 классе по теме: «Аммиак»
| № | Этап урока | Деятельность учителя | Деятельность ученика | Время (в мин.) |
| 1 | 2 | 3 | 4 | 5 |
| 1 | Организационный этап | Объявление темы урока, задач, беседа с целью выявления знаний учащихся об аммиаке (Что они уже знают об аммиаке) | Отвечают на вопросы учителя Запись в тетради темы урока | 2 мин |
| 2 | Опрос-повторение | Учитель задает вопросы. | Учащиеся отвечают. | 5 мин |
| 3 | Мотивационно - ориентировочный этап | Создание проблемной ситуацииВводное слово учителя | Учащиеся слушают, пытаются объяснить явление. | 5 мин |
| 4 | Операционно – исполнительский этап. | | | 23 мин |
| 4-1.Состав и строение молекулы аммиака | Организует работу учащихся в группах | Записывают формулу аммиака, собирают шаро-стержневую модель, зарисовывают молекулу | 3 мин | |
| 4-2. Физические свойства аммиака | Организует групповую работу учащихся. | Изучают физические свойства аммиака и записывают в конспект | 5 мин | |
| 4-3. Водородная связь | Постановка проблемы. Почему аммиак очень хорошо растворяется в воде? | Выписывают из учебника определение водородной связи и примеры веществ | 5 мин | |
| 4-4. Химические свойства аммиака. | Учитель объясняет новый материал. | Учащиеся слушают и оформляют конспект. | 7 мин | |
| 4-5. Применение аммиака. | Учитель организовывает работу учащихся с учебником и презентацией. | Выписывают из учебника основные направления применения аммиака | 3 мин. | |
| 5 | Проверка усвоения знаний | Организует фронтальный опрос по подготовленным вопросам. | Учащиеся выполняют задания у доски и в тетради. | 7 мин |
| 6 | Подведение итогов урока. Рефлексия. Домашнее задание. | Организует фронтальную беседу по рефлексии итогов урока. Объясняет домашнее задание. | Записывают домашнее задание: §25,упр. 1-5. Получение аммиака выучить самостоятельно. | 3мин |
