ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 28.07.2024
Просмотров: 219
Скачиваний: 0
СОДЕРЖАНИЕ
Техническая термодинамика и основы теории теплообмена
2. Измерить температуру термоэлектрическим термометром.
1.2. Биметаллические преобразователи температуры.
1.3. Манометрические термометры.
1.4. Термометры, основанные на температурной зависимости электрического сопротивления.
1.6. Термоэлектрические термометры.
2. Описание лабораторного стенда и порядок выполнения работы.
Измерение теплоёмкости воздуха
Определение теплопроводности твердых материалов методом плоского слоя
2. Определить зависимость коэффициента теплопроводности от температуры
2.1. Теплоотдача от горизонтальной трубы (поперечное обтекание).
2.1.1.Описание лабораторного стенда.
Температурный коэффициент объёмного расширения.
Коэффициент кинематической вязкости.
2.2. Теплоотдача от вертикальной трубы (продольное обтекание).
2.2.1.Описание лабораторного стенда.
Согласно молекулярно-кинетической теории показатель адиабаты для идеального газа не зависит от его температуры, а определяется только числом степеней молекулы газа. Для одноатомных газов k=1,66, для 2-х атомныхk=1,4, для 3-х и многоатомныхk=1,33.
Поскольку k1, то в координатахp-vлиния адиабаты идет круче линии изотермы. На рис.4 представлен график адиабатного процесса в сравнении с графиком изотермического.
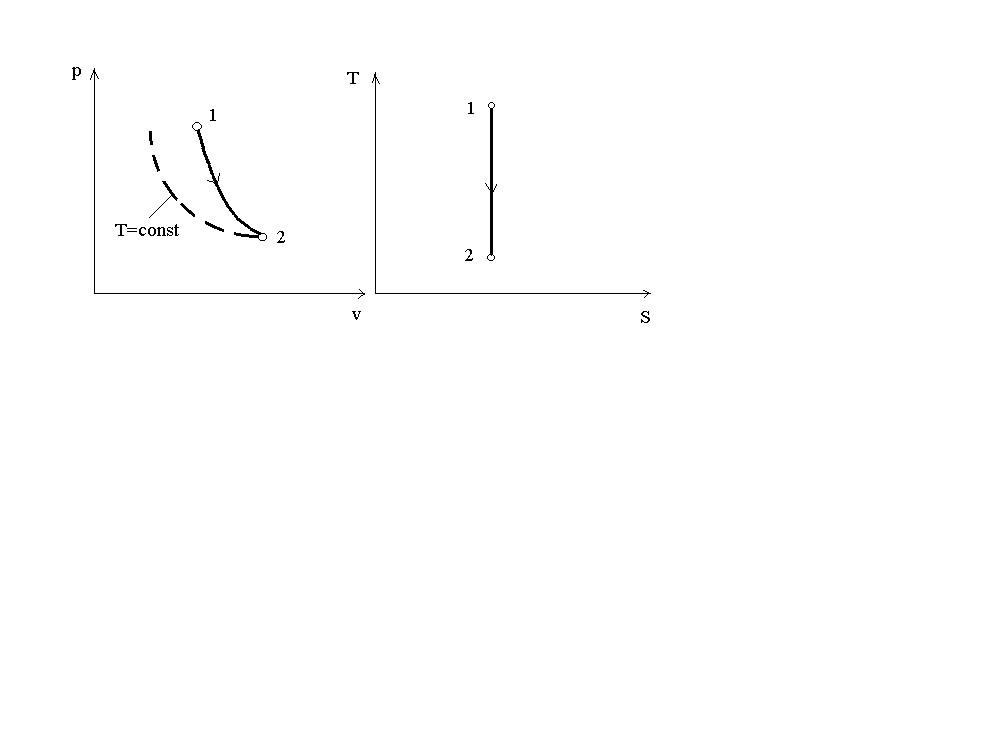
Рис. 4. График адиабатного процесса
При адиабатном расширении давление понижается быстрее, чем при изотермическом расширении, т.к. при этом происходит уменьшение температуры газа.
Параметры состояния в адиабатном процессе связаны следующими соотношениями
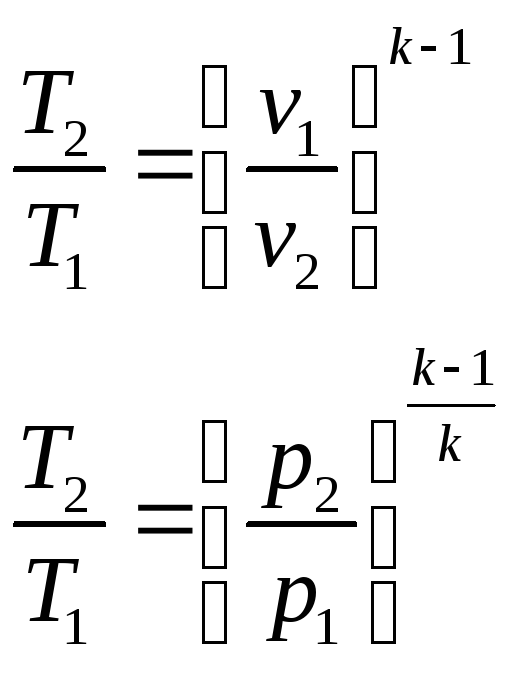
Изменение внутренней энергии системы:
![]()
Работа изменения объёма системы:
Согласно 1-му закону термодинамики
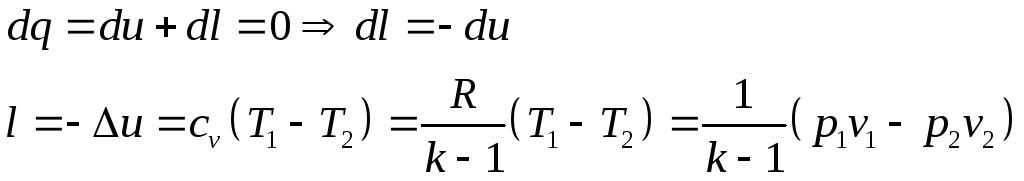
Таким образом, в адиабатном процессе работа совершается за счет изменения внутренней энергии системы.
Изменение энтропии:
![]()
В связи с тем, что в адиабатном процессе энтропия системы остается постоянной, иное название этого процесса – изоэнтропный.
Политропные процессы.
Политропными называются процессы, в которых изменяются все параметры состояния и имеет место теплообмен системы с внешней средой. Все эти процессы могут быть описаны общим уравнением вида
![]()
где n– показатель политропы, который может принимать любое значение в пределах от -до +, но для данного процесса остается постоянной величиной – индивидуальной характеристикой процесса.
Для политропных процессов характерны следующие соотношения между параметрами состояния
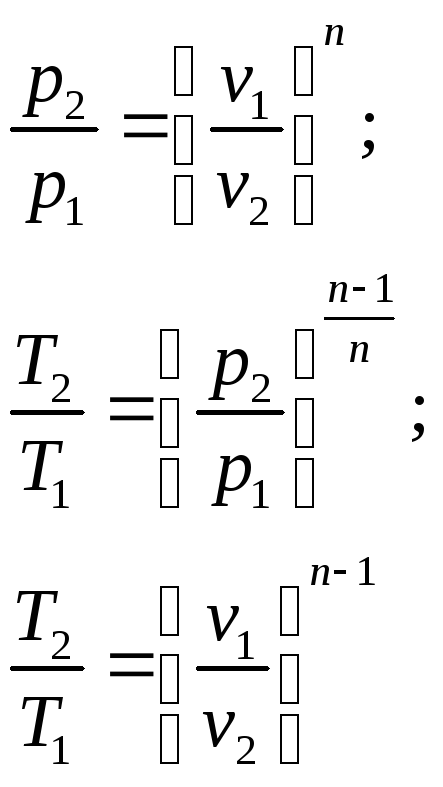
Работа изменения объёма:
![]()
Количество подведенной (отведенной) в процессе теплоты:
![]() ,
,
где
![]() - теплоемкость идеального газа в
политропном процессе. При постоянныхcv,k,nтеплоемкость сn=const,
поэтому политропные процессы ещё
называютпроцессами
при постоянной теплоемкости.
- теплоемкость идеального газа в
политропном процессе. При постоянныхcv,k,nтеплоемкость сn=const,
поэтому политропные процессы ещё
называютпроцессами
при постоянной теплоемкости.
Изменение энтропии
![]()
Все ранее рассмотренные термодинамические процессы по отношению к политропному являются его частными случаямии могут быть описаны уравнением политропы при характерных для этих процессов значениях показателя политропыn, представленных в таблице 1.
Таблица 1.
|
Процесс |
Значение n |
Теплоемкость |
|
Изохорный |
|
Cv |
|
Изобарный |
0 |
Cp |
|
Изотермический |
1 |
|
|
Адиабатный |
k |
0 |
На рис.5 представлена диаграмма политропных процессов.
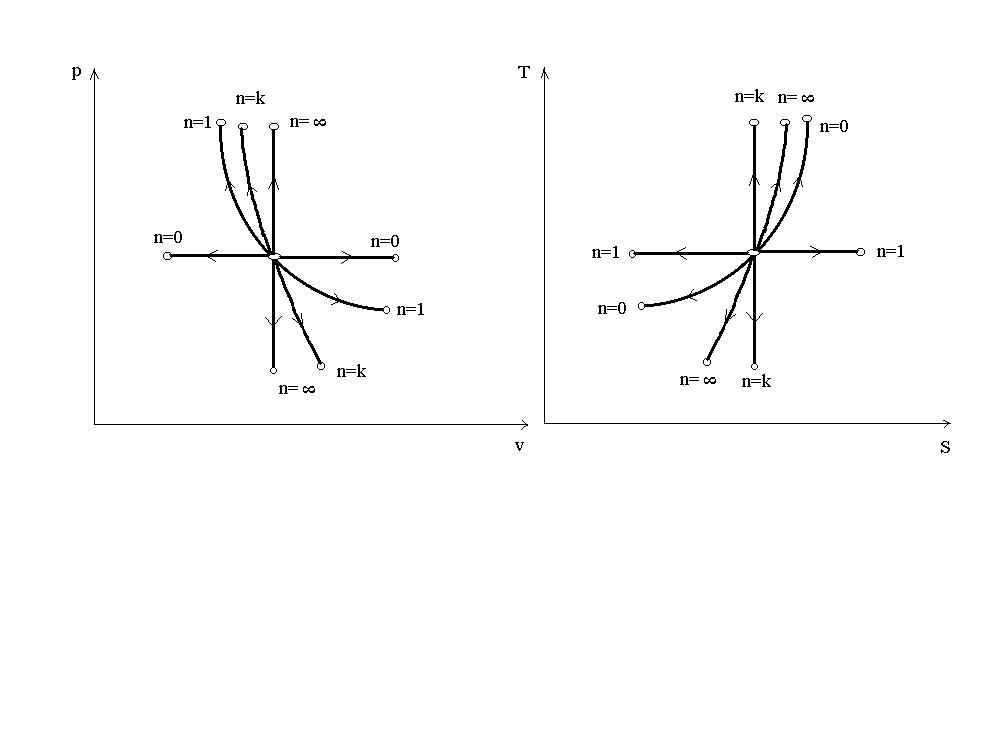
Рис. 5. Диаграмма политропных процессов.
Все процессы начинаются в одной точке («в центре»). Изохора (n=) делит все поле диаграммы на две области: процессы, находящиеся правее изохоры, характеризуются положительной работой, т.к. сопровождаются расширением рабочего тела. Для процессов, расположенных левее изохоры, характерна отрицательная работа.
Процессы, расположенные правее и выше адиабаты, идут с подводом теплоты к рабочему телу. Процессы, лежащие левее и ниже адиабаты, протекают с отводом теплоты.
Для процессов, расположенных над изотермой(n=1), характерно увеличение внутренней энергии газа. Процессы, расположенные под изотермой, сопровождаются уменьшением внутренней энергии.
Процессы, расположенные между адиабатой и изотермой, имеют отрицательную теплоемкость, т.к.dqиdu(а значит иdT) имеют в этой области противоположные знаки. В таких процессах работа расширения больше, чем количество подводимой теплоты (lq), и поэтому, чтобы выполнялся 1-й закон термодинамики, на её совершение затрачивается часть внутренней энергии системы. В случае сжатия газа в этих процессах работа сжатия больше, чем количество отводимой от системы теплоты, а значит, чтобы выполнялся 1-й закон термодинамики, избыточная часть энергии в форме работы затрачивается на увеличение внутренней энергии системы, следовательно, температура системы возрастает.
ОПИСАНИЕ ЛАБОРАТОРНОГО СТЕНДА.
Схема лабораторного стенда представлена на рис. 6.
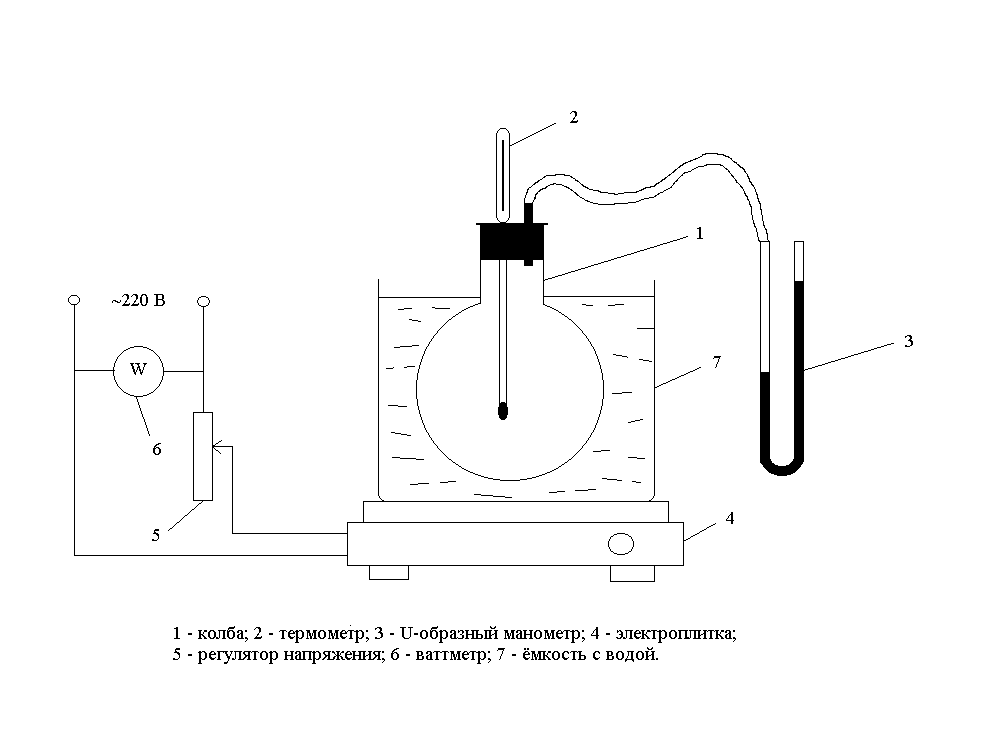
Рис. 6. Схема лабораторного стенда
В качестве термодинамической системы принимается плотно закрытая стеклянная колба 1 с постоянным количеством воздуха (V=const), соединенная сU-образным водяным манометром 3. Колба помещена в емкость с водой 7, устанавливаемую на электрическую плитку 4. Температура воздуха в колбе в каждый момент времени измеряется жидкостным стеклянным термометром 2. Измерения должны выполняться при «квазистационарных» температурных режимах, т.е. при минимальном темпе нагрева воздуха в колбе, задаваемом с помощью регулятора напряжения 5. Для измерения мощности в цепь включен ваттметр 6.
ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ.
3.1. Опустить колбу в емкость с водой, проверив, чтобы вода в ёмкости полностью закрывала стеклянную колбу.
3.2. Записать начальные значения параметров состояния воздуха в колбе и атмосферное давление. Для этого в лаборатории должен быть барометр.
3.3. Включить установку, с помощью регулятора напряжения установить мощность нагревателя электроплитки так, чтобы скорость нагрева не превышала 2 градуса в течение 5 минут.
Через каждые 2 градуса изменения температуры в протокол измерений (см. табл.2) заносить показания термометра и манометра.
Таблица 2.
|
Номер замера |
Температура |
Избыточное давление |
Атмосферное давление, Па |
Абсолютное давление, Па |
||
|
С |
К |
Мм вод. Ст. |
Па |
|||
|
1 2 3 4 5 . . . i |
|
|
|
|
|
|
3.5. Измерения заканчиваются, когда столбик воды в трубке U-образного манометра начнет подходить к верхнему уровню.
3.6. После последнего замера быстро поднять колбу из емкости с водой.
3.7. Установить регулятор напряжения в начальное положение и выключить установку.
ОБРАБОТКА РЕЗУЛЬТАТОВ ИЗМЕРЕНИЙ.
По экспериментальным данным построить зависимость
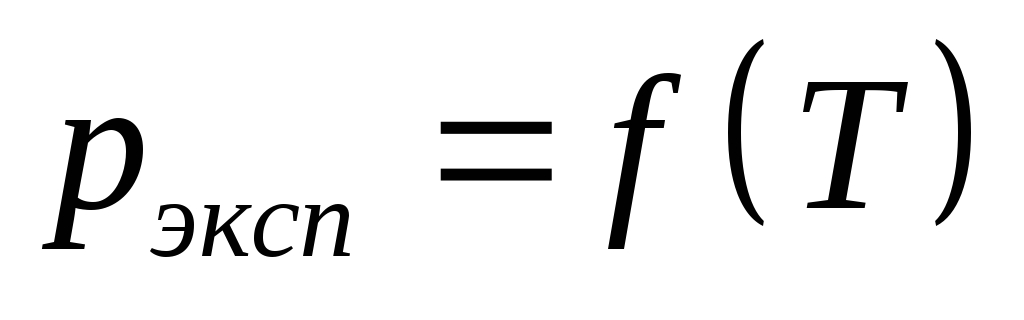 ,
учитывая, что в качестве параметров
состояния используютсяабсолютное
давление и абсолютная температура.
,
учитывая, что в качестве параметров
состояния используютсяабсолютное
давление и абсолютная температура.
На этом же графике построить теоретическую зависимость
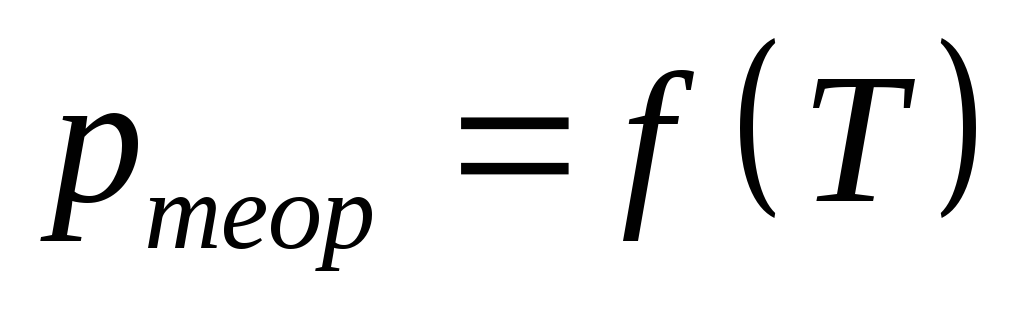 ,
рассчитав по уравнению изохорного
процесса значения давления системы
при соответствующих значениях
температуры. Расчеты первых 2-х значений
привести в протоколе полностью,
остальные результаты свести в таблицу.
,
рассчитав по уравнению изохорного
процесса значения давления системы
при соответствующих значениях
температуры. Расчеты первых 2-х значений
привести в протоколе полностью,
остальные результаты свести в таблицу.
Определить изменение внутренней энергии системы при условии, что теплоемкость системы постоянная (можно принять
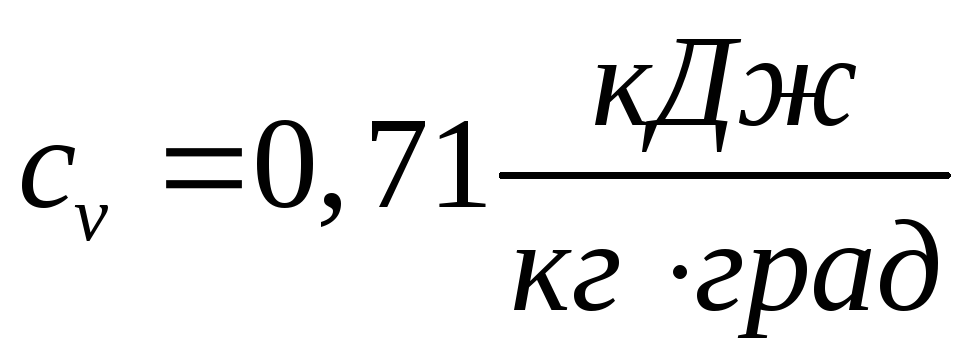 ).
).
Определить изменение энтропии системы при постоянной теплоемкости.
На основе анализ полученных графиков определить максимальную относительную погрешность экспериментальных данных.
КОНТРОЛЬНЫЕ ВОПРОСЫ.
Что называется термодинамическим процессом?
Какие характеристики процесса определяются при типовой схеме его изучения?
Дать характеристику основным термодинамическим процессам в соответствии с типовой схемой.
Какие процессы называются политропными?
Какие процессы и почему называются частными случаями политропного процесса?
Дать физическую интерпретацию диаграммы политропных процессов.