Файл: Учебнометодическое пособие Тюмень, 2018 удк 54 н 24. 1 Рецензенты.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 11.01.2024
Просмотров: 268
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Вещества с ковалентными связями могут быть молекулярными и немолекулярными. Это существенно сказывается на их физических свойствах.
Молекулярные вещества состоят из молекул, связанных между собой слабыми межмолекулярными связями, к ним относятся: H2, O2, N2, Cl2, Br2, S8, P4 и другие простые вещества; CO2, SO2, N2O5, H2O, HCl, HF, NH3, CH4, C2H5OH, органические полимеры и многие другие вещества. Эти вещества не обладают высокой прочностью, имеют низкие температуры плавления и кипения, не проводят электрический ток, некоторые из них растворимы в воде или других растворителях.
Немолекулярные вещества с ковалентными связями или атомные вещества (алмаз, графит, Si, SiO2, SiC и другие) образуют очень прочные кристаллы (исключение - слоистый графит), они нерастворимы в воде и других растворителях, имеют высокие температуры плавления и кипения, большинство из них не проводит электрический ток (кроме графита, обладающего электропроводностью, и полупроводников - кремния, германия).
Все ионные вещества, естественно, являются немолекулярными. Это твердые тугоплавкие вещества, растворы и расплавы которых проводят электрический ток. Многие из них растворимы в воде. Следует отметить, что в ионных веществах, кристаллы которых состоят из сложных ионов, есть и ковалентные связи, например: (Na+)2(SO42-), (K+)3(PO43-), (NH4+)(NO3-) и т. д. Ковалентными связями связаны атомы, из которых состоят сложные ионы.
Металлы (вещества с металлической связью) очень разнообразны по своим физическим свойствам. Среди них есть жидкость (Hg), очень мягкие (Na, K) и очень твердые металлы (W, Nb).
Характерными физическими свойствами металлов является их высокая электропроводность (в отличие от полупроводников, уменьшается с ростом температуры), высокая теплоемкость и пластичность (у чистых металлов).
В твердом состоянии почти все вещества состоят из кристаллов. По типу строения и типу химической связи кристаллы ("кристаллические решетки") делят на атомные (кристаллы немолекулярных веществ с ковалентной связью), ионные (кристаллы ионных веществ), молекулярные (кристаллы молекулярных веществ с ковалентной связью) и металлические (кристаллы веществ с металлической связью).
4.3.Вопросы для самоконтроля
1. Ионная связь. Охарактеризуйте механизм образования связи.
2. Ковалентная связь. Типы ковалентной связи.
3. Охарактеризуйте все типы гибридизации.
4. Металлическая связь. Особенности образования этой связи.
5. Водородная связь. Типы водородной связи.
6. Вещества и особенности строения.
4.4.Контрольные задания
41-50. Для предложенного в вашем задании (табл. 6) соединения постройте графическую формулу и укажите виды химической связи в этой молекуле. Покажите, какие (какая) связи «рвутся» при диссоциации. Объясните, что такое водородная связь? Приведите примеры её влияния на свойства вещества.
Таблица 6
| № задания | Соединения |
| 41 | гидросульфат натрия |
| 42 | карбонат алюминия |
| 43 | тиосульфат натрия |
| 44 | гидрокарбонат кальция |
| 45 | гидросульфит натрия |
| 46 | дигидрофосфат кальция |
| 47 | гидрофосфат кальция |
| 48 | нитрит аммония |
| 49 | гидроксонитрат кальция |
| 50 | фосфат алюминия |
Глава 5
Химическая кинетика и химическое равновесие
5.1.Химическая кинетика
Химические реакции протекают с различными скоростями. Некоторые из них полностью заканчиваются за малые доли секунды (взрыв), другие осуществляются за минуты, часы, дни и большие промежутки времени. Кроме того, одна и та же реакция может в одних условиях (например, при повышенных температурах) протекать быстро, а в других (например, при охлаждении) – медленно. При этом различие в скорости одной и той же реакции может быть очень большим.
Раздел химии, изучающий скорости химических реакций, называется химической кинетикой.
При рассмотрении вопроса о скорости реакций необходимо различать гомогенные и гетерогенные реакции. С этими понятиями тесно связано понятие фазы.
Фазой называется часть системы, отделенная от других ее частей поверхностью раздела
, при переходе через которую свойства изменяются скачком.
Гомогенная реакция протекает в объеме фазы (пример – взаимодействие водорода и кислорода с образованием водяного пара:
H2(г) + O2(г)→ H2O(г),
а если реакция гетерогенна, то она протекает на поверхности раздела фаз (например, горение углерода):
C(т) + O2(г) → CO2(г)].
Скоростью гомогенной реакции называется количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени в единице объема фазы:
где n – количество вещества, моль; V – объем фазы, л; τ – время; С – концентрация, моль/л.
Скоростью гетерогенной реакции называется количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени на единице площади поверхности фазы:
где S – площадь поверхности раздела фаз.
К важнейшим факторам, влияющим на скорость гомогенной реакции, являются следующие: природа реагирующих веществ, их концентрации, температура, присутствие катализаторов.
Зависимость скорости реакции от концентраций реагирующих веществ. Реакция между молекулами происходит при их столкновении. Поэтому скорость реакции пропорциональна числу соударений, которые претерпевают молекулы реагирующих веществ. Число соударений тем больше, чем выше концентрация каждого из исходных веществ. Например, скорость реакции
A + B → C пропорциональна произведению концентраций А и В:
v = k·[A]·[B] ,
где k – коэффициент пропорциональности, называемый константой скорости реакции. По смыслу величина k равна скорости реакции для случая, когда концентрации реагирующих веществ равны 1 моль/л.
Это соотношение выражает закон действия масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ.
Гораздо реже реакция осуществляется в результате одновременного столкновения трех реагирующих частиц. Например, реакция
2А+В → А2В
может протекать путем тройного столкновения:
А+А+В → А2В
Тогда в соответствии с законом действия масс концентрация каждого из реагирующих веществ входит в выражение скорости реакции в степени, равной коэффициенту в уравнении реакции:
v = k·[A]·[A]·[B] = k·[A]2[B]
Сумма показателей степени в уравнении закона действия масс называется порядком реакции. Например, в последнем случае реакция имеет третий порядок (второй - по веществу A и первый - по веществу B.
Зависимость скорости реакции от температуры. Если воспользоваться результатами подсчета числа столкновений между молекулами, то количество столкновений окажется настолько большим, что все реакции должны будут протекать мгновенно. Это противоречие можно объяснить тем, что в реакцию вступают лишь молекулы, обладающие некоторой энергией.
Избыточная энергия, которой должны обладать молекулы для того, чтобы их столкновение могло привести к образованию нового вещества, называется энергией активации (рис. 1)
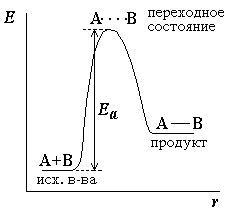
Рисунок 1 – Энергетическая диаграмма для реакции образования
продукта АВ из исходных веществ А и В.
Если энергия столкновения молекул А и В больше или равна энергии активации Еа, то энергетический барьер преодолевается, и происходит перемещение вдоль координаты реакции r от исходных веществ к продукту. Иначе имеет место упругое столкновение молекул А и В. Вершина энергетического барьера соответствует переходному состоянию (активированному комплексу), в котором связь А–В образовалась частично.
С ростом температуры число активных молекул возрастает. Следовательно, скорость химической реакции должна увеличиваться с ростом температуры. Возрастание скорости реакции при нагревании принято характеризовать температурным коэффициентом скорости реакции (γ) – числом, показывающим, во сколько раз возрастает скорость данной реакции при повышении температуры на 10 градусов. Математически эта зависимость выражается правилом Вант-Гоффа:
где v1 – скорость при температуре t1; v2 – скорость при температуре t2. Для большинства реакций температурный коэффициент γ лежит в пределах от 2 до 4.
Влияние катализаторов на скорость реакции.
Катализатор
– это вещество, не расходующееся в процессе протекания реакции, но влияющее на ее скорость.
Явление изменения скорости реакции под действием таких веществ называется катализом. Обычно катализаторами называют вещества, увеличивающие скорость реакции, а ингибиторами – вещества, замедляющие протекание реакции. В большинстве случаев действие катализатора объясняется тем, что он снижает энергию активации реакции (рис. 2).
А + В → АВ – некаталитическая реакция
А + С + В → АС + В → АВ + С – каталитическая реакция (С – катализатор)
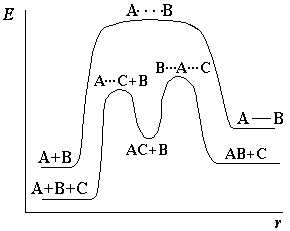
Рисунок 2 – Энергетическая диаграмма каталитической реакции в сравнении с некаталитической.
В присутствии катализатора реакция проходит через другие промежуточные стадии, чем без него, причем эти стадии протекают с меньшими энергиями активации. Иначе говоря, в присутствии катализатора возникают другие переходные состояния, чем без него, и для их образования требуется меньше энергии, чем для образования переходных состояний, возникающих без катализатора. В результате скорость реакции возрастает.
Пример: Вычислите, во сколько раз увеличится скорость реакции, протекающей в газовой фазе, при повышении температуры от 30 до 70оС, если температурный коэффициент реакции равен 2.
Решение. Зависимость скорости химической реакции от температуры определяется эмпирическим правилом Вант-Гоффа по формуле:
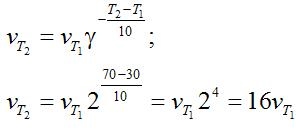
Следовательно, скорость реакции νТ2 при температуре 70°С больше скорости реакции νТ1при температуре 30°С в 16 раз.
5.2.Химическое равновесие
Все химические реакции можно разделить на две группы: необратимые и обратимые реакции. Необратимые реакции протекают до конца (до полного расхода одного из реагентов), а в обратимых ни одно из реагирующих веществ не расходуется полностью, потому что обратимая реакция может протекать как в прямом, так и в обратном направлении.
Пример необратимой реакции:
Zn + 4HNO3 → Zn(NO3)2 + 2NO2↑ + 2H2O
Пример обратимой реакции:
H2 + I2 ⇄ 2HI
Вначале скорость прямой реакции vпр велика, а скорость обратной реакции