Добавлен: 12.01.2024
Просмотров: 128
Скачиваний: 3
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Трубки катализатора непрерывно разрушаются из-за суровых условий в печи с момента их ввода в эксплуатацию. Верхний предел температуры стенки трубы в основном определяется расчетной температурой трубы. Если температура слишком высокая, существует высокий риск преждевременного повреждения ползучести и образования кокса, что приводит к выходу из строя трубки и ограничению технологического потока. Непрерывная работа при температуре всего на 20 градусов выше, чем расчетная температура сократит срок службы трубки вдвое. С другой стороны, температура инструментов приводит к снижению объема производства и снижению прибыли. Рабочие переменные, которые определяют оптимальную температуру оболочки трубки, включают расход топлива, соотношение пара и углерода и скорость подачи газа. В целом, для того, чтобы оптимизировать срок службы труб и производительность установки, рабочие температуры должны поддерживаться на минимальном уровне расчетной температуры. Основной проблемой повышения технологических параметров установок парового риформинга являются материалы, используемые при проектировании реакционного оборудования, в частности, каталитических трубок. Дальнейшей задачей работы можно считать изучение материалов, применяемых в конструировании каталитических труб печей риформинга.
2.2 Механизм реакций конверсии
Химические процессы взаимодействия метана с парами воды с целью получения технологического газа — смеси водорода и окиси углерода — изучаются длительное время. Это объясняется сравнительной дешевизной и доступностью исходных веществ и необходимостью разработки экономически выгодных методов получения смеси газов, пригодных для химического синтеза.
В литературе опубликовано значительное количество работ по исследованию конверсии метана парами воды, но среди них мало работ по изучению механизма протекания данного процесса.
Так, например, в работе А. Лейбуш с сотрудниками [5] предложен механизм конверсии метана парами воды, в основу которого взята схема термического распада метана по Касселю [6]. Каждый из продуктов этого распада, начиная с метана, взаимодействует с парами воды с образованием окиси углерода и водорода. Таким образом, принимается, что протекают два основных направления реакций — термическое разложение метана и взаимодействие метана и его продуктов с парами воды. Этот механизм реакций не может быть принят, так как часть реакций не является элементарной и энергетически не оправдана.
Конверсия метана парами воды до водорода и окиси углерода описывается следующим уравнением:
СН4 + Н2O = СО + ЗН2 — 49,3 ккал/моль (4)
Тепловой эффект этого процесса установлен из данных по энтальпии исходных и конечных продуктов реакции и равен 49,3 ккал/моль, что, очевидно, является достаточно точным. Данная величина может быть принята в основу расчета и проверки тепловых эффектов элементарных реакций с использованием данных по энергии разрыва связей атомов в молекулах и радикалах. Анализ литературных данных и тепловых эффектов различных вариантов элементарных реакций показывает, что процесс взаимодействия метана с парами воды протекает по радикальному механизму и может быть представлен следующими стадиями:
| | Н°298 , ккал/моль | , ккал/моль |
| 1. СН4 =СН3 + Н | 103 | (103) |
| 2. СН3 + Н2O= Н3СОН + Н | 30,5 | 34,3 |
| 3. НзСОН = НаСОН + Н | 92 | (92) |
| 4. Н2СОН==Н3СO | 8 | 17,5 |
| 5. Н3СО=Н2СО + Н | 17 | 24,3 |
| 6. Н2СО = НСО + Н | 77 | (77) |
| 7. НСО = СО + Н | 34 | 37,0 |
| 8. 6Н = ЗН2 | 312,6 | |
| СН4 + Н2O = СО + ЗН2 | 48,9 | |
Погрешности в расчетах составляют 0,4 ккал/моль, что вполне допустимо для недостаточно точных значений энергии разрыва связей в радикалах. Реакция (8) приведена в общем виде для суммирования тепловых эффектов. В действительности атомарный водород расходуется в основном на реакции, обусловливающие радикально-цепной механизм процесса. Энергии активации () реакций даны по приближенному уравнению Н. Н. Семенова [7].
Если не учитывать первую реакцию образования радикалов метила и атомарного водорода, которая, очевидно, ускоряется в гетерогенных условиях, скорость суммарного процесса обусловливается реакцией (7) и (2) взаимодействия метила с парами воды с затратой 30,5 ккал/моль тепла. По уравнению Н. Н. Семенова энергия активации этой реакции равна 34,4 ккал/моль и, следовательно, может протекать при сравнительно невысоких температурах.
3 Схема трубчатой печи 1 – ой ступени паровой конверсии метана
Oптимальные условия процесса паровой конверсии метана:
- Ni - катализатор;
- 800 - 900 0С;
- соотношение Н2 O/СН4 2-3;
- Р = 2 - 5 МПа.
В промышленности паровую конверсию метана (I этап конверсии метана) для получения азотоводородной смеси обычно комбинируют с паровоздушной конверсией (вторичный риформинг) – II этап конверсии метана.
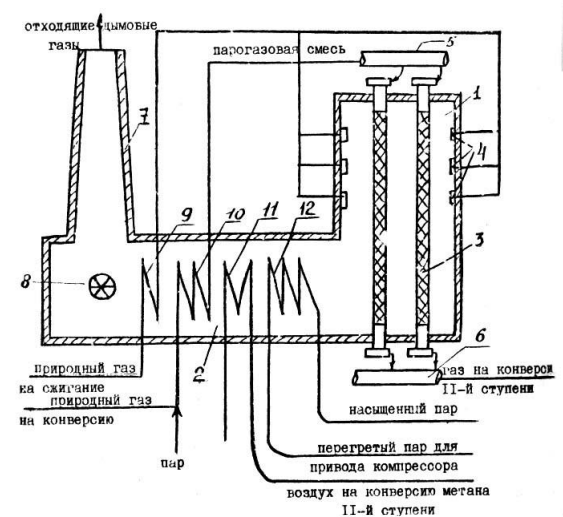
Рисунок 7 – Схема трубчатой печи 1 – ой ступени паровой конверсии метана
1 - топливная камера печи (реакционная зона), 2 - конвекционная камера печи, 3 - реакционные трубы с катализатором, 4 - горелки, 5 - газоподводящий коллектор, 6 - газоотводящий коллектор, 7 - выхлопная труба, 8 - дымосос, 9 - подогреватель природного газа, 10 - подогреватель парогазовой смеси, 11 - подогреватель воздуха, 12- перегреватель парового котла утилизатора.
В реакционной (1) камере трубчатой печи (рис. 7) размещены реакционные трубы 11 (количество трубок – 500, длина примерно 10 м), заполненные никелевым катализатором паровой конверсии метана (реакция 1), и горелки 4, в которых сжигается природный или горючий газ для создания высокой температуры (800 - 900 0С), необходимой для проведения эндотермической реакции паровой конверсии метана. Образовавшиеся дымовые газы обогревают трубы с катализатором, затем поступают в конвекционную камеру (2) трубчатой печи, где их тепло 20 используется для нагрева: парогазовой смеси 10, природного газа 9, воздуха для шахтного конвертора 11, перегревателя пара высокого давления 12 и питательной воды 7. Смесь пара и очищенного природного газа, нагретая в подогревателе 10 до температуры 525 0С, под давлением 3,7 МПа поступает в вертикально расположенные трубы 3 (рис. 3), заполненные катализатором. Выходящая из трубчатого реактора парогазовая смесь содержит 9 - 10 % неконвертированного метана. При температуре 850 0С этот газ поступает в конвертор метана II-ой ступени 13– реактор шахтного типа. В его верхнюю часть компрессором 19 подается технологический воздух, нагретый в конвекционной зоне трубчатой печи (2) до 480 - 500 0С. Шахтный реактор в рассматриваемой схеме выполняет две важные функции: увеличение конверсии метана за счет значительного повышения температуры (до 1000 0С) по сравнению с температурой в трубчатой печи (800 - 900 0С) и приготовление смеси газов с необходимым содержанием азота для последующего синтеза аммиака. В шахтном конверторе практически полностью реагирует кислород воздуха [8].
Заключение
Интерес к топливным элементам возрос из-за их высокой эффективности и, в идеале, отсутствия выбросов. Одним из представляющих интерес топливных элементов является твердооксидный топливный элемент. Он может работать при высоких температурах в диапазоне 700-1000 oC, что позволяет использовать CO и даже низкоуглеводороды, такие как CH4, непосредственно в качестве топлива, в отличие от низкотемпературных топливных элементов, для которых требуется H2.
Для продвижения технологии топливных элементов одним из интересных исследований были катализаторы. В прошлом большое внимание уделялось приготовлению катализаторов и оценке процесса и оборудования при незначительной работе над кинетикой и механизмом реакции. Кроме того, разработка установок риформинга для углеводородных топлив требует хорошего понимания фундаментальных механизмов и исследований кинетики. Кинетика парового риформинга ранее изучалась многими группами, такими как Темкин и др., а также Сюй и Фромант.
В будущей работе выражение ставки будет рассмотрено более подробно, чтобы определить, верны ли допущения, сделанные для получения выражения ставки. Это было бы сделано с помощью системы схемотехнического проектирования, чтобы помочь в подтверждении того, удалены ли предполагаемые шаги являются правильными. Далее, после подтверждения выражения скорости, необходимо выполнить дополнительную экспериментальную работу. Единственные экспериментальные данные, которые были получены, касались только прямой реакции. Кроме того, реверс и промежуточное условие подачи. Кроме того, промежуточные условия подачи позволят сравнить экспериментально определенный порядок реакции с тем, который предсказан моделью.
Будут проведены эксперименты с условиями дополнительного питания и порядком реакции. Также хотели бы использовать другие методы расчета поверхностной энергии, чтобы увидеть, изменят ли изменения параметров катализатора результат графика маршрута реакции. Надежность кинетики реакции имеет важное значение для используемого и описанного здесь подхода.
Изучены физико-химические закономерности процесса паровой конверсии метана и применяемое технологическое оборудование.
В работе произведены технологические расчеты (материальный и энергетический баланс,) работы установки с повышенной производительностью печи по природному газу. Рассмотрены характеристики сырья и продуктов процесса, а также используемого катализатора.
Список используемых источников
1. Syngas Production from Coal / IEA ETSAP - Technology Brief S01 – May 2010. Р. 1-5.
2. Матковский П.Е., Седов И.В., Савченко В.И. Технологии получения и переработки синтез-газа / Газохимия. – 2011. С. 77-84.
3. Кутепов А.М., Бондарева Т.И., Беренгартен М.Г. Общая химическая технология – М.: Академкнига, 2003. – 528 с.
4. Сафонов В.В., Смирнова С.Н., Цыганков В.Н. Производство водорода и водородосодержащих технологических газов. Учебное пособие. – М.: ИПЦ МИТХТ им. М.В. Ломоносова, 2003. - 20 с.
5. А. Г. Лейбуш, М.А. Людковская, Тр. Гос. н.-и. инст. и проекта, инст. азотн. пром., в. II, 62 (2012). 2 А. Лейбуш, Г. Берго, Журн. хим. пром., № 7, 1003 (2011).
6. L. S. Кassе1. J. Am. Chem. Soc , 54, 3949(2013).
7. James A. Liu. Kinetics, catalysis and mechanism of methane steam reforming / Degree of Master of Science in Chemical Engineering. - WPI Chemical Engineering Department, 2006.-118 р.
8. Rostrup-Nielsen, J.R., Catalytic Steam Reforming / Сatalysis Today Vol 18, 1993. – P. 305-324.
9. Fonseca A., Assaf E.M. Production of the hydrogen by methane steam reforming over nickel catalysts prepared from hydrotalcite precursors / Journal of Power Sources 142 ( 1 – 2 ), 2005. – P. 154-159.
10. Huang, T.-J., T.-C. Yu, and S.-Y. Jhao, Weighing Variation of Water-Gas Shift in Steam Reforming of Methane over Supported Ni and Ni-Cu Catalysts. Industrial and Engineering Chemistry, 2006. 45(1). Р.109-118