ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 16.08.2024
Просмотров: 15
Скачиваний: 0
Тепловой эффект химической реакции или изменение энтальпии системы вследствие протекания химической реакции — отнесенное к изменению химической переменной количество теплоты, полученное системой, в которой прошла химическая реакция и продукты реакции приняли температуру реагентов. Чтобы тепловой эффект являлся величиной, зависящей только от характера протекающей химической реакции, необходимо соблюдение следующих условий:
-
Реакция должна протекать либо при постоянном объёме Qv(изохорный процесс), либо при постоянном давлении Qp(изобарный процесс).
-
В системе не совершается никакой работы, кроме возможной при P = const работы расширения.
Если реакцию проводят при стандартных
условиях при Т = 298,15 К = 25 ˚С и Р = 1 атм =
101325 Па, тепловой эффект называют
стандартным тепловым эффектом реакции
или стандартной энтальпией реакции
ΔHrO. В термохимии
стандартный тепловой эффект реакции
рассчитывают с помощью стандартных
энтальпий образования.
Стандартная теплота образования
Под стандартной теплотой образования понимают тепловой эффект реакции образования одного моля вещества из простых веществ, его составляющих, находящихся в устойчивых стандартных состояниях. Например, стандартная энтальпия образования 1 моль метана из углерода и водорода равна тепловому эффекту реакции:
С(тв) + 2H2(г) = CH4(г) + 74.9 кДж/моль.
Стандартная энтальпия образования
обозначается ΔHfO.
Здесь индекс f означает formation (образование),
а перечеркнутый кружок, напоминающий
диск Плимсоля[1]
— то, что величина относится к стандартному
состоянию вещества. В литературе
часто встречается другое обозначение
стандартной энтальпии — ΔH298,150,
где 0 указывает на равенство давления
одной атмосфере (или, несколько более
точно, на стандартные условия[3]),
а 298,15 — температура. Иногда индекс 0
используют для величин, относящихся к
чистому веществу, оговаривая, что
обозначать им стандартные термодинамические
величины можно только тогда, когда в
качестве стандартного состояния выбрано
именно чистое вещество. Стандартным
также может быть принято, например,
состояние вещества в предельно
разбавленном растворе. «Диск
Плимсоля» в таком случае означает
собственно стандартное состояние
вещества, независимо от его выбора.
Энтальпия образования простых веществ
принимается равной нулю, причем нулевое
значение энтальпии образования относится
к агрегатному состоянию, устойчивому
при T = 298 K. Например, для йода
в кристаллическом состоянии ΔHI2(тв)0
= 0 кДж/моль, а для жидкого йода
ΔHI2(ж)0 = 22
кДж/моль. Энтальпии образования простых
веществ при стандартных условиях
являются их основными энергетическими
характеристиками. Тепловой эффект любой
реакции находится как разность между
суммой теплот образования всех продуктов
и суммой теплот образования всех
реагентов в данной реакции (следствие
закона
Гесса):
ΔHреакцииO =
ΣΔHfO (продукты) —
ΣΔHfO (реагенты)
Термохимические эффекты можно включать в химические реакции. Химические уравнения в которых указано количество выделившейся или поглощенной теплоты, называются термохимическими уравнениями. Реакции, сопровождающиеcя выделением тепла в окружающую среду имеют отрицательный тепловой эффект и называются экзотермическими. Реакции, сопровождающиеся поглощением тепла имеют положительный тепловой эффект и называются эндотермическими. Тепловой эффект обычно относится к одному молю прореагировавшего исходного вещества, стехиометрический коэффициент которого максимален.
Температурная зависимость теплового эффекта реакции
Чтобы рассчитать температурную зависимость энтальпии реакции, необходимо знать мольные теплоемкости веществ, участвующих в реакции. Изменение энтальпии реакции при увеличении температуры от Т1 до Т2 рассчитывают по закону Кирхгофа (предполагается, что в данном интервале температур мольные теплоемкости не зависят от температуры и нет фазовых превращений):
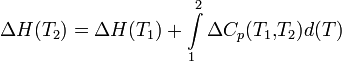
Если в данном интервале температур происходят фазовые превращения, то при расчёте необходимо учесть теплоты соответствующих превращений, а также изменение температурной зависимости теплоемкости веществ, претерпевших такие превращения:
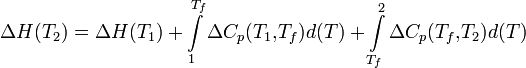
где ΔCp(T1,Tf) — изменение теплоемкости в интервале температур от Т1 до температуры фазового перехода; ΔCp(Tf,T2) — изменение теплоемкости в интервале температур от температуры фазового перехода до конечной температуры, и Tf — температура фазового перехода.
Стандартная энтальпия сгорания
Стандартная энтальпия сгорания — ΔHгоро, тепловой эффект реакции сгорания одного моля вещества в кислороде до образования оксидов в высшей степени окисления. Теплота сгорания негорючих веществ принимается равной нулю.
Стандартная энтальпия растворения
Стандартная энтальпия растворения — ΔHраство, тепловой эффект процесса растворения 1 моля вещества в бесконечно большом количестве растворителя. Складывается из теплоты разрушения кристаллической решетки и теплоты гидратации (или теплоты сольватации для неводных растворов), выделяющейся в результате взаимодействия молекул растворителя с молекулами или ионами растворяемого вещества с образованием соединений переменного состава — гидратов (сольватов). Разрушение кристаллической решетки, как правило, эндотермический процесс — ΔHреш > 0, а гидратация ионов — экзотермический, ΔHгидр < 0. В зависимости от соотношения значений ΔHреш и ΔHгидр энтальпия растворения может иметь как положительное, так и отрицательное значение. Так растворение кристаллического гидроксида калия сопровождается выделением тепла:
ΔHраствKOHо = ΔHрешо + ΔHгидрК+о + ΔHгидрOH−о = −59 КДж/моль
Под энтальпией гидратации — ΔHгидр, понимается теплота, которая выделяется при переходе 1 моля ионов из вакуума в раствор.
Стандартная энтальпия нейтрализации
Стандартная энтальпия нейтрализации — ΔHнейтро энтальпия реакции взаимодействия сильных кислот и оснований с образованием 1 моля воды при стандартных условиях:
HCl + NaOH = NaCl + H2O
H+ + OH− = H2O, ΔHнейтр° = −55,9 кДж/моль
Стандартная энтальпия нейтрализации для концентрированных растворов сильных электролитов зависит от концентрации ионов, вследствие изменения значения ΔHгидратации° ионов при разбавлении.