ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 25.10.2023
Просмотров: 19
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Мезомерный эффект (М) – это поляризующее влияние атомов или группы атомов, проявляющееся в смещении электронов π-связей или неподеленных электронных пар отдельных отдельных атомов (О, S, N) в сторону атомов с недостроенной до октета электронной облочкой. В результате на противоположных концах системы появляются одинаковые по величине, но разные по знаку заряды.
Мезомерный эффект (эффект сопряжения) характерен для соединений с сопряженными связями, в которых простые связи чередуются с кратными связями или (и) с атомами, имеющими неподеленные электронные пары (О, S, N).
Мезомерный эффект проявляется лишь в том случае, когда заместитель включен в сопряженную систему молекулы.
Благодаря подвижности π-электронов мезомерный эффект передаётся по системе сопряжённых связей без эффекта затухания.
Направление смещения электронной плотности под влиянием М-эффекта обозначается изогнутыми стрелками.
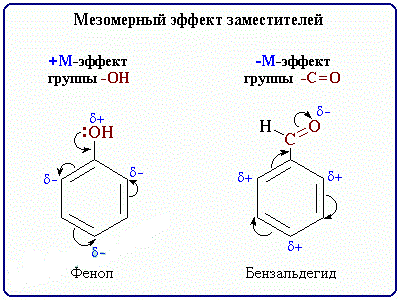 +М-эффектом обладают заместители, которые смещают электронную плотность по системе сопряжения от себя (повышают электронную плотность в сопряженной системе). К ним относятся группы, которые содержат атомы с неподеленной парой электронов, способные к передаче этой пары электронов в общую систему сопряжения.
+М-эффектом обладают заместители, которые смещают электронную плотность по системе сопряжения от себя (повышают электронную плотность в сопряженной системе). К ним относятся группы, которые содержат атомы с неподеленной парой электронов, способные к передаче этой пары электронов в общую систему сопряжения.Заместители, вызывающие положительный мезомерный эффект (электронодоноры): -NH2, -OH.
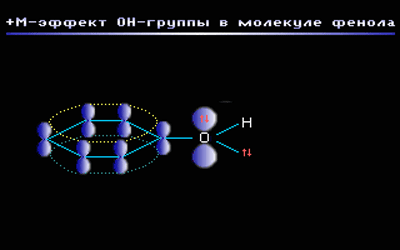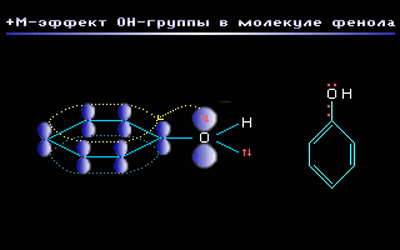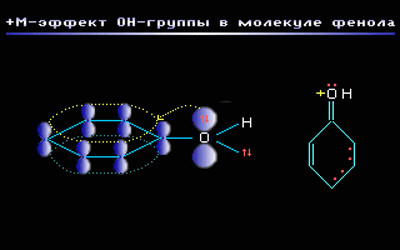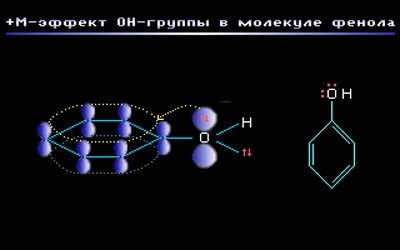
Например, в молекуле фенола С6Н5ОН группа –ОН проявляет +М-эффект за счет участия одной из неподеленных электронных пар атома кислорода в системе сопряжения:
–М-эффект проявляют заместители с электроотрицательными атомами и смещающие электронную плотность на себя (понижают электронную плотность в сопряженной системе).
Заместители, вызывающие отрицательный мезомерный эффект (электроноакцепторы): СН=О, -NO
2, -COOH. Эти группы имеют неподеленные электронные пары, но пространственное расположение орбиталей с этими электронами не позволяет им вступать в систему сопряжения. Поэтому, в этом случае, заместитель оттягивает электроны из общей системы сопряжения за счет своей более высокой электроотрицательности.
Например, π-орбиталь кратной связи С=О и sp2-орбитали с неподеленными парами электронов атома кислорода расположены перпендикулярно друг другу, т.е. их перекрывание невозможно и ни одна электронная пара кислорода не может передаваться в π-систему:
Индуктивный эффект (I) – это смещение электронной плотности вдоль σ–связи от одного атома к другому вследствие их разной электроотрицательности. При этом происходит поляризация связи.
Наличие в молекуле полярной σ–связи вызывает поляризацию ближайших двух-трех σ–связей и ведет к возникновению частичных зарядов δ+ (дельта плюс) или δ– (дельта минус) на соседних атомах.
Направление смещения электронной плотности всех σ-связей обозначается прямыми стрелками (по линии связи) и символами частичных зарядов.
Из-за слабой поляризуемости σ-связей I-эффект быстро затухает с удалением от заместителя и через 3-4 связи становится практически равным нулю.

Атомы и группы атомов, электроотрицательность которых больше электроотрицательности атома углерода, в связах с ним оттягивают на себя электроны связи и обладают отрицательным индуктивным эффектом –I (электроноакцепторы). При этом заместитель приобретает частичный отрицательный заряд (δ-), а атом углерода – частичный положительный заряд (δ+).
Атомы и группы атомов с меньшей электротрицательностью отталкивают от себя электроны в связях с углеродом и обладают положительным индуктивным эффектом +I (электронодоноры). При этом заместитель приобретает частичный положительный заряд (δ+), а атом углерода частичный отрицательный заряд (δ-).
Заместители, вызывающие отрицательный индуктивный эффект:
-NO2, -CN, -COOH, -F, -Cl, -Br, -I, -COOR, -COR, -OR, -OH, -NH2.
Заместители, вызывающие положительный индуктивный эффект:
— CR3, -CHR2, -CH2R, -CH3.