Добавлен: 26.10.2023
Просмотров: 84
Скачиваний: 2
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
экспресс-анализаторы, называемые еще «лаборатории на чипе». Один чип размером порядка 4x4 см может заменить целый комплекс оборудования, необходимого для анализа ДНК/РНК, установления родства, определения генетически модифицированных организмов, ранней диагностики онкологических заболеваний, количественного определения белков и многого другого. При этом кроха-лаборатория умеет анализировать одновременно до 12 разных образцов, а время анализа, занимавшего раньше недели, сокращается до 15-30 минут.
Примером такого устройства может служить миниатюрный и быстродействующий экспресс-анализатор, созданный учеными Калифорнийского университета, США (рис. 4).

Рис. 4. Экспресс-анализатор
Это устройство представляет собой биологическую лабораторию на чипе на основе углеродных нанотрубок. Капля крови поступает в смесительный резервуар, в котором она смешивается с антикоагуляторами, препятствующими ее свертыванию, затем в контейнер, где кровь «разжижается», что позволяет посчитать отдельные клетки.
Устройство разрабатывалось в первую очередь для космонавтов. При длительных полетах дает информацию об образце в среднем за две минуты.
В области терапии наиболее существенным результатом применения нанотехнологий является решение проблем доставки препаратов и регенерации тканей. Наночастицы позволяют врачам:
- доставлять лекарство точно к месту болезни, увеличивая эффективность и сводя к минимуму побочные эффекты;
- обеспечивают возможности для контролируемого вывода терапевтических веществ и их метаболитов (продуктов превращения лекарств в ходе естественных процессов обмена веществ в организме);
- могут использоваться для стимулирования врожденных механизмов иммунитета и регенерации (основное внимание здесь сосредоточено на искусственной активации и управлении взрослыми стволовыми клетками).
Aктивно проводятся работы по созданию нанокапсул и наносфер для целенаправленной доставки лекарственных препаратов в организме человека (онкологическая, противогепатитная и анти-ВИЧ-терапия). Лекарства, содержащиеся внутри наночастиц, размер которых в 70 раз меньше, чем красные кровяные тельца, переносятся с током крови к определенному органу, где происходит пролонгированное (постепенное) выделение препарата.
В настоящее время получены нанокапсулы со средним диаметром от 10 до 5000 нм, включающие матрицу из воска или текстильного волокна и активного вещества.
Указанная структура позволяет обеспечить стабильное выделение лекарства в течение длительного периода и, если в дендримеры будут встроены миниатюрные датчики, - постоянный контроль состояния пациента, позволяющий регулировать поступление лекарства.
Обычная бактерия обладает естественной способностью проникать в живые клетки и может работать в качестве «транспортного средства» по доставке лекарств, что открывает новые возможности в области генной терапии. Наночастицы размером от 40 до 200 нм прикрепляют на поверхность бактерии специальными молекулами-линкерами. На одной бактерии можно разместить до нескольких сотен наночастиц, расширив таким образом количество и «типы» грузов, которые нужно доставить.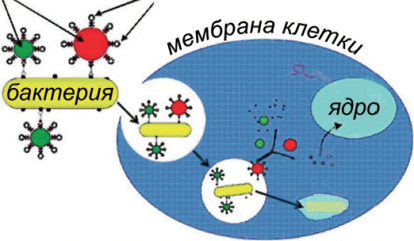
На рис. 5 представлена схема такой капсулы.
Одним из направлений развития нанохимии является криохимия. Криохимические методы открывают новые возможности для получения и производства лекарственных препаратов. Биофармацевтическая и терапевтическая активность лекарств зависит от их полиморфной модификации, молекулярной организации, структурной упорядоченности, размера и формы частиц. В настоящее время нанохимия занимается получением структурно- модифицированных (видоизмененных) лекарственных средств. При исследовании различных органических соединений установлено, что в низкотемпературных конденсатах формируются особые неравновесные состояния, на основе которых предложены новые способы производства лекарственных препаратов. Низкие температуры (криомодификация лекарств) позволяют обойтись без использования растворителей и исключают загрязнение окружающей среды.
Фуллерены, нанотрубки, наносферы и другие наночастицы способны повышать качество имплантантов - биосовместимость, механическую прочность, срок службы (например, для искусственных клапанов сердца).
Наноматериалы оказались перспективными и для зубоврачебной практики. Наночастицы оксидов металлов с амфотерными свойствами (титана, олова, тантала, ниобия и индия), содержащие дополнительно фосфор-, сера- или кремнийфункциональные группы при сополимеризации с акрилатными или метакрилатными мономерами образуют нанокомпозиты, которые полимеризуются уже при комнатной температуре с образованием очень прочных твердых материалов.
Широкое применение в медицинской практике находят наночастицы благородных металлов, в частности серебра и золота (рис. 6). Свойства наночастиц серебра уникальны, для них характерна феноменальная бактерицидная и антивирусная активность.
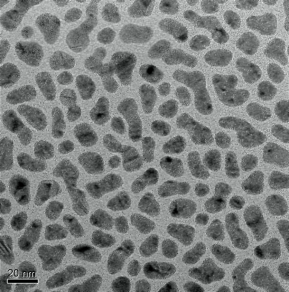
Рис. 6. Наночастицы серебра на подложке
В отличие от антибиотиков, убивающих не только вредоносные вирусы, но и пораженные ими клетки, действие наночастиц очень избирательно: они действуют только на вирусы, клетка при этом не повреждается.
Это объясняется тем, что оболочка микроорганизмов состоит из особых белков, которые при поражении наночастицами серебра перестают снабжать бактерию кислородом, поэтому микроорганизм больше не может окислять глюкозу и гибнет, оставшись без источника энергии. Вирусы вообще не имеют никакой оболочки, поэтому погибают сразу. Клетки же человека и животных имеют более «высокотехнологичные» стенки, и наночастицы им не страшны.
Серебряные наночастицы - не единственные наноматериалы, пригодные для борьбы с бактериями. Недавно был создан нанокатализатор, который производит углеродные нанотрубки одинакового размера и заставляет их собираться в структуру, напоминающую ковер. При добавлении к «ковру» различных биологических агентов он меняет свой цвет от красного до желтого. Самым удивительным оказалось то, что этим «наноковром» можно убивать различные микроорганизмы. В эксперименте на бактериях отдельные нанотрубки «ковра» проткнули их клеточные мембраны, чем вызвали гибель микроорганизмов.
«Наноковер» может быть использован в качестве биологического детектора либо бактерицидной поверхности для применения в терапии, а также в фильтрах для очистки воды и воздуха.
Нанокристаллические оксиды, в частности оксид магния, также были использованы для уничтожения различных бактерий, вирусов, токсинов, при применении хлорированных аддуктов. Механизм взаимодействия и гибели биологически активных частиц при реакции с системой наноразмерный оксид-хлор нуждается в дальнейших исследованиях, которые представляют интерес для борьбы с биологическим оружием и различными биотоксикологическими заболеваниями.
Проблема избавления человечества от патологического страха, вызываемого диагнозом «рак», является одной из важнейших для современной медицины. Для этого необходимо добиться ранней диагностики заболевания и разработать безопасные методы терапии. К сожалению, пока эти проблемы решаются недостаточно быстрыми темпами. Идеальных средств борьбы с раком пока не создано. Лучевая терапия, убивая раковые клетки, повреждает и эпителиальный слой, вызывая целый ряд побочных эффектов, таких как выпадение волос. Химиотерапия наносит сильный удар по почкам, сердцу, печени и может стать причиной частичной потери слуха и язвенной болезни органов пищеварения. Многие проблемы позволят решить нанотехнологии.
В настоящее время методы использования наночастиц в диагностике и лечении опухолей стремительно приближаются к внедрению в клиническую практику. Биомедицинское направление нанохимии предполагает разработку способов воздействия на клетки биологических тканей наноманипуляторами, а также методов создания наносистем непосредственно в биологических тканях.
Лабораторные эксперименты показали, что процедуру ввода в полимерное тело реагентов, при взаимодействии которых формируются наночастицы гетита или гидроксиапатита, можно организовать таким образом, чтобы возникшие в объеме тела наночастицы почти не влияли на структуру полимера. Если после образования наночастиц на тело наложить акустическое поле, то оно нагреется до 43 °С в течение времени, за которое тело без наночастиц почти не изменит температуру. Это позволило предположить, что если найти вещества, наночастицы которых могут формироваться в раковых клетках со значительно большей вероятностью, чем здоровые ткани, то раковые клетки можно будет селективно нагреть и «убить». И такие вещества были найдены. Были получены интересные результаты действия одного из них (терофтала) на развитие раковой опухоли у мышей. Стало очевидным, что сами по себе наночастицы терофтала не влияют на развитие опухоли, а акустическое поле лишь слабо замедляет ее рост. Но если поле наложить после образования наночастиц терофтала, причем всего на 10 минут, объем опухоли в течение недели уменьшится на 80%. Эти факты подчеркивают перспективность изучения эволюции наносистем в биологических средах.
Пресс-конференция «Достижения нанотехнологии в диагностике и лечении рака», проводившаяся в рамках международной конференции «Молекулярные мишени и методы терапии рака» с 14 по18 ноября 2007 года в Пенсильвании, США, была полностью посвящена развитию этого нового направления в медицине. Ниже изложены наиболее перспективные разработки в этой области.
Однослойные углеродные нанотрубки с адсорбированными антителами для обнаружения клеток рака. Антитела, своего рода управляемые снаряды, специфичные к рецептору инсулиноподобного фактора роста I (IGF1R) - особому белку на поверхности большинства злокачественных клеток), - находят эти клетки и связываются с ними. При помещении образующегося комплекса между электродами происходит изменение его электропроводимости, причем оно прямо пропорционально количеству рецепторов на поверхности клеток.
Результаты этих разработок могут лечь в основу метода обнаружения опухолевых клеток в крови, как в случае образования новой опухоли, так и в случае рецидива опухоли или метастазов, оставшихся после проведенного ранее лечения. Важным достоинством этого метода является то, что он позволяет определить злокачественность клеток в течение нескольких минут, в отличие от нескольких часов или даже дней, требующихся для применяемых в настоящее время методов.
Иммунонаносферы для избирательной фототермической терапии рака и обнаружения опухолей. Новый подход к лечению рака, основанный на двух приемах, которые безвредны сами по себе, но при совместном использовании губительны для опухолевых клеток.
Используются наносферы, представляющие собой микроскопические силиконовые шарики, покрытые тончайшим слоем золота, а также свет длинноволновой инфракрасной области спектра (рис. 7).
нанотехнология медицина диагностика
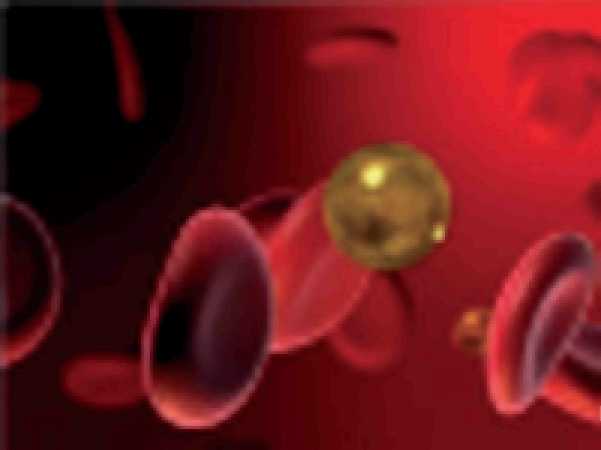
Рис. 7. Силиконовая наносфера, покрытая золотом
Наносферы нетоксичны и выводятся из организма без каких-либо побочных эффектов, а длинноволновое ИК-излучение, испускаемое лазером, практически не взаимодействует с тканями организма.
Опухоль-ориентированные системы доставки. Созданы липосомные (собранные из молекул липидов) наночастицы, которые благодаря антителам, покрывающим их поверхность, способны находить опухоль в любой части организма. В более чем 50% случаев злокачественные клетки имеют мутацию в гене p53, являющемся «охранником» генома, так как он обеспечивает избавление от генетически измененных клеток.
Лечение раковых метастазов. Раковые метастазы традиционно гораздо хуже поддаются лечению, чем первичная опухоль, и, в конечном счете, именно они становятся причиной смерти большинства пациентов. Исследователи Гарвардской Медицинской школы сообщают о разработке перорально принимаемого препарата, получившего название лодамин (Lodamin) и являющегося ингибитором ангиогенеза. Этот комплекс также производится на основе наночастиц, улучшающих нацеливание активного ингредиента на пораженные клетки. Оказалось также, что лодамин нетоксичен, что позволяет использовать его для профилактики развития рака у пациентов, находящихся в зоне особого риска.
Примером такого устройства может служить миниатюрный и быстродействующий экспресс-анализатор, созданный учеными Калифорнийского университета, США (рис. 4).

Рис. 4. Экспресс-анализатор
Это устройство представляет собой биологическую лабораторию на чипе на основе углеродных нанотрубок. Капля крови поступает в смесительный резервуар, в котором она смешивается с антикоагуляторами, препятствующими ее свертыванию, затем в контейнер, где кровь «разжижается», что позволяет посчитать отдельные клетки.
Устройство разрабатывалось в первую очередь для космонавтов. При длительных полетах дает информацию об образце в среднем за две минуты.
-
Терапия
В области терапии наиболее существенным результатом применения нанотехнологий является решение проблем доставки препаратов и регенерации тканей. Наночастицы позволяют врачам:
- доставлять лекарство точно к месту болезни, увеличивая эффективность и сводя к минимуму побочные эффекты;
- обеспечивают возможности для контролируемого вывода терапевтических веществ и их метаболитов (продуктов превращения лекарств в ходе естественных процессов обмена веществ в организме);
- могут использоваться для стимулирования врожденных механизмов иммунитета и регенерации (основное внимание здесь сосредоточено на искусственной активации и управлении взрослыми стволовыми клетками).
Aктивно проводятся работы по созданию нанокапсул и наносфер для целенаправленной доставки лекарственных препаратов в организме человека (онкологическая, противогепатитная и анти-ВИЧ-терапия). Лекарства, содержащиеся внутри наночастиц, размер которых в 70 раз меньше, чем красные кровяные тельца, переносятся с током крови к определенному органу, где происходит пролонгированное (постепенное) выделение препарата.
В настоящее время получены нанокапсулы со средним диаметром от 10 до 5000 нм, включающие матрицу из воска или текстильного волокна и активного вещества.
Указанная структура позволяет обеспечить стабильное выделение лекарства в течение длительного периода и, если в дендримеры будут встроены миниатюрные датчики, - постоянный контроль состояния пациента, позволяющий регулировать поступление лекарства.
Обычная бактерия обладает естественной способностью проникать в живые клетки и может работать в качестве «транспортного средства» по доставке лекарств, что открывает новые возможности в области генной терапии. Наночастицы размером от 40 до 200 нм прикрепляют на поверхность бактерии специальными молекулами-линкерами. На одной бактерии можно разместить до нескольких сотен наночастиц, расширив таким образом количество и «типы» грузов, которые нужно доставить.

На рис. 5 представлена схема такой капсулы.
Одним из направлений развития нанохимии является криохимия. Криохимические методы открывают новые возможности для получения и производства лекарственных препаратов. Биофармацевтическая и терапевтическая активность лекарств зависит от их полиморфной модификации, молекулярной организации, структурной упорядоченности, размера и формы частиц. В настоящее время нанохимия занимается получением структурно- модифицированных (видоизмененных) лекарственных средств. При исследовании различных органических соединений установлено, что в низкотемпературных конденсатах формируются особые неравновесные состояния, на основе которых предложены новые способы производства лекарственных препаратов. Низкие температуры (криомодификация лекарств) позволяют обойтись без использования растворителей и исключают загрязнение окружающей среды.
Фуллерены, нанотрубки, наносферы и другие наночастицы способны повышать качество имплантантов - биосовместимость, механическую прочность, срок службы (например, для искусственных клапанов сердца).
Наноматериалы оказались перспективными и для зубоврачебной практики. Наночастицы оксидов металлов с амфотерными свойствами (титана, олова, тантала, ниобия и индия), содержащие дополнительно фосфор-, сера- или кремнийфункциональные группы при сополимеризации с акрилатными или метакрилатными мономерами образуют нанокомпозиты, которые полимеризуются уже при комнатной температуре с образованием очень прочных твердых материалов.
Широкое применение в медицинской практике находят наночастицы благородных металлов, в частности серебра и золота (рис. 6). Свойства наночастиц серебра уникальны, для них характерна феноменальная бактерицидная и антивирусная активность.

Рис. 6. Наночастицы серебра на подложке
В отличие от антибиотиков, убивающих не только вредоносные вирусы, но и пораженные ими клетки, действие наночастиц очень избирательно: они действуют только на вирусы, клетка при этом не повреждается.
Это объясняется тем, что оболочка микроорганизмов состоит из особых белков, которые при поражении наночастицами серебра перестают снабжать бактерию кислородом, поэтому микроорганизм больше не может окислять глюкозу и гибнет, оставшись без источника энергии. Вирусы вообще не имеют никакой оболочки, поэтому погибают сразу. Клетки же человека и животных имеют более «высокотехнологичные» стенки, и наночастицы им не страшны.
Серебряные наночастицы - не единственные наноматериалы, пригодные для борьбы с бактериями. Недавно был создан нанокатализатор, который производит углеродные нанотрубки одинакового размера и заставляет их собираться в структуру, напоминающую ковер. При добавлении к «ковру» различных биологических агентов он меняет свой цвет от красного до желтого. Самым удивительным оказалось то, что этим «наноковром» можно убивать различные микроорганизмы. В эксперименте на бактериях отдельные нанотрубки «ковра» проткнули их клеточные мембраны, чем вызвали гибель микроорганизмов.
«Наноковер» может быть использован в качестве биологического детектора либо бактерицидной поверхности для применения в терапии, а также в фильтрах для очистки воды и воздуха.
Нанокристаллические оксиды, в частности оксид магния, также были использованы для уничтожения различных бактерий, вирусов, токсинов, при применении хлорированных аддуктов. Механизм взаимодействия и гибели биологически активных частиц при реакции с системой наноразмерный оксид-хлор нуждается в дальнейших исследованиях, которые представляют интерес для борьбы с биологическим оружием и различными биотоксикологическими заболеваниями.
-
Нанобиотехнологии в борьбе с онкологическими заболеваниями
Проблема избавления человечества от патологического страха, вызываемого диагнозом «рак», является одной из важнейших для современной медицины. Для этого необходимо добиться ранней диагностики заболевания и разработать безопасные методы терапии. К сожалению, пока эти проблемы решаются недостаточно быстрыми темпами. Идеальных средств борьбы с раком пока не создано. Лучевая терапия, убивая раковые клетки, повреждает и эпителиальный слой, вызывая целый ряд побочных эффектов, таких как выпадение волос. Химиотерапия наносит сильный удар по почкам, сердцу, печени и может стать причиной частичной потери слуха и язвенной болезни органов пищеварения. Многие проблемы позволят решить нанотехнологии.
В настоящее время методы использования наночастиц в диагностике и лечении опухолей стремительно приближаются к внедрению в клиническую практику. Биомедицинское направление нанохимии предполагает разработку способов воздействия на клетки биологических тканей наноманипуляторами, а также методов создания наносистем непосредственно в биологических тканях.
Лабораторные эксперименты показали, что процедуру ввода в полимерное тело реагентов, при взаимодействии которых формируются наночастицы гетита или гидроксиапатита, можно организовать таким образом, чтобы возникшие в объеме тела наночастицы почти не влияли на структуру полимера. Если после образования наночастиц на тело наложить акустическое поле, то оно нагреется до 43 °С в течение времени, за которое тело без наночастиц почти не изменит температуру. Это позволило предположить, что если найти вещества, наночастицы которых могут формироваться в раковых клетках со значительно большей вероятностью, чем здоровые ткани, то раковые клетки можно будет селективно нагреть и «убить». И такие вещества были найдены. Были получены интересные результаты действия одного из них (терофтала) на развитие раковой опухоли у мышей. Стало очевидным, что сами по себе наночастицы терофтала не влияют на развитие опухоли, а акустическое поле лишь слабо замедляет ее рост. Но если поле наложить после образования наночастиц терофтала, причем всего на 10 минут, объем опухоли в течение недели уменьшится на 80%. Эти факты подчеркивают перспективность изучения эволюции наносистем в биологических средах.
Пресс-конференция «Достижения нанотехнологии в диагностике и лечении рака», проводившаяся в рамках международной конференции «Молекулярные мишени и методы терапии рака» с 14 по18 ноября 2007 года в Пенсильвании, США, была полностью посвящена развитию этого нового направления в медицине. Ниже изложены наиболее перспективные разработки в этой области.
Однослойные углеродные нанотрубки с адсорбированными антителами для обнаружения клеток рака. Антитела, своего рода управляемые снаряды, специфичные к рецептору инсулиноподобного фактора роста I (IGF1R) - особому белку на поверхности большинства злокачественных клеток), - находят эти клетки и связываются с ними. При помещении образующегося комплекса между электродами происходит изменение его электропроводимости, причем оно прямо пропорционально количеству рецепторов на поверхности клеток.
Результаты этих разработок могут лечь в основу метода обнаружения опухолевых клеток в крови, как в случае образования новой опухоли, так и в случае рецидива опухоли или метастазов, оставшихся после проведенного ранее лечения. Важным достоинством этого метода является то, что он позволяет определить злокачественность клеток в течение нескольких минут, в отличие от нескольких часов или даже дней, требующихся для применяемых в настоящее время методов.
Иммунонаносферы для избирательной фототермической терапии рака и обнаружения опухолей. Новый подход к лечению рака, основанный на двух приемах, которые безвредны сами по себе, но при совместном использовании губительны для опухолевых клеток.
Используются наносферы, представляющие собой микроскопические силиконовые шарики, покрытые тончайшим слоем золота, а также свет длинноволновой инфракрасной области спектра (рис. 7).
нанотехнология медицина диагностика

Рис. 7. Силиконовая наносфера, покрытая золотом
Наносферы нетоксичны и выводятся из организма без каких-либо побочных эффектов, а длинноволновое ИК-излучение, испускаемое лазером, практически не взаимодействует с тканями организма.
Опухоль-ориентированные системы доставки. Созданы липосомные (собранные из молекул липидов) наночастицы, которые благодаря антителам, покрывающим их поверхность, способны находить опухоль в любой части организма. В более чем 50% случаев злокачественные клетки имеют мутацию в гене p53, являющемся «охранником» генома, так как он обеспечивает избавление от генетически измененных клеток.
Лечение раковых метастазов. Раковые метастазы традиционно гораздо хуже поддаются лечению, чем первичная опухоль, и, в конечном счете, именно они становятся причиной смерти большинства пациентов. Исследователи Гарвардской Медицинской школы сообщают о разработке перорально принимаемого препарата, получившего название лодамин (Lodamin) и являющегося ингибитором ангиогенеза. Этот комплекс также производится на основе наночастиц, улучшающих нацеливание активного ингредиента на пораженные клетки. Оказалось также, что лодамин нетоксичен, что позволяет использовать его для профилактики развития рака у пациентов, находящихся в зоне особого риска.