Файл: Контрольная работа по дисциплине Химия в ыполнил студент гр. 1Збмсдс2 В. И. Нехорошева Проверила доцент, к х. н. Е. В. Новоселова.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 26.10.2023
Просмотров: 27
Скачиваний: 2
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
 | МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ Федеральное государственное бюджетное образовательное учреждение высшего образования «МОСКОВСКИЙ АВТОМОБИЛЬНО-ДОРОЖНЫЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ (МАДИ)» |
Заочный факультет
КАФЕДРА ХИМИИ
КОНТРОЛЬНАЯ РАБОТА
по дисциплине «Химия»
В

ыполнил студент гр. 1ЗбМСДс2 В.И. Нехорошева
Проверила: доцент, к.х.н. Е.В. Новоселова
Москва 2023
№Варианта 27
Номера задач-10,27,43,60,87,94,123,145,164,181,215,244,250,265,274.
№10
1.По положению атома элемента в периодической системе:
а) составьте электронные формулы и графические схемы заполнения электронами валентных орбиталей атомов элементов в нормальном и возбужденном состояниях;
б) определите, к каким электронным семействам они относятся , какие свойства проявляют.
№ элемента 23,53
23-V ванадий
53- I йод
1.Ванадий
Электронная формула атома ванадия в порядке возрастания энергий орбиталей:
1s2 2s2 2p6 3s2 3p6 4s2 3d3
Электронная формула атома ванадия в порядке следования уровней:
1s2 2s2 2p6 3s2 3p6 3d3 4s2

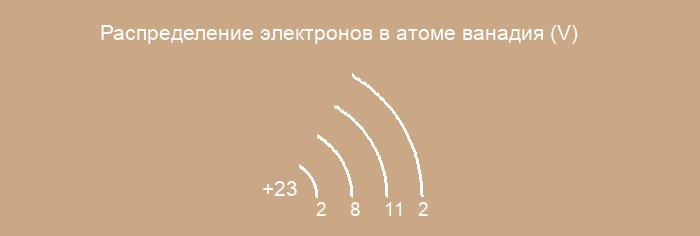
Относится элементам d — семейства. Металл
В возбужденном состоянии: 1s2 2s2
2p6 3s2 3p6 3dxy1 3dyz1 3dzx1 4s1 4px1. Электрон с 4s-орбиты переходит на 4p-орбиту.x орбитальный.
2.Йод
Электронная формула атома йода в порядке возрастания энергий орбиталей:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p5
Электронная формула атома йода в порядке следования уровней:
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p5

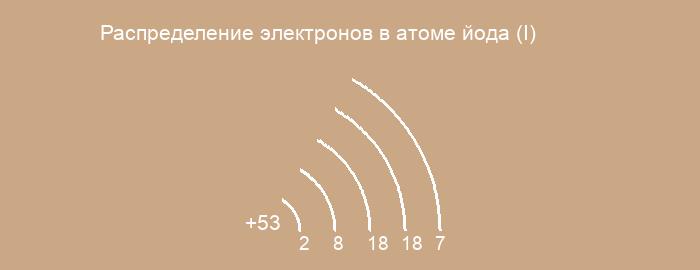
Относится к галогенам
Электронная конфигурация йода в возбужденном состоянии
Первая электронная конфигурация возбужденного состояния [I] представляет собой [Kr] 4d.105-е2, 5p4, и 5д1, который характеризуется переходом одного электрона с 5d на 6s орбиталь, создавая 5d8 и 62 в самой внешней оболочке.
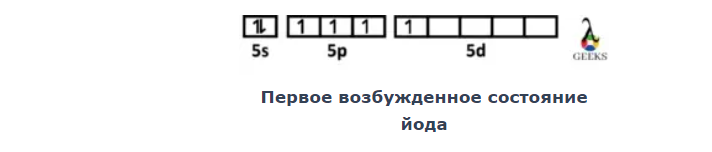
-
Компания Электронная конфигурация второго возбуждающего состояния йода 4d105-е2, 5p3, 5d2, возникающий в результате перескока другой молекулы с 5p на 5d.
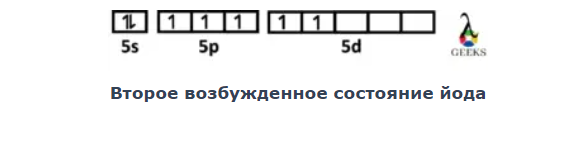
№27.
Приведите орбитальные схемы перекрывания электронных облаков в молекулах следующих соединений
H2O, атом кислорода на валентном уровне имеет конфигурацию: 2s22р4
n=2 ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓
s p d
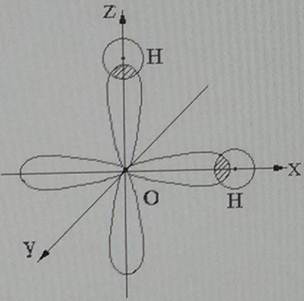
Молекула воды состоит из атома кислорода и двух атомов водорода. Два неспаренных р-электрона атома кислорода занимают две орбитали, которые располагаются под углом 90o друг к другу. При образовании молекулы воды орбиталь каждого р-электрона перекрывается орбиталью s – электрона атома водорода
При образовании молекулы воды происходит гибридизация орбиталей атома кислорода по типу sp3. Каждая из двух связей H-O образуется за счет перекрывания s-орбитали атома водорода с sp3-орбиталью атома кислорода: Угол между связями H–O–H равен 104,5°. Отклонение от тетраэдрического угла (109°28') обусловлено действием неподелённых электронных пар, у атома кислорода связывающими электронными парами заняты только две sp3-гибридные орбитали, а две другие заполнены неподелёнными электронными парами. Так как молекула воды имеет угловое строение и образована элементами с разной степенью электроотрицательности, то она является полярной.
№43.
Не производя расчетов, определите и объясните знак изменения
энтропии в реакциях:
2NH3(г) = N2(г) + 3H2(г),
СН4(г) + 2О2(г) = СО2(г) + 2Н2О(ж).
Знак изменения энтропии будет "+"
- 1) из газа образуются 2 других газа (газы вообще характеризуются максимальным значением энтропии по сравнению с жидкостями и твердыми веществами) и
2) происходит увеличение объема - из 2 объемов NH3 обр-ся 1 объем N2 + 3 объема H2.
Данная реакция протекает без изменения количества моль газообразных веществ, поэтому энтропия реакции будет невелика, так как у углекислого газа и паров воды значение энтропии больше чем у простых веществ (как кислород), то можно предположить, что энтропия реакции будет положительная
№60.
Рассчитайте, какое количество теплоты выделится при сжигании 5 г магния в стандартных условиях, если стандартная энтальпия образования оксида магния ∆Н о298MgO(тв)=−601,8 кДж/моль?
Дано:
m(Mg) = 6 г
∆Н о298
MgO(тв)=−601,8 кДж/моль
Найти:
Q = ?
Решение:
2Mg+O2=2MgO+Q
n(Mg)=m/M=5/24,3=0,20 моль
H=-601,8кДж/моль*5г/(24.3г/моль)= -123,8кДж
Q=-H
Q=123,8кДж
Ответ: выделится 123,8 кДж
№87.
Используем уравнение для кинетики первого порядка:
[A]t = [A]0 * e^(-kt)
Подставляем известные значения:
0,1 = 0,3 * e^(-0,017t)
Решаем уравнение относительно времени t:
t = ln(0,1*0,3) / (-0,017) = 1,76 сек
№94.
Для реакции с заданной константой равновесия Kс и начальными концентрациями газообразныз исходных веществ C 0 рассчитайте равновесные концентрации исходных веществ и продуктов
FeO(тв) + CO(г) ↔ Fe(тв) + CO2(г)
Kс-13,6
C0, моль/л-0,04
Kс=CO2/CO=13,6
Если начальная концентрация CO равна 0,04 моль/л, то равновесную концентрацию обозначаем через х.А равновесная концентрация CO2
Будет (0,04) моль/л
0.04-х/х=13,6
0.04-х=13,6х
0.04=13,6х+х
14,6х=0,04
Х=0,04/14,6=0,00273973 моль/л
[CO2]=0,04-0,00273973=0,03726027
Ответ:[CO]=2,73*10-3 моль/л, [CO2]=3,72*10-2
№123
Рассчитайте молярную массу неэлектролита, зная, что раствор, содержащий 2,5 г этого вещества в 250 г воды, замерзает при температуре –0,3оС. Крископическая константа воды 1,86 кг·К·моль−1.
Дано:
m(в-ва) = 2,25г
m(H2O) = 250г
t0 =0,30С
К-к=1,86 кг*К*моль-1
Найти?
M(в-ва)-?
Решение:
Δt=tзам.(р-ля)−tзам.(р-ра)=0−(−0.3)=0.3°C
Δt=1000⋅Kк⋅m(в-ва)/M(в-ва)⋅m(H2O)
M(в-ва)=1000⋅1.86⋅2.25/0.279⋅250=60 г/моль
Ответ:60г/моль
№145 индетичен с №123
№164.
Определите молярную концентрацию вещества степень
диссоциации a или константа диссоциации Kд первой ступени .
HCN
Концентрация 0,1 моль/л
Кд 4,9*10-10
Константа диссоциации первой ступени (Kд)
для HCN равна 4,9*10-10.
Для определения молярной концентрации вещества степень диссоциации a можно воспользоваться формулой:
Степень электролитической диссоциации α можно вычислить, используя формулу : α = √(КД / С), где С — концентрация электролита, моль / л.
α = √(КД / С)= √4,9*10-10/0,1=7*10-5=0,00007
a = 0,00007
Молярная концентрация диссоциированного HCN будет:
[HCN]дисс = a*[HCN]нач =0,00007 * 0,1 моль/л = 0,000007моль/л
№181.
Рассчитайте рН растворов следующих веществ.
NH4OH
Концентрация раствора, моль/л-0,02
Степень диссоциации, %- 1,3
В расчетах используется не кажущаяся, а относительная степень диссоциации, которая будет равна.
α = 1,3% / 100% = 0,013
См = 0,02 моль/л
Гидроксид аммония NH4OH – слабый электролит, который в водном растворе ограниченно диссоциирует на ионы.
NH4OH ↔ NH4(+) + OH(-)
Молярная концентрацию ионов ОН(–) в растворе слабого электролита
[OH(-)] = α*Cм = 0,013*0,02 = 0,00026 моль/л = 2,6*10-4 моль/л
Гидроксильный показатель ионов ОН(-) в растворе
pOH = – lg 2,6*10-4 = 4 – lg 2,6 = 3,6
Водородный показатель раствора
рН = 14 – рОН = 14 – 3,6 = 10,4
№215.
Составьте электронные уравнения. Расставьтe коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, а какое – восстановителем.
НNO3 + Zn ↔ N2O + Zn(NO3)2 + H2О,
FeSO4 + КClO3 + Н2SO4 ↔ Fe2(SO4)3 + КСl + H2О
10HNO3 + 4Zn ⟶ N2O + 4Zn(NO3)2 + 5H2O
Zn0 - 2e ⟶ Zn+2 │2│ 8│4 восстановитель (окисление)
2N+5 + 8e ⟶ 2N+ │8│ │1 окислитель (восстановление)
6FeSO4 + KClO3 + 3H2SO4 ⟶ 3Fe2(SO4)3 + KCl + 3H2O
Fe+2 - 1e ⟶ Fe+3 │1│6│6 восстановитель (окисление)
Cl+5 + 6e ⟶ Cl- │6│ │1 окислитель (восстановление)
№244.
Какие окислительно-восстановительные процессы протекают на электродах предложенных гальванических элементов? Укажите, какой из них является поляризующимся? Составьте схему работы этого элемента:
Ni/H2SO4 ||CuSO4/Cu;
Поляризующийся элемент -Ni/NiSO4 || H2SO4/Cu.
Схема работы Ni(s) | Ni2+(aq) || H2SO4 || CuSO4(aq) | Cu (s)
В первом гальваническом элементе на аноде происходит окисление никеля (Ni → Ni2+ + 2e-) и выделение электронов, которые переносятся через внешнюю цепь на катод, где ионы меди (Cu2+ + 2e- → Cu) получают электроны и восстанавливаются до медного металла. Таким образом, на аноде происходит окисление, а на катоде – восстановление.
Схема работы гальванического элемента Ni/H2SO4 ||CuSO4/Cu:
Анод:Ni→Ni2++2e-
Катод:Cu2++2e-→Cu
Общее уравнение:Ni+Cu2+→Ni2++Cu
Во втором гальваническом элементе на аноде происходит окисление никеля (Ni → Ni2+ + 2e-) и выделение электронов, которые переносятся через внешнюю цепь на катод, где водородные ионы (2H+ + 2e- → H2) получают электроны и образуют молекулы водорода. Таким образом, на аноде происходит окисление, а на катоде – восстановление.
Схема работы гальванического элемента Ni/NiSO4 || H2SO4/Cu:
Анод: Ni→Ni2++2e-
Катод: 2H+ +2e-→H2
Общее уравнение: Ni + 2H+ → Ni2+ + H2
№250.
Вычислите коэффициенты выхода по току веществ, если при электролизе водного раствора Na J током 5 А в течение 2 ч на катоде и аноде выделилось соответственно 0,30 и 46 г веществ.