Файл: 1 Вопрос. Основные химические понятия атом, молекула, химический элемент, относительные атомные и молекулярные массы.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 30.10.2023
Просмотров: 283
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
количество прежних ионов (сверхэквивалентная адсорбция). Например, вместо одного – двух ионов К+ может оказаться ион Th4+. Поэтому, при достаточно высокой концентрации таких ионов создаваемый ими заряд на поверхности может стать больше по абсолютному значению, чем заряд потенциалопределяющих ионов. Это и означает изменение знака заряда и потенциала. Теперь такие ионы становятся потенциалопределяющими (вместо прежних) и вокруг частицы ориентируются иные противоионы.
4. Коагулирующая способность иона при одинаковом заряде тем больше, чем больше его кристаллический радиус.
Для однозарядных неорганических катионов коагулирующая способность убывает в следующем порядке:
Ag+ > Cs+ > Rb+ > NH4+ > K+ > Na+ > Li+
Этот ряд называется лиотропным.
Правило Шульце-Гарди
40 Современная физическая теория коагуляции (ДЛФО)
Современная теория устойчивости, развитая российскими учеными Б. В. Дерягиным и Л. Д. Ландау, получила всеобщее признание. Несколько позднее теоретическая разработка, которая привела практически к тем же результатам, была осуществлена голландскими учеными Фервеем и Овербеком. Поэтому современная теория устойчивости носит имя указанных ученых и известна в литературе как теория ДЛФО (DLVO).
Когда коллоидные частицы подходят очень близко друг к другу, их диффузные слои перекрываются и взаимодействуют. Это взаимодействие совершается в тонкой прослойке дисперсионной среды, разделяющей частицы. Очевидно, что свойства тонкого жидкого слоя определяют, произойдет ли коагуляция, т. е. определяют устойчивость коллоидов.
Исследования показали, что утончение тонкого слоя при сближении частиц происходит путем вытекания из него жидкости. Когда жидкий слой становится достаточно тонким (толщина его меньше 100–200 нм), свойства жидкости в нем начинают сильно отличаться от свойств жидкости в окружающем объеме. В слое появляется дополнительное давление, которое один из авторов теории ДЛФО Б. В. Дерягин назвал «расклинивающим давлением».
Возникновение расклинивающего давления в тонких жидких слоях обусловлено, главным образом, двумя факторами:
1) электростатическое взаимодействие в слое – это силы отталкивания с энергией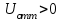 ;
;
2) Ван-дер-Ваальсовы силы притяжения с энергией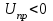 .
.
Результирующая энергия межчастичного взаимодействия U определяется как сумма двух составляющих:
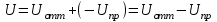 .
.
Если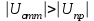 , то преобладают силы отталкивания, коагуляция не происходит, золь является агрегативно устойчивым. В противоположном случае преобладают силы притяжения между частицами, происходит коагуляция.
, то преобладают силы отталкивания, коагуляция не происходит, золь является агрегативно устойчивым. В противоположном случае преобладают силы притяжения между частицами, происходит коагуляция.
7.4.1. Электростатические силы отталкивания
Электростатическое отталкивание между мицеллами возникает при перекрывании диффузных слоев противоионов. Расчеты показывают, что энергия отталкивания уменьшается:
Энергия отталкивания Uотт убывает с увеличением расстояния между частицами h по экспоненциальному закону.
7.4.2. Ван-дер-Ваальсовы силы притяжения
Энергия притяжения связана, главным образом, с дисперсионным взаимодействием между молекулами. Uпр изменяется с увеличением расстояния между частицами h обратно пропорционально квадрату расстояния. Таким образом, притяжение сравнительно медленно уменьшается с увеличением расстояния.
Зависимость суммарной потенциальной энергии межчастичного взаимодействия от расстояния между частицами имеет сложный характер. Общий вид этой зависимости U = f(h) представлен на рис. 7.1.
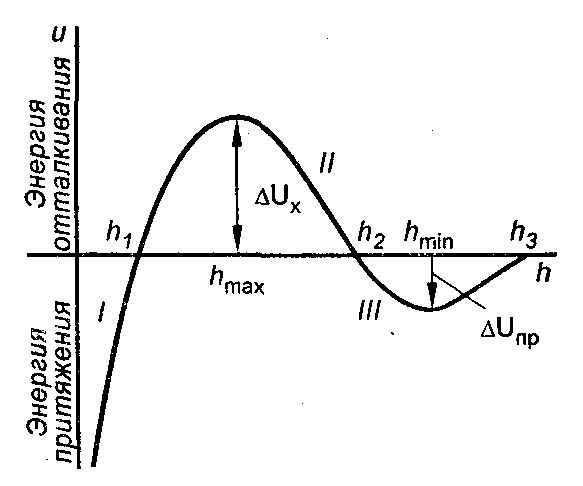
Рис.7.1. Потенциальная кривая взаимодействия двух коллоидных частиц.
На графике есть три участка:
1)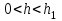 .
. 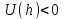 , между частицами преобладают силы притяжения, наблюдается ближний минимум.
, между частицами преобладают силы притяжения, наблюдается ближний минимум. 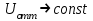 ;
; 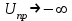 . Происходит коагуляция;
. Происходит коагуляция;
2)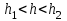 .
. 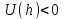 – между частицами преобладают силы отталкивания.
– между частицами преобладают силы отталкивания.  ;
;
3)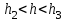 .
. 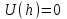 – обнаруживается дальний минимум, однако глубина его невелика.
– обнаруживается дальний минимум, однако глубина его невелика.
При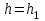 ,
, 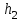 и
и 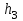
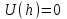 , т. е. при этих расстояниях между частицами силы притяжения уравновешиваются силами отталкивания.
, т. е. при этих расстояниях между частицами силы притяжения уравновешиваются силами отталкивания.
Таким образом, если частицы сблизятся на расстояние меньше h1, они неизбежно слипнутся, но для этого должен быть преодолен потенциальный барьер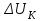 . Это возможно при достаточной кинетической энергии частиц.
. Это возможно при достаточной кинетической энергии частиц.
Так как золь обычно рассматривают при постоянной температуре, кинетическая энергия частиц остается постоянной. Следовательно, для коагуляции должен быть уменьшен потенциальный барьер коагуляции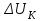 .
.
41 Основные факторы устойчивости коллоидных систем
Следует отметить четыре фактора устойчивости, среди которых два первых играют главную роль.
В реальных системах действуют, как правило, несколько факторов устойчивости. Каждому фактору соответствует специфический способ его нейтрализации.
42 Суспензии. Эмульсии. Пены. Аэрозоли
МИКРОГЕТЕРОГЕННЫЕ СИСТЕМЫ
Микрогетерогенные системы имеют особенности:
В зависимости от природы стабилизатора, реализуются несколько факторов устойчивости: электростатический, адсорбционно-сольватный, структурно-механический, энтропийный, гидродинамический.
Наряду с общими свойствами каждая из дисперсных систем имеет свои особенности.
8.2.1. Суспензии
Суспензии – это микрогетерогенные системы с твердой дисперсной фазой и жидкой дисперсионной средой (Т/Ж).
В зависимости от частичной концентрации дисперсной фазы, суспензии делятся на разбавленные и концентрированные, называемые пастами.
Разбавленные суспензии являются свободнодисперсными системами и имеют много общего с лиофобными золями. Подобно лиофобным золям их получают диспергационными и конденсационными методами. Как правило, на поверхности частиц суспензий возникает ДЭС, который обеспечивает их агрегативную устойчивость. При добавлении электролитов суспензии, подобно лиозолям, коагулируют, образуя крупные агрегаты. При наложении внешнего электрического поля происходят, правда в меньшей степени, чем у золей, электрокинетические явления.
Вместе с тем частицы дисперсной фазы в суспензиях имеют значительно большие размеры (более 10-5 см), чем частицы золей. Этим обусловлены их существенные различия:
Концентрированные суспензии – пасты представляют собой связнодисперсные системы, в которых частицы дисперсной фазы взаимодействуют, образуя пространственные структуры. Для этих систем определяющими являются структурно-механические свойства, которые характеризуются такими параметрами, как вязкость, упругость, пластичность и др.
8.2.2. Эмульсии
Эмульсией называется микрогетерогенная система, состоящая из взаимнонерастворимых жидкостей, распределенных одна в другой в виде капелек.
В зависимости от природы дисперсной фазы и дисперсионной среды, эмульсии подразделяются на прямые (М/В) и обратные (В/М). В первом случае непрерывной средой является вода, а во втором случае – масло.
Большинство эмульсий относятся к лиофобным системам и являются термодинамически неустойчивыми. Для их стабилизации используются специальные вещества – эмульгаторы. В качестве эмульгаторов применяют неорганические электролиты, коллоидные ПАВ, ВМС, высокодисперсные порошки.
Устойчивость эмульсий зависит от межфазового поверхностного натяжения. В тех случаях, когда поверхностное натяжение мало, эмульсия образуется самопроизвольно (без эмульгатора) и является термодинамически устойчивой.
От природы эмульгатора зависит не только устойчивость, но и тип образующейся эмульсии. При изменении природы эмульгатора может происходить обращение фаз эмульсии (переход М/В → В/М или обратно).
В зависимости от концентрации дисперсной фазы, эмульсии делятся на разбавленные, концентрированные и высококонцентрированные.
Разбавленные эмульсии по своим свойствам близки к лиофобным золям:
Концентрированные эмульсии седиментационно неустойчивы – вследствие высокой концентрации капли находятся в контакте и легко наступает коалесценция. Устойчивость таких эмульсий зависит только от эмульгатора.
Высококонцентрированные эмульсии – по своим свойствам сходны со структурированными коллоидными системами – гелями.
8.2.3. Пены
Пены – это грубодисперсные высококонцентрированные системы, в которых дисперсной фазой являются пузырьки газа, а дисперсионной средой – жидкость в виде тонких пленок.
Пены являются типичными лиофобными системами. Термодинамически они не устойчивы. В результате диффузионного переноса газа из мелких пузырьков в более крупные и из поверхностных пузырьков во внешнюю среду возникает агрегативная неустойчивость пен. Стекание дисперсионной среды под действием силы тяжести приводит к седиментационной неустойчивости. В результате пенные пленки утончаются и постепенно разрушаются. Устойчивыми пены получаются только в присутствии специальных веществ – пенообразователей. В качестве пенообразователей обычно используются коллоидные ПАВ и ВМС. Адсорбционные слои, образуемые этими веществами, стабилизируют пенные пленки, замедляя вытекание из них жидкости. Основные свойства пены:структурно-механические (предельное напряжение сдвига и вязкость);оптические (рассеяние и поглощение света);электрическая проводимость.
8.2.4. Аэрозоли
Аэрозоли – это микрогетерогенные системы, в которых частицы твердого вещества или капельки жидкости взвешены в газе (Т/Г или Ж/Г).
По агрегатному состоянию дисперсной фазы аэрозоли подразделяют на:
Благодаря очень маленьким размерам частиц дисперсной фазы они имеют развитую поверхность, на которой могут активно протекать адсорбция, горение, другие химические реакции.
Молекулярно-кинетические свойства аэрозолей обусловлены малой концентрацией частиц дисперсной фазы, малой вязкостью и малой плотностью дисперсионной среды.
В зависимости от размеров частиц дисперсной фазы, они могут либо быстро седиментировать (при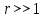 мкм), либо прилипать к стенкам сосуда или слипаться (при
мкм), либо прилипать к стенкам сосуда или слипаться (при 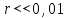 мкм). Наибольшей устойчивостью обладают частицы промежуточных размеров.
мкм). Наибольшей устойчивостью обладают частицы промежуточных размеров.
Оптические свойства аэрозолей сходны со свойствами лиозолей, однако рассеяние света ими выражено значительно сильнее из-за больших различий показателей преломления дисперсной фазы и дисперсионной среды.
Специфичность электрических свойств аэрозолей состоит в том, что на частицах не возникает ДЭС, заряд частиц носит случайный характер и мал по величине. При сближении частиц не возникает электростатическое отталкивание, и происходит быстрая коагуляция.
Разрушение аэрозолей является важной проблемой и осуществляется путем седиментации, коагуляции, пылеулавливания и другими методами.
Изучив тему «Лиофильные системы. Микрогетерогенные системы», вы должны знать:
4. Коагулирующая способность иона при одинаковом заряде тем больше, чем больше его кристаллический радиус.
Для однозарядных неорганических катионов коагулирующая способность убывает в следующем порядке:
Ag+ > Cs+ > Rb+ > NH4+ > K+ > Na+ > Li+
Этот ряд называется лиотропным.
Правило Шульце-Гарди
| Значения порогов коагуляции, вызываемой электролитами с зарядами противоионов 1, 2, 3 относятся как:1:(1/2)6:(1/3)6. Пороги коагуляции уменьшаются в ряду противоионов: катионов:Li+ > Na+ > K+ > Rb+ > Cs+, анионов:Cl- > Br- > NO3- > I-.Эти ряды называются лиотропными. Чем более ионы лиофобны, тем большим коагулирующим действием они обладают. Коагулирующее действие смеси электролитов часто бывает неаддитивным. Если для начала коагуляции требуется смеси электролитов в большем количестве, чем одного из них - антоганистическое действие. Если смесь электролитов действует эффективней, чем один электролит - синергетическое действие. Рассмотренные закономерности относятся к порогу быстрой коагуляции, для которой потенциальный барьер равен нулю или фактор устойчивости равен единице. Термодинамическая теория устойчивости и кинетическая теория ДЛФО хорошо согласуются, дополняют друг друга и подтверждаются опытом. |
40 Современная физическая теория коагуляции (ДЛФО)
Современная теория устойчивости, развитая российскими учеными Б. В. Дерягиным и Л. Д. Ландау, получила всеобщее признание. Несколько позднее теоретическая разработка, которая привела практически к тем же результатам, была осуществлена голландскими учеными Фервеем и Овербеком. Поэтому современная теория устойчивости носит имя указанных ученых и известна в литературе как теория ДЛФО (DLVO).
Когда коллоидные частицы подходят очень близко друг к другу, их диффузные слои перекрываются и взаимодействуют. Это взаимодействие совершается в тонкой прослойке дисперсионной среды, разделяющей частицы. Очевидно, что свойства тонкого жидкого слоя определяют, произойдет ли коагуляция, т. е. определяют устойчивость коллоидов.
Исследования показали, что утончение тонкого слоя при сближении частиц происходит путем вытекания из него жидкости. Когда жидкий слой становится достаточно тонким (толщина его меньше 100–200 нм), свойства жидкости в нем начинают сильно отличаться от свойств жидкости в окружающем объеме. В слое появляется дополнительное давление, которое один из авторов теории ДЛФО Б. В. Дерягин назвал «расклинивающим давлением».
Возникновение расклинивающего давления в тонких жидких слоях обусловлено, главным образом, двумя факторами:
1) электростатическое взаимодействие в слое – это силы отталкивания с энергией
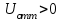 ;
;2) Ван-дер-Ваальсовы силы притяжения с энергией
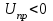 .
.Результирующая энергия межчастичного взаимодействия U определяется как сумма двух составляющих:
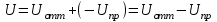 .
.Если
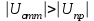 , то преобладают силы отталкивания, коагуляция не происходит, золь является агрегативно устойчивым. В противоположном случае преобладают силы притяжения между частицами, происходит коагуляция.
, то преобладают силы отталкивания, коагуляция не происходит, золь является агрегативно устойчивым. В противоположном случае преобладают силы притяжения между частицами, происходит коагуляция.7.4.1. Электростатические силы отталкивания
Электростатическое отталкивание между мицеллами возникает при перекрывании диффузных слоев противоионов. Расчеты показывают, что энергия отталкивания уменьшается:
-
при увеличении зарядов противоионов и их концентрации; -
при уменьшении по абсолютной величине φ0 и дзета-потенциала.
Энергия отталкивания Uотт убывает с увеличением расстояния между частицами h по экспоненциальному закону.
7.4.2. Ван-дер-Ваальсовы силы притяжения
Энергия притяжения связана, главным образом, с дисперсионным взаимодействием между молекулами. Uпр изменяется с увеличением расстояния между частицами h обратно пропорционально квадрату расстояния. Таким образом, притяжение сравнительно медленно уменьшается с увеличением расстояния.
Зависимость суммарной потенциальной энергии межчастичного взаимодействия от расстояния между частицами имеет сложный характер. Общий вид этой зависимости U = f(h) представлен на рис. 7.1.

Рис.7.1. Потенциальная кривая взаимодействия двух коллоидных частиц.
На графике есть три участка:
1)
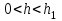 .
. 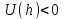 , между частицами преобладают силы притяжения, наблюдается ближний минимум.
, между частицами преобладают силы притяжения, наблюдается ближний минимум. 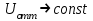 ;
; 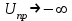 . Происходит коагуляция;
. Происходит коагуляция;2)
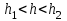 .
. 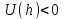 – между частицами преобладают силы отталкивания.
– между частицами преобладают силы отталкивания.  ;
;3)
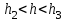 .
. 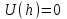 – обнаруживается дальний минимум, однако глубина его невелика.
– обнаруживается дальний минимум, однако глубина его невелика.При
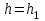 ,
, 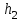 и
и 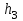
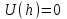 , т. е. при этих расстояниях между частицами силы притяжения уравновешиваются силами отталкивания.
, т. е. при этих расстояниях между частицами силы притяжения уравновешиваются силами отталкивания.Таким образом, если частицы сблизятся на расстояние меньше h1, они неизбежно слипнутся, но для этого должен быть преодолен потенциальный барьер
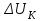 . Это возможно при достаточной кинетической энергии частиц.
. Это возможно при достаточной кинетической энергии частиц.Так как золь обычно рассматривают при постоянной температуре, кинетическая энергия частиц остается постоянной. Следовательно, для коагуляции должен быть уменьшен потенциальный барьер коагуляции
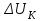 .
.41 Основные факторы устойчивости коллоидных систем
Следует отметить четыре фактора устойчивости, среди которых два первых играют главную роль.
-
Электростатический фактор устойчивости. Он обусловлен наличием ДЭС и дзета-потенциала на поверхности частиц дисперсной фазы. -
Адсорбционно-сольватный фактор устойчивости. Он обусловлен снижением поверхностного натяжения в результате взаимодействия дисперсионной среды с частицей дисперсной фазы. Этот фактор играет заметную роль, когда в качестве стабилизаторов используются коллоидные ПАВ. -
Структурно-механический фактор устойчивости. Он обусловлен тем, что на поверхности частиц дисперсной фазы образуются пленки, обладающие упругостью и механической прочностью, разрушение которых требует времени и затраты энергии. Этот фактор устойчивости реализуется в тех случаях, когда в качестве стабилизаторов используются высокомолекулярные соединения (ВМС). -
Энтропийный фактор устойчивости. Коагуляция приводит к уменьшению числа частиц в системе, следовательно, к уменьшению энтропии (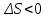 ), а это приводит к увеличению свободной энергии системы
), а это приводит к увеличению свободной энергии системы 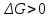 . Поэтому система самопроизвольно стремится оттолкнуть частицы друг от друга и равномерно (хаотично) распределить по объему системы.
. Поэтому система самопроизвольно стремится оттолкнуть частицы друг от друга и равномерно (хаотично) распределить по объему системы.
В реальных системах действуют, как правило, несколько факторов устойчивости. Каждому фактору соответствует специфический способ его нейтрализации.
42 Суспензии. Эмульсии. Пены. Аэрозоли
МИКРОГЕТЕРОГЕННЫЕ СИСТЕМЫ
Микрогетерогенные системы имеют особенности:
-
частицы дисперсной фазы имеют размеры от 1 мкм и выше, т. е. указанные системы занимают промежуточное положение между коллоидными растворами и макросистемами; -
все указанные системы характеризуются наличием большой межфазной поверхности, что обусловливает их термодинамическую неустойчивость – стремление к укрупнению частиц дисперсной фазы; -
агрегативная устойчивость обеспечивается введением стабилизаторов: низкомолекулярных электролитов, ПАВ, полимеров.
В зависимости от природы стабилизатора, реализуются несколько факторов устойчивости: электростатический, адсорбционно-сольватный, структурно-механический, энтропийный, гидродинамический.
Наряду с общими свойствами каждая из дисперсных систем имеет свои особенности.
8.2.1. Суспензии
Суспензии – это микрогетерогенные системы с твердой дисперсной фазой и жидкой дисперсионной средой (Т/Ж).
В зависимости от частичной концентрации дисперсной фазы, суспензии делятся на разбавленные и концентрированные, называемые пастами.
Разбавленные суспензии являются свободнодисперсными системами и имеют много общего с лиофобными золями. Подобно лиофобным золям их получают диспергационными и конденсационными методами. Как правило, на поверхности частиц суспензий возникает ДЭС, который обеспечивает их агрегативную устойчивость. При добавлении электролитов суспензии, подобно лиозолям, коагулируют, образуя крупные агрегаты. При наложении внешнего электрического поля происходят, правда в меньшей степени, чем у золей, электрокинетические явления.
Вместе с тем частицы дисперсной фазы в суспензиях имеют значительно большие размеры (более 10-5 см), чем частицы золей. Этим обусловлены их существенные различия:
-
суспензии кинетически неустойчивы и быстро седиментируют; -
молекулярно-кинетические свойства – броуновское движение, диффузия, осмос проявляются слабо или не проявляются совсем; -
суспензии практически не рассеивают свет, преимущественно отражая или поглощая его, частицы дисперсной фазы видны в обычный микроскоп; -
вследствие малой удельной поверхности частиц дисперсной фазы суспензий слабо выражены поверхностные явления.
Концентрированные суспензии – пасты представляют собой связнодисперсные системы, в которых частицы дисперсной фазы взаимодействуют, образуя пространственные структуры. Для этих систем определяющими являются структурно-механические свойства, которые характеризуются такими параметрами, как вязкость, упругость, пластичность и др.
8.2.2. Эмульсии
Эмульсией называется микрогетерогенная система, состоящая из взаимнонерастворимых жидкостей, распределенных одна в другой в виде капелек.
В зависимости от природы дисперсной фазы и дисперсионной среды, эмульсии подразделяются на прямые (М/В) и обратные (В/М). В первом случае непрерывной средой является вода, а во втором случае – масло.
Большинство эмульсий относятся к лиофобным системам и являются термодинамически неустойчивыми. Для их стабилизации используются специальные вещества – эмульгаторы. В качестве эмульгаторов применяют неорганические электролиты, коллоидные ПАВ, ВМС, высокодисперсные порошки.
Устойчивость эмульсий зависит от межфазового поверхностного натяжения. В тех случаях, когда поверхностное натяжение мало, эмульсия образуется самопроизвольно (без эмульгатора) и является термодинамически устойчивой.
От природы эмульгатора зависит не только устойчивость, но и тип образующейся эмульсии. При изменении природы эмульгатора может происходить обращение фаз эмульсии (переход М/В → В/М или обратно).
В зависимости от концентрации дисперсной фазы, эмульсии делятся на разбавленные, концентрированные и высококонцентрированные.
Разбавленные эмульсии по своим свойствам близки к лиофобным золям:
-
вследствие малых размеров частиц они седиментационно устойчивы; -
проявляются молекулярно-кинетические свойства – броуновское движение, диффузия; -
рассеивают падающий свет; -
коагулируют (коалесцируют) под действием электролитов в соответствии с правилом Шульце-Гарди.
Концентрированные эмульсии седиментационно неустойчивы – вследствие высокой концентрации капли находятся в контакте и легко наступает коалесценция. Устойчивость таких эмульсий зависит только от эмульгатора.
Высококонцентрированные эмульсии – по своим свойствам сходны со структурированными коллоидными системами – гелями.
8.2.3. Пены
Пены – это грубодисперсные высококонцентрированные системы, в которых дисперсной фазой являются пузырьки газа, а дисперсионной средой – жидкость в виде тонких пленок.
Пены являются типичными лиофобными системами. Термодинамически они не устойчивы. В результате диффузионного переноса газа из мелких пузырьков в более крупные и из поверхностных пузырьков во внешнюю среду возникает агрегативная неустойчивость пен. Стекание дисперсионной среды под действием силы тяжести приводит к седиментационной неустойчивости. В результате пенные пленки утончаются и постепенно разрушаются. Устойчивыми пены получаются только в присутствии специальных веществ – пенообразователей. В качестве пенообразователей обычно используются коллоидные ПАВ и ВМС. Адсорбционные слои, образуемые этими веществами, стабилизируют пенные пленки, замедляя вытекание из них жидкости. Основные свойства пены:структурно-механические (предельное напряжение сдвига и вязкость);оптические (рассеяние и поглощение света);электрическая проводимость.
8.2.4. Аэрозоли
Аэрозоли – это микрогетерогенные системы, в которых частицы твердого вещества или капельки жидкости взвешены в газе (Т/Г или Ж/Г).
По агрегатному состоянию дисперсной фазы аэрозоли подразделяют на:
-
туман (Ж/Г); -
дым, пыль (Т/Г); -
смог [(Ж+Т)/Г)].
Благодаря очень маленьким размерам частиц дисперсной фазы они имеют развитую поверхность, на которой могут активно протекать адсорбция, горение, другие химические реакции.
Молекулярно-кинетические свойства аэрозолей обусловлены малой концентрацией частиц дисперсной фазы, малой вязкостью и малой плотностью дисперсионной среды.
В зависимости от размеров частиц дисперсной фазы, они могут либо быстро седиментировать (при
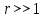 мкм), либо прилипать к стенкам сосуда или слипаться (при
мкм), либо прилипать к стенкам сосуда или слипаться (при 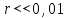 мкм). Наибольшей устойчивостью обладают частицы промежуточных размеров.
мкм). Наибольшей устойчивостью обладают частицы промежуточных размеров.Оптические свойства аэрозолей сходны со свойствами лиозолей, однако рассеяние света ими выражено значительно сильнее из-за больших различий показателей преломления дисперсной фазы и дисперсионной среды.
Специфичность электрических свойств аэрозолей состоит в том, что на частицах не возникает ДЭС, заряд частиц носит случайный характер и мал по величине. При сближении частиц не возникает электростатическое отталкивание, и происходит быстрая коагуляция.
Разрушение аэрозолей является важной проблемой и осуществляется путем седиментации, коагуляции, пылеулавливания и другими методами.
Изучив тему «Лиофильные системы. Микрогетерогенные системы», вы должны знать:
-
особенности растворов ПАВ; -
особенности растворов ВМС, их сходства и различия с коллоидными растворами; -
характерные особенности и общие свойства эмульсий, пен, аэрозолей, суспензий; -
факторы устойчивости рассмотренных систем.