Файл: 1. Первичная структура пептидов и белков. Состав и аминокислотная последовательность.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 07.11.2023
Просмотров: 226
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
1. Первичная структура пептидов и белков. Состав и аминокислотная последовательность.
Пептиды и белки представляют собой соединения, построенные из остатков α-аминокислот.
Пептидную или белковую молекулу формально можно представить как продукт поликонденсации α-аминокислот, протекающей с образованием пептидной связи между мономерными звеньями.
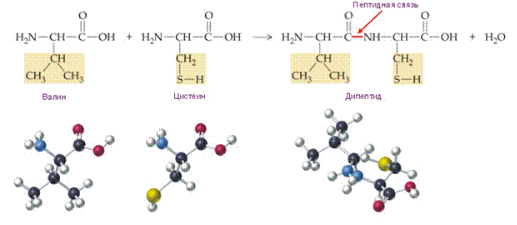
Рисунок 1. Образование дипептида ВАЛ-ЦИС.
В группе пептидов принято различать олигопептиды (низкомолекулярные пептиды), содержащие в цепи не более 10 аминокислотных остатков, и полипептиды, в состав цепи которых входит до 100 аминокислотных остатков.
Белковая молекула образуется по реакции поликонденсации α-аминокислот.
Конструкция пептидной цепи одинакова для всего многообразия пептидов и белков. Эта цепь имеет неразветвленное строение. Вначале цепи всегда находится свободная NH2-группа, а в конце – свободная -COOH группа.
При единообразии построенной полипептидной цепи специфичность пептидов и белков определяется двумя важнейшими характеристиками – аминокислотным составом и аминокислотной последовательностью.
Аминокислотный состав пептидов и белков – это природа и количественное соотношение входящих в них α-аминокислот.
Первичная структура пептидов и белков – это аминокислотная последовательность, т. е. порядок чередования α-аминокислотных остатков.
2. Ферментативный гидролиз белков. Химические способы отщепления α-аминокислот с N-конца. Метод динитрофенилирования, метод Эдмана, дансильный метод.
Первичная структура определяется путем последовательного отщепления α-аминокислот с какого-либо конца цепи и их идентификация.
Довольно хорошо разработаны химические способы отщепления α-аминокислот с N-конца.
Метод динитрофенилирования – это первый способ отщепления и идентификации N-концевой α-аминокислоты, предложенный ученым Ф. Сенгером.
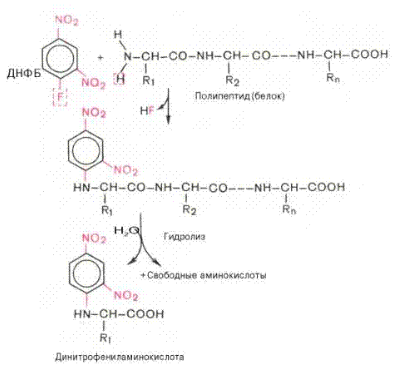
Метод основан на использовании реакции взаимодействия 2,4-динитрофторбензола с полипептидом. Высокая нуклеофильность атома азота α-аминокислот позволяет его проалкилировать 2,4-динитрофторобензолом (ДНФБ) и образовать «меченый полипептид», при этом 2,4-дифенильное (ДНФ)-производное полипептида окрашено в
желтый цвет. При кислотном гидролизе все пептидные связи в таком ДНФ-производном полипептида расщепляются, однако ковалентная связь между 2,4-динитрофенильной группой и α-аминогруппой N-концевого остатка остается незатронутой. Следовательно, N-концевой остаток будет представлен в гидролизате в виде 2,4-динитрофенильного производного. Это ДНФ-производное N-концевой α-аминокислоты легко отделить от незамещенных свободных аминокислот и идентифицировать хроматографическим способом путем сравнения его с аутентичными динитрофенильными производными различных аминокислот.
Метод Эдмана заключается во взаимодействии N-концевой α-аминокислоты с фенилизотиоцианатом в щелочной среде. При дальнейшей обработке слабой кислотой без нагревания происходит отщепление от цепи «меченой» концевой ФТГ-аминокислоты.
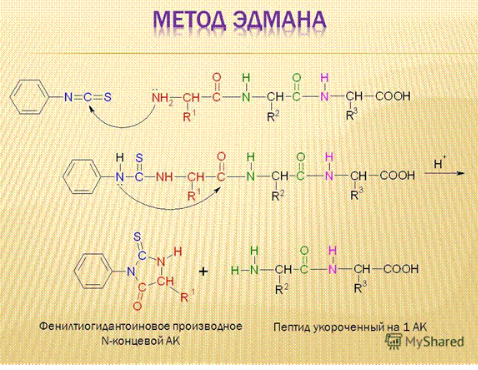
Рисунок 3. Реакция получения ФТГ-производного N-концевой α-аминокислоты.
ФТГ-аминокислота идентифицируется методами тонкослойной или газожиткостной хроматографии.
Преимущества метода Эдмана состоит в том, что при отщеплении каждой концевой α-аминокислоты остальная часть пептидной молекулы не разрушается и операции по отщеплению можно повторить.
Метод Эдмана оказался пригодным для воспроизведения в автоматическом приборе – секвенаторе ( от англ. sequence – последовательность), с помощью которого можно осуществить 40-50 стадий отщепления. Полученное на каждой стадии ФТГ-производное идентифицируют хроматографическим путем.
Дансильный метод разработали ученые Грей и Хартли в 1963 г. Метод основан на получении производных N-концевой α-аминокислоты при обработке дансилхлоридом (5-диметиламинонафталин-1-сульфонилхлорид) и последующим отщеплением при гидролизе разбавленной хлороводородной кислотой (105°С, 12-16 часов). Дансилпроизводное α-аминокислот (ДНС-аминокислоты) обладают интенсивной флуоресценцией, позволяющей обнаружить их содержание даже в ничтожно малых количествах.
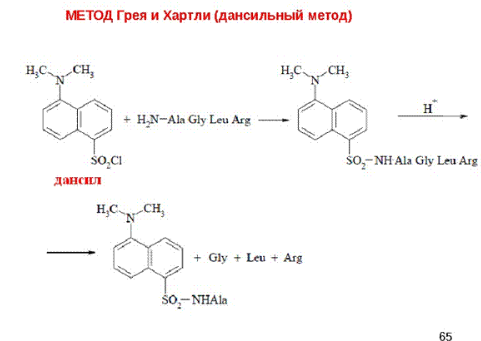
Рисунок 4. Реакция получения дансильного производного N-концевой α-аминокислоты.
Дансильный метод – один из самых высокочувствительных, так как для идентификации ДНС-аминокислот используется высокоэффективная жидкостная хроматография с флуоресцентным детектированием.
По мере совершенствования экспериментальных методов и внедрения автоматических приборов быстро возрастает число пептидов и белков с установленной первичной структурой.
3. Строение и синтез пептидов. Дипептиды, трипептиды, пептидные антибиотики, пептидные гормоны, пептидные токсины и нейропептиды.
Пептиды по сравнению с белками являются более удобными объектами для физико-химических исследований, и поэтому для многих из них установлена структура и разработаны методы синтеза.
Названия пептидов строятся путем последовательного перечисления аминокислотных остатков, начиная с N-конца, с добавлением суффикса –ил, кроме последней С-концевой аминокислоты, для которой сохраняется ее полное название. Другими словами, названия α-аминокислот, вступивших в образование пептидной связи за счет «своей» СООН-группы, оканчиваются в названии пептида на –ил: аланил, валил и т.п. (для аспаргиновой кислоты используется название аспартил).
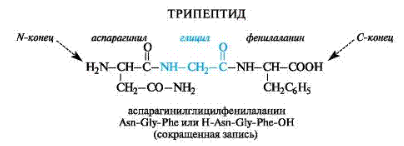
Рисунок 5. Образование трипептида и его название.
Пептиды содержатся во всех видах организмов. В отличие от белков они имеют более разнородный аминокислотный состав. В структурном отношении они более разнообразны: содержат циклические фрагменты, разветвленные цепи и т. д. Пептидную природу имеют многие антибиотики, гормоны, нейропептиды, токсины.
Дипептиды.Представителями самых маленьких пептидов являются содержащие в мышцах животных и человека карнозин (β-аланил-L-гистидин) и ансерин (β-аланил-N-метил-L-гистидин). В их состав входит остаток необычной аминокислоты – β-аланина (структурный изомер α-аланина).

Рисунок 6. Строение дипептидов карнозина и ансерина.
Считается, что эти пептиды выполняют буферные функции при физиологических значениях рН за счет наличия имидазольного кольца (остаток гистидина) с рКа ≈ 6. Ансерин как вещество выделен из мяса мигрирующих рыб, таких как тунец и скумбрия. Ансерин работает, чтобы увеличить выносливость, способствуя разложению молочной кислоты, которая является причиной усталости. Также это вещество повышает способность к физическим нагрузкам, когда необходимо тренироваться в течение длительного времени. Ансерин образуется в мышцах в результате
метилирования карнозина. Основная концентрация карнозина находится в тканях скелетных мышц и головного мозга. Карнозин был выделен российским химиком Владимиром Гулевичем в 1900 году из мышечных волокон. Это первый из открытых биогенных пептидов. По своему действию карнозин похож на ансерин. Карнозин имеет широкое применение в спорте и медицине.
В настоящее время в промышленном масштабе выпускается дипептид аспартам, обладающий почти в200 раз более сладким вкусом, чем сахароза. Аспартам состоит из остатков L-аспарагиновой кислоты и метилового эфира L-фенилаланина. Следует отметить, что при нагревании аспартам разрушается, поэтому не пригоден для подслащивания продуктов, подвергающихся термообработке. Аспартам является искусственным сахарозаменителем. В Европе установлен максимум суточного потребления: 40 мг/кг массы тела. По некоторым данным канцерогенен при суточной дозе больше 20 мг/кг. Надо иметь ввиду, что аспартам возбуждает аппетит.
Рисунок 7. Строение дипептида аспартама.
Трипептиды. Один из наиболее распространенных представителей трипептидов – глутатион – содержится во всех растениях, животных и бактериях.
Наличие остатка цистеина в составе глутатиона обуславливает возможность существования последнего как в восстановленной, так и в окисленной формах.
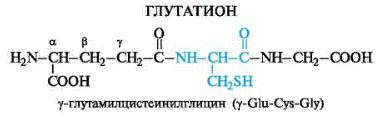
Рисунок 8. Структура трипептида глутатиона (γ-ГЛУ-ЦИС-ГЛИ).
Глутатион участвует в ряде окислительно-восстановительных процессах. Он выполняет функцию протектора белков, т. е. вещества, предохраняющего белки со свободными тиольными группами –SH от окисления с образованием дисульфидных связей –S–S– . Это касается тех белков, для которых такой процесс нежелатенен. Глутатион в этих случаях принимает на себя действие окислителя и таким образом «защищает» белок. Глутатион имеет свойства антиоксиданта, он нейтрализует разрушительное действие свободных радикалов, определяет редокс-статус внутриклеточной среды.
Глутатион – одна из самых важных и сложных молекул в теле человека. Базовый инструмент защиты клеток от повреждений. Сложность молекулы в том, что организм не может принять ее извне. Она способна принести реальную пользу, только когда вырабатывается внутри нашего организма. Его биодоступность при пероральном приеме крайне низкая. Сравнительно большое количество его содержится в печени, мозгах, почках и эритроцитах.
В организме глутатион синтезируется печенью. Для пополнения его организмом возможны следующие варианты. Следует отметить, что растение расторопша повышает уровень глутатиона в клетках печени. Сывороточный протеин восполняет его запасы. Селен – мощный антиоксидант, который создает глутатион. Говяжья печень богата селеном и повышает уровень глутатиона. Витамины С и Е повышают его уровень в эритроцитах и лимфоцитах. А также продукты, содержащие серу. Богаты серой руккола, брокколи, брюссельская капуста, цветная капуста, капуста, редис, репа.
Пептидные гормоны. Большое значение имеет группа пептидов, проявляющих гормональное действие, т. е. регулирующих химические реакции в организме.
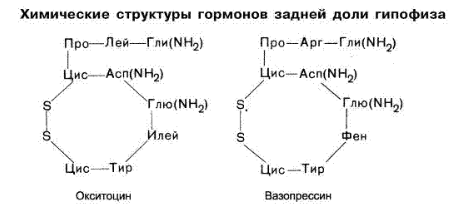
В 1953 году В. Дю Виньо установил строение двух гормонов – окситоцина и вазопрессина, выделяемых задней долей гипофиза. Оба гормона содержат по 9 аминокислотных остатков, т.е. являются нонапептидами. Окситоцин и вазопрессин имеют близкую первичную структуру. Небольшое различие в аминокислотной последовательности оказывается достаточно для специфического биологического действия каждого из этих гормонов. Окситоцин встречается только у женских особей. Он вызывает сокращение гладкой мускулатуры, особенно мускулатуры матки, и применяется в гинекологии и акушерстве в ветеринарной практике. Вазопрессин содержится и в женском и в мужском организмах. Он регулирует минеральный обмен и баланс жидкости. Установлено, вазопрессин относится к числу мощных стимуляторов запоминания.
Ответственный за контроль метаболизма углеводов, жиров и белков гормон инсулин вырабатывается поджелудочной железой. С недостатком инсулина в организме связаны серьезные нарушения углеводного обмена (сахарный диабет). Для того, чтобы расшифровать строение инсулина потребовались годы напряженного труда. В 1943 году американский ученый Ф. Сенгер приступил к расшифровке строения инсулина и лишь через 10 лет получил ответ. Инсулин состоит из двух пептидных цепей А и Б. Цепь А содержит 21, а цепь Б – 30 аминокислотных остатков. Эти цепи соединены двумя дисульфидными мостиками.
Рисунок 9. Строение инсулина.
Пептидные токсины. Пептидно-белковую природу имеют многие токсичные вещества, например токсины ядовитых грибов, пчел, змей, скорпионов.
Пептид апамин является токсичным компонентом яда пчел и оказывает сильное действие на центральную нервную систему. Апамин содержит 18 аминокислотных остатков. Это один из низкомолекулярных нейротоксинов. Самая ядовитая медуза в мире – австралийская морская оса. Она славится своей способностью наносить очень сильные ожоги. В некоторых случаях они могут приводить буквально к моментальной смерти. После ее прикосновения у человека появляется мучительная боль, которая сопровождается чувством сильного жжения. При этом яд медузы обладает множественным действием. Он одновременно поражает нервную систему и кожу, парализует сердечную мышцу. Впрочем, существует и противоядие против морской осы. Но своевременное лечение пострадавшего от укуса, как правило, затруднено или невозможно. Ужаленные купальщики часто получают сердечный приступ и тонут так и не успев, добраться до берега. Действие яда несколько нейтрализует 5% уксус.