ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 08.11.2023
Просмотров: 27
Скачиваний: 2
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
1. Схема процесса.
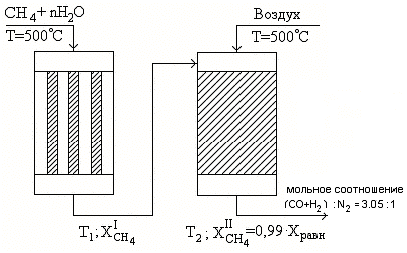
2. Исходные данные.
-
Температура, Т1 = 840 0С; -
Температура, Т2 = 1040 0С; -
Производительность, П(NH3) = 1400 тонн NH3/сутки; -
Концентрация азота в природном газе, С(N2) = 5,0 % (об); -
Потери АВС (азотоводородной смеси) с продувочным газом, Р= 8,0 % (об); -
Коэффициент избытка Н2О , n= 4 % (об).
3.Химическая схема.
I-й реактор: СН4 + Н2О = 3Н2 + СО - 206,4 кДж/моль.
II-й реактор: а) СН4 + Н2О = 3Н2 + СО - 206,4 кДж/моль;
б) Н2 + 1/2О2 = Н2О + 242,0 кДж/моль
4. Расчетная часть.
4.1. Расчет исходных потоков всех компонентов системы.
4.1.1. Расчет производительности установки:
П(NH3) = 1400 тонн NH3/сутки =
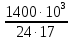 = 3431,37 кмоль/ч
= 3431,37 кмоль/ч4.1.2. Расчет теоретического количества АВС:
N2 + 3H2 = 2 NH3
Gт (АВС) = 2 ∙ П(NH3) = 2 ∙ 3431,37 = 6862,75 кмоль/ч
так как из уравнения реакции следует, что на образование 1 объёма аммиака расходуется 2 объёма азотоводородной смеси (АВС).
4.1.3. Расчет практического количества АВС с учетом потерь:
Gпр (АВС) = Gт (АВС)/(1 – Р) =
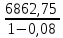 =7459,51 кмоль/ч
=7459,51 кмоль/ч4.1.4. Расчет поступающих N2 и H2:
На образование 2 кмоль аммиака расходуется 3 кмоль водорода, образующегося в результате реакции
СО + Н2О = Н2 + СО2
так как реакция является обратимой, то не идёт до полного расходования окида углерода (II).
По условию мольное соотношение (СО + Н2) :N2=3,05:1 следует, что соотношение (СО + Н2):H2=3,05:3
Кн = μпр/μт = 3,05/3,0 = 1,017,
где Кн– коэффициент, учитывающий, что не весь СО превратится в СО2 по реакции СО + Н2О = Н2 + СО2;
Расчёт количества водорода:
N0(H2)=(Gпр (АВС)*v(H2)*Кн)/(v(H2)+v(N2))= 7459,51*3*1,017/4=5689,74 кмоль/ч
V0(H2)=N(H2)*Vm= 5689,74кмоль/ч*22,4м3/кмоль=
=127450,13 м3/ч
G0(H2) = N(H2)*М(H2)= 5689,74кмоль/ч*2кг/кмоль = 11379,48кг/ч
Расчёт количества азота:
N0(N2)=(Gпр (АВС)*v(N2)*Кн)/(v(H2)+v(N2))= 7459,51*1*1,017/4=1896,58 кмоль/ч
V0(N2)=N0(N2)*Vm=1896,58 кмоль/ч*22,4м3/кмоль=
=42483,38 м3/ч
G0(N2) = N0(N2)*М(N2)= 1896,58кмоль/ч*28кг/кмоль = 53104,22 кг/ч
4.1.5. Расчет поступающих СН4, воздуха и воды:
Водород и смесь АВС образуются при конверсии природного газа.
СН4+Н2О=3Н2+СО
СО+Н2О=Н2+СО2
Суммарная реакция
СН4+2Н2О+СО=4Н2+СО+СО2
СН4+2Н2О=4Н2+СО2
Учтём, что подаваемый в составе воздуха кислород полностью расходуется на сгорание образовавшегося в результате реакции водорода.
О2+2Н2=2Н2О
Степень превращения исходного природного газа на выходе из всей системы составит 0,99*Хравн (Хравн- равновесная степень превращения)
Степень превращения природного газа после 2 ступеней конверсии равна
ХIIСН4=0,99*0,9999=0,9899
Составим систему уравнений для нахождения значений неизвестных величин:
Азот не вступает в реакцию, приходит из воздуха и природного газа.
N(N2)=Nвозд(N2)+Nприрод газ(N2)
Водород образуется при газификации метана и расходуется в реакции сгорания.
N(Н2)=Nреакции(Н2)-Nсгорания(Н2)
Получаем систему уравнений с 2 неизвестными: исходным количеством природного газа и воздуха
N0(H2) = 4 ∙N0(СН4) ∙ ХIIСН4 – 0,21 ∙ N0(возд) ∙ 2
(По реакциям
СН4+2Н2О=4Н2+СО2
О2+2Н2=2Н2О)
N0(N2) =N0(СН4) ∙ [C(N2)/(C(СН4))]+ 0,79 ∙ N0(возд)=
=N0(СН4) ∙ [C(N2)/(1 – C(N2))]+ 0,79 ∙ N0(возд)
Принимаем, что воздух сухой, состоящий на 21% из кислорода и на 79%(об.) из азота.
Решаем полученную систему уравнений:
5689,74=3,9596 ∙N0(СН4) – 0,42 ∙ N0(возд)
1896,58=0,05∙N0(СН4) + 0,79 ∙ N0(возд)
12593,29=7,494∙N0(СН4)
N0(СН4)=1679,85 кмоль/ч
Подставим в 1 из уравнений системы:
1896,58=83,99 + 0,79 ∙ N0(возд
N0(возд) = 2288,82 кмоль/ч
V0(возд)=N0(возд)*Vm=2288,82 кмоль/ч*22,4м3/кмоль=51269,5 м3/ч
G0(возд) = 2288,82 кмоль/ч*29 кг/кмоль=66375,7 кг/ч
N0(СН4) = 1679,85 кмоль/ч
V0(СН4)=N0(СН4)*Vm=1679,85 кмоль/ч*22,4м3/кмоль=37628,61 м3/ч
G0(СН4) = 1679,85 кмоль/ч*16 кг/кмоль=26877,58 кг/ч
Расчёт исходного количества воды:
N0(Н2О) = N0(СН4) ∙ n = 4*1679,85 кмоль/ч=6719,39 кмоль/ч
V0(Н2О)=N0(Н2О)*Vm=6719,39 кмоль/ч*22,4м3/кмоль=150514,43 м3/ч
G0(Н2О) = 6719,39 кмоль/ч*18 кг/кмоль=120,949,1 кг/ч
Расчёт количества кислорода в воздухе:
N0(O2)=0,21*2288,82кмоль/ч=480,65 кмоль/ч
V0(О2)=N0(О2)*Vm=480,65 кмоль/ч*22,4м3/кмоль=10766,6 м3/ч
G0(О2) = 480,65кмоль/ч*32 кг/кмоль=15380,86 кг/ч
Расчёт количества азота в воздухе:
Nвозд(N2)=0,79*2288,82кмоль/ч=1808,17 кмоль/ч
Vвозд(N2)=N(N2)*Vm=1808,17 кмоль/ч*22,4м3/кмоль=40502,92 м3/ч
Gвозд(N2) = 1808,17 кмоль/ч*28 кг/кмоль=50628,65 кг/ч
4.2. Расчет теплового баланса и степени превращения по с первого реактора Х1.
4.2.1. Расчет теплоемкости компонентов системы.
По справочнику Равделя находим данные и заносим их в таблицу:
| Теплоём-кость | Уравнение | Значение Ср, кДж/(кмоль ∙ град) | ||
| при Т1 = 1113К | при Т2 = 1313К | при Т = 773К | ||
| Ср(N2) | 27,87 + 4,27 ∙ 10-3 ∙ Т | 32,62 | 33,48 | 31,17 |
| Ср(H2) | 27,28 + 3,26 ∙ 10-3 ∙ Т + 0,502 ∙ 105 / Т2 | 30,95 | 31,59 | - |
| Ср(O2) | 31,46 + 3,39 ∙ 10-3 ∙ Т – 3,77 ∙ 105 / Т2 | 34,93 | - | 33,45 |
| Ср(CO) | 28,41 + 4,10 ∙ 10-3 ∙ Т – 0,46 ∙ 105 / Т2 | 32,94 | 33,77 | - |
| Ср(H2O) | 30,00 + 10,71 ∙ 10-3 ∙ Т + 0,33 ∙ 105 / Т2 | 41,95 | 44,08 | 38,34 |
| Ср(CH4) | 14,32 + 74,66 ∙ 10-3 ∙ Т – 17,43 ∙ 10-6 ∙ Т2 | 75,83 | 82,30 | 61,62 |
4.2.2. Расчет тепловых потоков, входящих во второй реактор:
1) Qвх(СН4) = Nвх(CH4) ∙ Cp ∙ T1 = N0(CH4) ∙ (1 – X1) ∙ Cp ∙ T1 =1679,85 ∙ (1 – X1) ∙ 75,80∙ 1113 = 141767,53∙(1 – X1) МДж/ч
2) Qвх(H2O) = N0(H2O) ∙ (1 – X1 / n) ∙ Cp ∙ T1 =6719,39∙ (1 – 0,25 X1) ∙ 41,95 ∙ 1113 =
=313707,46 ∙ (1 – 0,25 X1) МДж/ч
3) Qвх(CO) = N0(CH4) ∙ X1 ∙ Cp ∙ T1 = 1679,85∙ X1 ∙ 32,94∙ 1113 = 61579,81 ∙ X1 МДж/ч
4) Qвх(H2) = 3 ∙ N0(CH4) ∙ X1 ∙ Cp ∙ T1 =3 ∙ 1679,85∙ X1 ∙ 30,95 ∙ 1113 = 173592,85 ∙ X1 МДж/ч
5) Qвх(N2) = Qвозд + Qост = N0(возд) ∙0,79 ∙ Cp(N2) ∙ T(возд) + N0(CH4) ∙[C(N2)/(1 – C(N2))] ∙
∙ Cp(N2) ∙ T1 = 2288,82 ∙0,79 ∙ 31,17 ∙ 773 + 1679,85 ∙[0,05/(1 – 0,05))] ∙ 32,62 ∙ 1113 = =46777,87 МДж/ч
6) Qвх(O2) = N0(возд) ∙0,21 ∙ Cp(О2) ∙ T(возд) =2288,82∙0,21 ∙ 33,45 ∙ 773 = 12427,97 МДж/ч
4.2.3. Расчет массовых и тепловых потоков, выходящих из второго реактора:
1) Nвых(СН4) = Nвх(CH4) ∙ (1 – Х2) = N0(CH4) ∙ (1 – X1) ∙ (1 – Х2) =1679,85 ∙ (1 – X1) ∙ (1 – 0,9899) = 16,97 ∙ (1 – X1) кмоль/ч
Qвых(СН4) = Nвх(CH4) ∙ Cp ∙ T2 = 16,97 ∙ (1 – X1) ∙ Cp ∙ T2 = = 16,97(1 – X1) ∙ 82,3∙ 1313 = 1833,39 ∙ (1 – X1) МДж/ч
2) Nвых(Н2) = Nвх(CH4) ∙ 3 ∙ Х2 – 0,21 ∙N0(возд) ∙ 2 + N0(CH4) ∙ 3 ∙ Х1 =N0(CH4) ∙ (1 – X1) ∙ 3 ∙ Х2 – 0,21 ∙N0(возд) ∙ 2 +
N0(CH4) ∙ 3 ∙ Х1 =1679,85 ∙ (1 – X1) ∙ 3 ∙ 0,9899 – 0,21 ∙2288,82 ∙ 2 + 1679,85∙ 3 ∙ Х1 = 4027,34 + 50,90∙ Х1 кмоль/ч
Qвых(Н2) = Nвых(H2) ∙ Cp ∙ Т2 =(4027,34 + 50,90∙ Х1) ∙ 31,59 ∙ 1313 = 167042,14 + 2111,16 ∙ Х1 МДж/ч
3) Nвых(СО) = Nвх(CH4) ∙ Х2 + N0(CH4) ∙ Х1 =
= N0(CH4) ∙ (1 – Х1)∙ Х2 + N0(CH4) ∙ Х1 = = 1679,85 ∙ (1 – Х1)∙ 0,9899 + 1679,85 ∙ Х1 = 1662,88 + 16,97 ∙ Х1 кмоль/ч
Qвых(СО) = Nвых(СО) ∙ Cp ∙ T2 = (1662,88 + 16,97∙ Х1) ∙ 33,77 ∙ 1313 =
= 73724,82 + 752,22 ∙ Х1 МДж/ч
4) Nвых(Н2О) =Nвх(H2О) –Nвх(CH4) ∙ Х2+ 0,21 ∙N0(возд) ∙ 2 = = N0(H2О) ∙ (1 – Х1 /n) – N0(CH4) ∙ (1 – Х1)∙ Х2 + 0,21 ∙N0(возд) ∙ 2 =
= 6719,40 ∙ (1 – 0,25 ∙ Х1) – 1679,85 ∙ (1 – Х1)∙ 0,9899 + 0,21 ∙ 2288,82 ∙ 2 =
= 6017,82 – 16,97 ∙ Х1 кмоль/ч
Qвых(Н2О) = Nвых(Н2О) ∙ Cp ∙ T2 = = (6017,82 – 16,97 ∙ Х1) ∙ 44,08 ∙ 1313= 348304,20 – 982,00 ∙ Х1 МДж/ч
5) Nвых(N2) = Nвх(N2) = 1896,58 кмоль/ч
Qвых(N2) = Nвых(N2) ∙ Cp ∙ T2 = 1896,58 ∙ 33,48 ∙ 1313 =83363,49 МДж/ч
4.2.4. Расчет источников энергии:
Q1(CH4) –тепловой эффект конверсии метана:
Q1(CH4) = – N0(CH4) ∙ (Х2 – X1) ∙ Qх.р. =
= – 1679,85 ∙ (0,9899 – X1) ∙ 206,4 кмоль/ч ∙ МДж/кмоль =
= 346720,74∙ X1 – 343218,86 МДж/ч
Q1(О2) –тепловой эффект сгорания кислорода:
Q1(О2) = N0(возд) ∙ 0,21 ∙ 2∙ Qх.р. = = 2288,82 ∙ 0,21 ∙ 2∙ 242 = 232635,46 МДж/ч
4.2.5. Расчет степени превращения Х1:
∑