Добавлен: 08.11.2023
Просмотров: 527
Скачиваний: 34
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Медицинский колледж
ФГБОУ ВО ДГМУ Минздрава России
Проектная работа на тему:
Электролиз растворов и электролитов
Выполнил студент: 1 курса 5 потока
31.02.02 «Сестринское дело»
Арсланбеков Рамазан Русланович
Руководитель: Марина Абдулжалиловна
Махачкала 2023
Содержание
Введение…………………………………………………………………………........................................................3
Глава 1 Основные понятия и теоретические основы…………….………………………………………….….....4
-
Определение электролиза и его принципы……………………………………………………………...…….4 -
Понятие электролитов и растворов…………………………………………………………………...………..5 -
Анодные и катодные реакции………………………………………………………………………………......6 -
Законы Фарадея………………………………………………………………………………………………….7
Глава 2 Методы исследования электролиза………………………………………………………………………..8
2.1 Экспериментальные методы и оборудование…………………………………………………………………..8
2.2 Принципы проведения электролиза……………………………………………………………………………10
Глава 3 Влияние факторов на электролиз………………………………………………………………………...11
3.1 Концентрация раствора или электролита…………………………………………………………………...…11
3.2 Плотность тока…………………………………………………………………………………………………..13
3.3 Время проведения электролиза………………………………………………………………………………...14
3.4 Температура……………………………………………………………………………………………………...15
Глава 4 Практические применения электролиза…………………………………………………………………16
4.1 Электрохимическая очистка металлов………………………………………………………………………...16
4.2 Электролиз в производстве химических соединений………………………………………………………...18
4.3 Электролиз в электрохимических источниках энергии………………………………………………………19
Глава 5 Примеры экспериментов с электролизом………………………………………………………………..20
5.1 Электролиз раствора соли………………………………………………………………………………………20
5.2 Электролиз воды………………………………………………………………………………………………...21
5.3 Электролиз раствора кислот и щелочи………………………………………………………………………...22
Заключение…………………………………………………………………………………………………………..24
Список литературы……………………………………………………………………………………………….....25
Введение
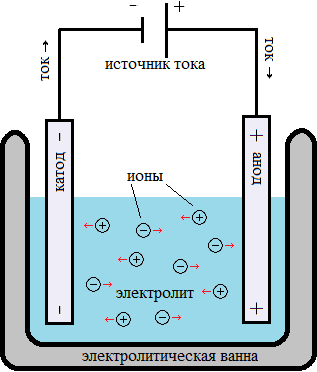
Электролиз растворов и электролитов - это процесс разложения вещества на его составные части с использованием электрического тока. Во время электролиза ток пропускается через электролит или раствор, и происходят окислительно-восстановительные реакции на электродах.
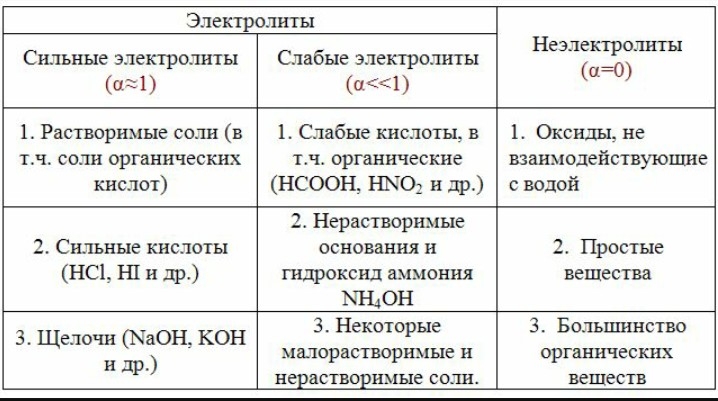
Электролиты - это вещества, способные проводить электрический ток. Они могут быть представлены в виде растворов или расплавов солей, кислот или щелочей. Когда электрический ток проходит через электролит, ионы вещества движутся к электродам и участвуют в реакциях.
Глава 1
-
Определение электролиза и его принципы
Электролиз - это процесс разложения вещества на составные части с использованием электрического тока. Он основан на принципе электрохимических реакций, которые происходят в растворе или электролите под воздействием постоянного электрического тока.
Принципы электролиза основаны на двух основных законах электролиза, известных как законы Фарадея:
Первый закон Фарадея (закон электролиза): Масса вещества, разложенного или отложенного на электродах, пропорциональна количеству электричества, прошедшему через электролит. Формально можно записать этот закон следующим образом:
m = Q * F * n,
где m - масса вещества, Q - количество электричества (заряд), F - фарадей (электрохимическая константа), n - число электронов, участвующих в реакции.
Второй закон Фарадея (закон эквивалентов): Массы разных веществ, разложенных или отложенных на электродах, пропорциональны их эквивалентным массам. Эквивалентная масса вещества определяется как масса вещества, соответствующая 1 молью перенесенных зарядов.
m = E * Z,
где m - масса вещества, E - эквивалентная масса, Z - количество перенесенных зарядов.
Эти законы позволяют связать количество прошедшего через электролит заряда с количеством разложенного вещества на электродах. Они являются основой для расчета и интерпретации результатов электролиза.
Электролиз широко применяется в различных областях, таких как производство металлов, электрохимические источники энергии, электрохимическая обработка поверхностей, электрохимический синтез химических соединений и другие.
-
Понятие электролитов и растворов
Электролиты - это вещества, способные проводить электрический ток в растворе или при плавлении. Они обладают свободными движущимися заряженными частицами, которые называются ионами. Ионы могут быть положительно заряженными (катионами) или отрицательно заряженными (анионами).
Электролиты могут быть представлены в различных формах:
-
Растворы электролитов: Это смеси, в которых электролит полностью или частично диссоциирует на ионы в растворителе (обычно в воде). Примеры включают солевые растворы, кислотные и щелочные растворы. -
Расплавы электролитов: Некоторые электролиты могут образовывать расплавы при достаточно высоких температурах, в которых ионы свободно движутся. Примеры включают расплавы солей или металлические расплавы. -
Газовые электролиты: Некоторые газы, такие как кислород, хлор и водород, могут служить электролитами, когда они находятся в ионизированном состоянии, например, в электролитических газовых разрядах.
Электролиты играют важную роль в электролизе, поскольку ионы электролита являются носителями заряда и участвуют в реакциях на электродах. Во время электролиза, положительно заряженные ионы (катионы) притягиваются к отрицательно заряженному электроду (катоду), где происходят восстановительные реакции, в то время как отрицательно заряженные ионы (анионы) притягиваются к положительно заряженному электроду (аноду), где происходят окислительные реакции.
-
Анодные и катодные реакции
Анодные и катодные реакции являются важной частью электролиза и определяют процессы, происходящие на электродах. Рассмотрим каждый тип реакций подробнее:
-
Анодные реакции:
Анод - это положительно заряженный электрод, на котором происходят окислительные реакции. Во время электролиза, вещество на аноде теряет электроны и окисляется. Общая химическая реакция на аноде обычно записывается в виде окисления иона или молекулы, приводящего к образованию положительно заряженного продукта. Например, при электролизе раствора хлорида натрия (NaCl) на аноде происходит следующая анодная реакция:
2Cl⁻ → Cl₂ + 2e⁻
В данном случае ионы хлорида (Cl⁻) окисляются до молекул хлора (Cl₂) с выделением двух электронов.
-
Катодные реакции:
К
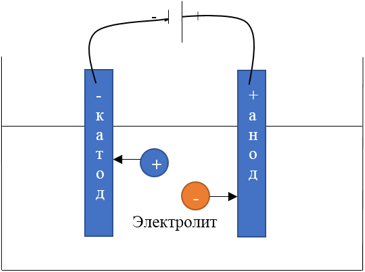 атод - это отрицательно заряженный электрод, на котором происходят восстановительные реакции. Во время электролиза, вещество на катоде получает электроны и восстанавливается. Общая химическая реакция на катоде обычно записывается в виде восстановления иона или молекулы, приводящего к образованию негативно заряженного продукта. Продолжая пример с раствором хлорида натрия, на катоде происходит следующая катодная реакция:
атод - это отрицательно заряженный электрод, на котором происходят восстановительные реакции. Во время электролиза, вещество на катоде получает электроны и восстанавливается. Общая химическая реакция на катоде обычно записывается в виде восстановления иона или молекулы, приводящего к образованию негативно заряженного продукта. Продолжая пример с раствором хлорида натрия, на катоде происходит следующая катодная реакция:2H₂O + 2e⁻ → H₂ + 2OH⁻
В этой реакции молекулы воды (H₂O) восстанавливаются до молекул водорода (H₂) с присоединением двух электронов, а также образуются ионы гидроксида (OH⁻).
Важно отметить, что анодные и катодные реакции обязательно согласуются друг с другом, чтобы поддерживать электрическую нейтральность системы в целом. Это означает, что сумма зарядов, переносимых ионами на аноде и катоде, должна быть одинаковой.
-
Законы Фарадея
Законы Фарадея описывают количественную связь между количеством электричества, проходящего через электролит, и количеством вещества, разложенного или отложенного на электродах во время электролиза. Эти законы были сформулированы английским ученым Майклом Фарадеем в 1833 году.
Первый закон Фарадея (закон электролиза) гласит:
"
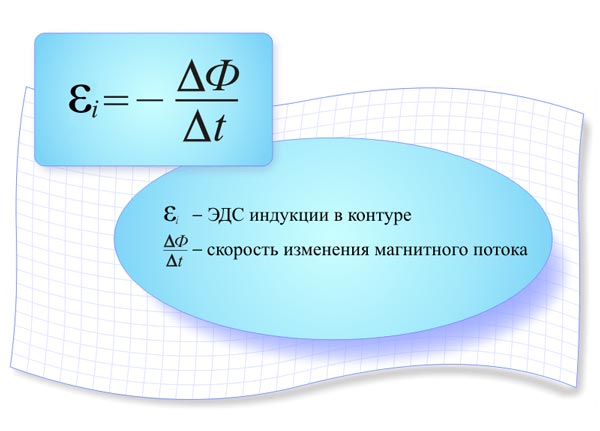 Количество вещества, разложенного или отложенного на электродах во время электролиза, пропорционально количеству электричества (заряду), прошедшему через электролит."
Количество вещества, разложенного или отложенного на электродах во время электролиза, пропорционально количеству электричества (заряду), прошедшему через электролит."Формально этот закон может быть выражен следующим образом:
m = Q * F * n,
где:
m - масса вещества, разложенного или отложенного на электродах,
Q - количество электричества (заряд), прошедшее через электролит,
F - фарадей (электрохимическая константа), равная заряду, переносимому одним молью электронов,
n - число электронов, участвующих в реакции.
Второй закон Фарадея (закон эквивалентов) гласит:
"Массы различных веществ, разложенных или отложенных на электродах во время электролиза, пропорциональны их эквивалентным массам."
Формально этот закон может быть выражен следующим образом:
m = E * Z,
где:
m - масса вещества, разложенного или отложенного на электродах,
E - эквивалентная масса, определяемая как масса вещества, соответствующая 1 молью перенесенных зарядов,
Z - количество перенесенных зарядов.
Законы Фарадея являются фундаментальными в электрохимии и широко используются для расчетов электролиза и интерпретации результатов электрохимических процессов.
Глава 2
2.1 Экспериментальные методы и оборудование
В экспериментах, связанных с электролизом растворов и электролитов, используются различные методы и оборудование. Ниже перечислены некоторые из них:
Электролитическая ячейка: Электролитическая ячейка - это основное оборудование, которое используется для проведения электролиза. Ячейка состоит из двух электродов (анода и катода), которые погружены в электролит. Электроды обычно изготавливаются из проводящих материалов, таких как платина или карбон, и размещаются таким образом, чтобы они не соприкасались друг с другом.
Источник постоянного тока: Для электролиза требуется источник электрического тока постоянной силы. Это может быть источник постоянного тока, такой как батарея или источник питания постоянного тока, способный обеспечивать стабильный ток нужной силы.
Амперметр: Амперметр используется для измерения силы тока, протекающего через электролитическую ячейку. Он подключается последовательно к источнику постоянного тока и электролитической ячейке, и позволяет контролировать и измерять ток, проходящий через систему.
Вольтметр: Вольтметр используется для измерения разности потенциалов (напряжения) между электродами электролитической ячейки. Он может быть подключен параллельно к электродам для измерения напряжения в системе.
Растворитель или электролит: В зависимости от конкретной цели эксперимента, могут использоваться различные растворители или электролиты. Например, для исследования электролиза растворов можно использовать водные растворы солей, кислот или щелочей.
Реакционные емкости: Для проведения электролиза и сбора продуктов реакции используются реакционные емкости, такие как стеклянные или пластиковые контейнеры. Они обеспечивают безопасное и контролируемое окружение для процесса электролиза.
Электроды: Электроды используются для подачи электрического тока в электролитическую ячейку и взаимодействия с раствором или электролитом. Электроды могут быть изготовлены из различных материалов в зависимости от требуемых реакций и условий эксперимента.