Файл: Лабораторная работа 8 Окислительновосстановительные реакции Студент, группы Иркутск 2023.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 08.11.2023
Просмотров: 28
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Министерство науки и образования Российской Федерации
ИРКУТСКИЙ НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ
ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
Институт Заочно-вечернего обучения
Кафедра «Химии и биотехнологии имени В.В. Тутуриной»
Основы химии
Лабораторная работа №8
Окислительно-восстановительные реакции
Выполнил:
Студент, группы
Иркутск – 2023
Лабораторная работа
Окислительно-восстановительные реакции
Выполнение работы
Опыт 1. Влияние рН среды на окислительно-восстановительные реакции
В три пробирки налить по 2-3 мл раствора перманганата калия. В первую пробирку прилить 1-2 мл разбавленной серной кислоты, во вторую 1-2 мл дистиллированной воды, в третью – 1-2 мл концентрированного раствора щелочи.
В каждую пробирку добавить по одному шпателю кристаллического сульфита натрия. Отметить наблюдения, учитывая, что фиолетовая окраска характерна для ионов MnO4‾, бесцветная или слабо-розовая − для ионов Mn2+, зеленая – для ионов MnO42−, бурый цвет имеет осадок MnO2.
Требования к результатам опыта:
1. Написать уравнения реакций. В каждой реакции указать окислитель, восстановитель, среду, процессы окисления и восстановления. Составить электронный баланс к каждой реакции, на основании которого расставить коэффициенты в уравнении.
2. Сделать вывод о влиянии среды на процесс восстановления марганца.
1.Уравнения реакций взаимодействия KMnO4 с Na2SO3
a)в кислой среде:
окислитель восстановитель среда
Mn+7 + 5e → Mn+2 2 - окислитель
b)в щелочной среде:
окислитель восстановитель среда
Mn+7 + 1e → Mn+6 2 - окислитель
c)в нейтральной среде:
окислитель восстановитель среда
Mn+7 + 3e → Mn+4 2 - окислитель
2.Вывод о характерной степени окисления марганца
· в кислой среде: Mn+7 → Mn+2
· в щелочной среде: Mn+7 → Mn+6
· в нейтральной среде: Mn+7 → Mn+4
Опыт 2. Окислительно-восстановительная двойственность нитрита натрия
В пробирку налить 1-2 мл раствора перманганата калия, добавить 1-2 мл разбавленной серной кислоты. Затем прилить раствор нитрита натрия. Отметить изменение окраски раствора.
В другую пробирку налить раствор йодида калия, добавить 1-2 мл разбавленной серной кислоты. Затем прилить раствор нитрита натрия. Отметить цвет раствора. Затем добавить раствор крахмала и отметить появление синей окраски. Объяснить, чем обусловлено изменение цвета раствора.
Требования к результатам опыта
1. Составить уравнения реакций. Указать в каждой реакции окислитель, восстановитель, среду, процессы окисления и восстановления. Составить электронный баланс к каждой реакции, на основании которого расставить коэффициенты в уравнении.
2. Сделать вывод об окислительно-восстановительных функциях нитрита натрия в проведенных реакциях.
1.
· Уравнения реакций (I)
окислитель среда восстановитель
N+3 – 2e → N+5 3 - восстановитель
· Уравнения реакций (II)
восстановитель среда окислитель
2 - окислитель
2.Вывод об окислительно-восстановительных функциях KNO2
Нитрит калия KNO2 содержит азот в степени окисления +3
· Реакция (I): N+3 → N+5 ⇒ KNO2 – восстановитель
· Реакция (II):
Общий вывод: Вещества, которые содержат элемент в промежуточной степени окисления, в зависимости от условий проведения реакции может быть и окислителем, и восстановителем (в присутствии сильных окислителей проявляют восстановительные свойства, а при взаимодействии с активными восстановителями являются окислителями). Эти вещества могут проявлять окислительно-восстановительную двойственность.
Опыт 3. Окислительно-восстановительная двойственность пероксида водорода
В пробирку налить 1-2 мл раствора пероксида водорода, добавить 1-2 мл разбавленной серной кислоты. Затем прилить раствор йодида калия. Отметить изменение окраски раствора.
В другую пробирку налить раствор перманганата калия, добавить 1-2 мл разбавленной серной кислоты. Затем прилить раствор пероксида водорода. Отметить изменения цвета раствора.
Требования к результатам опыта
1. Составить уравнения реакций. Указать в каждой реакции окислитель, восстановитель, среду, процессы окисления и восстановления. Составить электронный баланс к каждой реакции, на основании которого расставить коэффициенты в уравнении.
2. Сделать вывод об окислительно-восстановительных функциях пероксида водорода в проведенных реакциях.
-
Уравнение реакции, учитывая, что продуктом окисления йода в щелочной среде является йода натрия NaIO3.
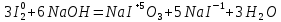
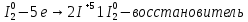
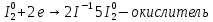
-
Общий вывод: Вещество содержит элемент в промежуточной степени окисления и молекулы этого элемента реагируют друг с другом как окислитель и как восстановитель. Это вещество может участвовать в реакциях диспропорционирования.
Опыт 4. Реакция диспропорционирования
Поместить в пробирку 1–2 кристалла йода, добавить 3-5 капель концентрированного раствора щелочи, слегка нагреть. Затем добавить раствор серной кислоты и наблюдать появление желтой окраски раствора, характерной для свободного йода.
Требования к результатам опыта
1. Составить уравнение реакции, указать окислитель, восстановитель, среду, процессы окисления и восстановления. Составить электронный баланс к реакции, на основании которого расставить коэффициенты в уравнении.
2. Сделать вывод, какие вещества могут участвовать в реакциях диспропорционирования.
В сухую пробирку помещу небольшое количество
Уравнение реакции:
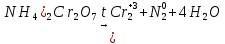
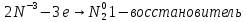
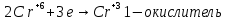
Вывод: эта реакция – реакция внутримолекулярная.