Файл: Реферат Таырыбы Газдар Тексерген Оу практикасыны жетекшісіАргынбаева Зауре Музировна.docx
Добавлен: 08.11.2023
Просмотров: 15
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Қазақ ұлттық қыздар педагогикалық университеті
Жаратылыстану институті
Химия кафедрасы

Реферат
Тақырыбы: Газдар
Тексерген: Оқу практикасының жетекшісі-Аргынбаева Зауре Музировна
Орындаған: 6В05301-химия 1 курс студенті Исмадинова Арай
Алматы,2022-2023ж.
I Кіріспе
1.1 Газ дегеніміз не?
II Негізгі бөлім
2.1 Газдардың қандай түрлері бар?
2.2 Газдардың алынуы жолдары?
2.3 Газдардың физикалық және химиялық қасиеттері қандай?
III Қорытынды
IV Пайданылған әдебиет
Кіріспе
1.1 Газ дегеніміз не?
Газ—заттыңатомдары мен молекулалары бір-бірімен әлсіз байланысқандықтан, кез келген бағытта еркін қозғалатын және өзіне берілген көлемгетолық жайылып орналасатын агрегаттық күйі. «Газ» атауын ғылыми қолданысқа 17 ғасырдың басында голланд ғалымы Ян Баптист ван Гельмонт енгізген. Газ молекулаларының соқтығысу уақыты олардың еркін жолға кететін уақытынан әлде қайда аз болады. Химиялық элементтердіңөте кіші бөлшекке бөлініп, бейтарап ұшуы. Негізгі тұрмыстағы газдар пропан, бутан, неон және тағыда басқа Газ қатты дене мен сұйықтық тәрізді еркін бет түзбейді және ол берілген көлемді толық толтырып тұрады. Газ тәрізді күй – заттардың (жұлдызаралықзаттар, тұмандықтар, жұлдыздар, планеталардыңатмосферасы, тағыдабасқа) ғаламдағы ең көп таралған күйі. Химиялық қасиеттері бойынша газдар және олардың қоспалары (активтілігі аз инерттігаздар мен қопарылғышгаздарқоспасынадейін) сан алуан болып келеді. Газға атомдар мен молекулалардан тұратын жүйе ғана емес, кейде басқа бөлшектерден – фотондардан, электрондардан, броундық бөлшектерден, сондай-ақ плазмадан тұратын жүйелер де жатқызылады.
Негізгі бөлім
2.1 Газдардың қандай түрлері бар?
ТҰТАНҒЫШТЫҚ БОЙЫНША ЖІКТЕУ
тұтану және жану процестерін мінез-құлық ерекшеліктеріне байланысты газдардың барлық түрлері, тотығу инертті және жанғыш бөлінеді.
-
Антиоксиданттар мен оттан ықпал, бірақ олар жазуға болмайды: әуе, оттегі, фтор, хлор, азот тотығы және диоксиді.
-
Инертті жану қатысу емес, алайда, қарқындылығы қысқарту процесіне оттегі мен ықпалын ығыстыра бейім: гелий, неон, ксенон, азот, аргон, көмірқышқыл газы.
-
Жанғыш жарық немесе оттегі ұштастыра жарылуы: метан, аммиак, сутегі, ацетилен, пропан, бутан, көміртегі тотығы, этан, этилен. Олардың көпшілігі тек газ қоспасының белгілі бір жағдайларда жағу сипатталады. Бұл сипат, газ арқасында - отын түрі, ең көп таралған бүгін. Бұл метан, пропан, бутан сияқты пайдаланылады.
Сұйытылған газ-табиғи текті заттардың арасында және межелі процесі және жанғыштығын калориялық жоғары дәрежесі, мұндай қамалады. сақтау, тасымалдау және пайдалану үшін, сұйытылған газ мынадай түрлері: метан, пропан, бутан, және пропан-бутан қоспасы.
Бутан (C 4 H 10), және пропан мұнай газдарын компоненттері болып табылады. -0,5˚S - бірінші -1 сұйытылған. Ұстау және суық ауа райы таза бутан бағдарлама байланысты оның қату үшін жүргізілген жоқ. пропан сұйылту температурасы (C 3 H 8) -41 - -42˚S, сын қысым - 4,27 МПа.
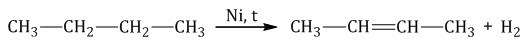
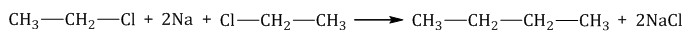
Метан (CH 4), - негізгі компонент табиғи газ. Түрлері газ көзі - мұнай кен, биогенді процестердің өнімдері. Сұйылту қысу фаза арқылы жүреді және -160 үшін қызуды азайтуға - -161˚S. Әрбір кезеңде 5-10 есе сығылады.
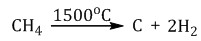
Al4C3 + 12H2O = 4Al(OH)3 + 3CH4
Жанғыш газдар-олар құрамдас бөліктері жанармай ретінде жұмыс істейтін газдар, өйткені олар жылу энергиясын өндіру үшін қолданылады. Олардың кейбіреулері табиғи газ, сұйытылған мұнай газы және сутегі.
Өндірістік газдар-олар денсаулыққа, азық-түлікке, қоршаған ортаны қорғауға, металлургияға, химия өнеркәсібіне, қауіпсіздік салаларына және басқаларына арналған әр түрлі мақсаттар мен қолдану үшін халыққа сатылатын өндірілген газдар. Бұл газдардың кейбіреулері оттегі, азот, гелий, хлор, сутегі, көміртек тотығы, пропан, метан, азот оксиді және басқалары.
Инертті газдар-олар белгілі бір температура мен қысым жағдайында химиялық реакция туғызбайтын немесе өте төмен реакция тудыратын газдар. Олар неон, аргон, гелий, криптон және ксенон. Олар реактивті емес элементтер қажет болатын химиялық процестерде қолданылады.
2.2 Газдардың алынуы жолдары?
Алынуы
1. Өнеркәсіпте:
Мұнай өнімдерін крекингілеу: C16H34=8H18+C8H16
2. Зертханада:
а) карбидті гидролиздеу: Al4C3+12H2O=3CH4+Al(OH)3
б)Вюрц реакциясы: C2H5Cl+2Na=C4H10+4NaCl
в)карбон қышқылының натрий тұздарын декарбоксилдеу:
CH3COONa+2NaOH=CH4+Na2CO3
2.Сутек газын өнеркәсіпте алу:
2H2O=2H2+2O2
CH4+2H2 O=CO2+4H2
Сутек газын зертханада алу:
2Na+2H2O=2NaOH+H2
Zn+2HCL=ZnCl2+H2
CaH2+H2O=CA(OH)2+H2
2AI+2NaOH+2H2O=2NaAIO2+3H2
3.Көмірқышқыл газын алу:
C+O2=CO2
2K2Cr2O7+3C+8H2SO4=2Cr2(SO4)3+2K2SO4+3CO2+8H2O
C+2H2SO4=CO2+2SO2+2H2O
CaCO3+2HCl=CaCl2+CO2+H2O
Азот газын алу:
NH4NO2=N2+2H2O
(NH4)2Cr2O7=N2+CrO3+4H2O
3CuO+2NH3=3Cu+N2+3H2O
-
Газдардың физикалық және химиялық қасиеттері қандай?
Газдардың негізгі қасиеттері өткір иісті кейбірі жанғыш болып келеді.Әр газдын физикалық қасиеттері әр түрлі солардың бір-екеуіне тоқтала кетсек:
-
Сутек газының физикалық қасиеті-Сутек газ күйіндегі зат, бірақ бұл газды -2530 С градусқа дейін салқындатсақ, сутек сұйыққа айналады. Сутек суда нашар ериді, 100 көлем суда 2 көлем сутек ериді. Сутектің иісі де, түсі де жоқ.Сутек өте жеңіл газ, мысалы ауадан 14,5 есе жеңіл. Сутектің тығыздығы 0,089 г/л.
-
Көмірқышқыл газының физикалық қасиеті-түссіз газ, аз концентрацияларда ауада иісі жоқ, үлкен концентрацияларда газдалған судың қышқыл иісі бар. Ауадан шамамен 1,5 есе ауыр.Көмірқышқыл газының молекуласы сызықтық, көміртегінің орталық атомының ортасынан оттегінің екі атомының орталықтарына дейінгі қашықтық 116,3 пм-78,3 °С температурада ақ қар тәрізді масса түрінде кристалданады- "құрғақ мұз". Атмосфералық қысымда құрғақ мұз ерімейді, ал буланады, сұйық күйге ауыспай, сублимация температурасы -78 °с.сұйық көмірқышқыл газын қысымның жоғарылауы кезінде алуға болады. Осылайша, 20 °С температурада және 6 МПа (
60 атм) жоғары қысымда газ түссіз сұйықтыққа қойылтылады. Тыныш электр разрядында тән ақ-жасыл жарықпен жарқырайды.
Антиоксиданттар мен оттан ықпал, бірақ олар жазуға болмайды: әуе, оттегі, фтор, хлор, азот тотығы және диоксиді.
Инертті жану қатысу емес, алайда, қарқындылығы қысқарту процесіне оттегі мен ықпалын ығыстыра бейім: гелий, неон, ксенон, азот, аргон, көмірқышқыл газы.
Жанғыш жарық немесе оттегі ұштастыра жарылуы: метан, аммиак, сутегі, ацетилен, пропан, бутан, көміртегі тотығы, этан, этилен. Олардың көпшілігі тек газ қоспасының белгілі бір жағдайларда жағу сипатталады. Бұл сипат, газ арқасында - отын түрі, ең көп таралған бүгін. Бұл метан, пропан, бутан сияқты пайдаланылады.
-
Газдардың физикалық және химиялық қасиеттері қандай?
Сутек газының физикалық қасиеті-Сутек газ күйіндегі зат, бірақ бұл газды -2530 С градусқа дейін салқындатсақ, сутек сұйыққа айналады. Сутек суда нашар ериді, 100 көлем суда 2 көлем сутек ериді. Сутектің иісі де, түсі де жоқ.Сутек өте жеңіл газ, мысалы ауадан 14,5 есе жеңіл. Сутектің тығыздығы 0,089 г/л.
Көмірқышқыл газының физикалық қасиеті-түссіз газ, аз концентрацияларда ауада иісі жоқ, үлкен концентрацияларда газдалған судың қышқыл иісі бар. Ауадан шамамен 1,5 есе ауыр.Көмірқышқыл газының молекуласы сызықтық, көміртегінің орталық атомының ортасынан оттегінің екі атомының орталықтарына дейінгі қашықтық 116,3 пм-78,3 °С температурада ақ қар тәрізді масса түрінде кристалданады- "құрғақ мұз". Атмосфералық қысымда құрғақ мұз ерімейді, ал буланады, сұйық күйге ауыспай, сублимация температурасы -78 °с.сұйық көмірқышқыл газын қысымның жоғарылауы кезінде алуға болады. Осылайша, 20 °С температурада және 6 МПа (
-
Азот газының физикалық қасиеті-көлемі бойынша ауаның 78%-ын құрайды. Ол - түссіз, иіссіз, суда нашар еритін, ауадан сәл ғана жеңіл D (ауа) = 0,97,D (H2) = 14 болатын, жануды қолдамайтын, тыныс алуға жарамсыз газ. Ауадағы 1 л азот газының массасы 1,25 г. Азот -196°С-та сұйылады, -210°С-та қатады (қар тектес). 209,86 °C кезінде азот қатты күйде қарға ұқсас масса немесе үлкен қарлы ақ кристалдар түрінде өтеді. Ауамен жанасқан кезде одан оттегіні сіңіреді, бұл ретте азотта оттегі ерітіндісін түзе отырып, ерітіледі.Қатты азоттың үш кристалды модификациялары белгілі. 3.гексагональды тығыз қаптамасы бар β — N2 фазасы бар, p63/mmc кеңістіктік тобы, тор параметрлері a=3,93 Å и c=6,50 Å. 36,61 К-ден төмен температурада pa3 немесе P213 кеңістіктік тобы және A=5,660 Å периоды бар α-N2 текше торлы фазасы бар. 3500 атмосферадан астам қысым мен 83 K төмен температура астында γ-N2 гексагоналды фаза түзіледі.
Химиялық қасиеттерін қарастырсақ:
-
Сутектің химиялық қасиеттері-сутек оттегіде жаңғанда көп мөлшерде жылу бөлінеді:
2H2 + O2 = 2H2O + 572 кДж
Соңдықтан бұны ғарышқа ұшатын ракеталарда ппайдалынады. Бірақ сутекті алу тым қымбатқа түсетіндіктен, сутегі күнделікті өмірде көліктерге арналған жанармай ретінде кең қолданылмай тұр. Қолданса барлық көліктер бірден экологиялық таза болар еді, өйткені сутегі жаңғанда су ғана түзіледі.
Сутек күкірпен әрекеттеседі: H2 + S = H2S
Пайда болған зат күкіртсутек деп аталады, бұл газ күйіндегі зат, мұнаймен бірге кездесетін зат.Ал жалпы сутек бейметаллдармен әрекеттесіп газдарды, ал металлдармен әрекеттесіп гидридттерді түзеді. Мысалы натрий металымен әрекеттесуі: 2Na + H2 = 2NaH
-
Көмірқышқыл газы мен қысқаша миялық қасиеттері. су әлсіз көмір қышқылының қалыптастыру байланыста. Ол сутегі қалыптастыру карбонат немесе бикарбонат болып катиондар мен аниондардың ішіне диссоциирует дерлік кейін бірден. Алынған қосылу белсенді металдар, оксидтердің, сондай-ақ сілтілік бар өзара ұшырамаған.
-
N2-суда, органикалық еріткіште ерімейді. N=N болғандықтан өте берік, жанбайды және жануды қолдамайды. Li +N2 →Li3N бөлме температурасында тек литий нитриді алынады. Ме (активті металл) + N2 ® нитрид , реакция тек қыздырғанда жүреді.
Қорытынды
Газдар бұл агрегаттық күйлері әлсіз және дисперсті, сонымен бірге оларды басқаратын қысым мен температура жағдайларына өте тәуелді заттар немесе қосылыстар. Олар бүкіл әлемдегі заттардың плазмадан кейінгі ең көп таралған түрі болуы мүмкін.Жер бетінде газдар экзосферадан тропосфераға және біз тыныс алатын ауаға дейінгі атмосфераның қабаттарын құрайды. Газ аспан сияқты үлкен кеңістіктерге шашылған кезде көрінбейтін болса да, оны бұлттардың қозғалуы, диірмен қалақтарының бұрылыстары немесе салқын климатта аузымыздан шыққан булар анықтайды
.Газдар қай жерде байқалса, олар химиялық реакция болғандығын білдіреді, егер олар тікелей ауадан бекітілмесе немесе ассимиляцияланбаса, планетадағы газдардың негізгі көзі (үстірт). Температура көтерілгенде, барлық заттар (химиялық элементтер) газдарға айналады, соның ішінде темір, алтын, күміс сияқты металдар.
Пайданылған әдебиет
1.Газдардың қасиеттері. Қалпына келтірілген: chemed.chem.purdue.edu
2.Википедия. (2019). Газ. Қалпына келтірілді: en.wikipedia.org
3.Хельменстин, Анна Мари, Ph.D. (05 желтоқсан 2018). Газдар - Газдардың жалпы қасиеттері. Қалпына келтірілді: thoughtco.com
4.Электрондық салқындату редакторлары. (1 қыркүйек, 1998 жыл). Газдардың жылу өткізгіштігі. Қалпына келтірілді: electronics-cooling.com