Файл: Контрольная работа по дисциплине Химия Вариант 46 выполнил 121ингт213.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 10.11.2023
Просмотров: 23
Скачиваний: 2
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
 | МИНОБРНАУКИ РОССИИ федеральное государственное бюджетное образовательное учреждение высшего образования «Самарский государственный технический университет» (ФГБОУ ВО «СамГТУ») |
Кафедра: «Общая и неорганическая химия»
Контрольная работа по дисциплине:
«Химия»
Вариант 46
| ВЫПОЛНИЛ | 1-21ИНГТ-213 Ханмагомедов Роман Эфендиевич № зачетной книжки 21131146 |
| | (студент, курс, группа) |
| ПРОВЕРИЛ | Истомова Мария Александровна |
| | (фамилия, имя, отчество) |
| | |
Самара 2021 г.
7. Как осуществить следующие превращения: Аl → Al2O3 → Al(OH)3 → Ba(AlO2)2 → Al(NO3)3 → Na3AlO3
Решение:
1. 4Al + 3O2 = 2Al2O3
2. Al2O3 + 6HCl = 2AlCl3 + 3H2O
AlCl3 + 3NaOH = Al(OH)3 + 3NaCl
3. 2Al(OH)3 + Ba(OH)2 = Ba(AlO2)2 + 4H2O
4. Ba(AlO2)2 + 8HNO3 = Ba(NO3)2 + 2Al(NO3)3 + 4H2O
5. Al(NO3)3 + 6NaOH = Na3AlO3 + 3NaNO3 + 3H2O
30. Вычислить рН растворов, в которых концентрация ионов ОН– (в моль/л) равна: а) 210-7; б) 8,110-3.
Дано:
[ОН-]1 = 2×10-7 моль/л
[ОН-]2= 8,1×10-3 моль/л
Найти: pH1 - ?, pH2 - ?
Решение:
[Н+][ОН-] = 10-14
[Н+]1 = 10-14/2×10-7 = 5,010-8
[Н+]2
= 10-14/8,1×10-3 = 1,2310-12
рН1 = -lg[Н+] = -lg5,010-8 = 7,3
рН2 = -lg[Н+] = -lg1,07510-13 = 11,9
Ответ: рН1 = 7,3; рН2 = 11,9
52. Одно и то же количество металла соединяется с 0,2 г кислорода и с 3,173 г одного из галогенов. Определите эквивалент галогена.
Дано:
m(O2) = 0,2 г
m(Г) = 3,173 г
Найти: Мэ(Г) - ?
Решение:
Количество моль кислорода вступающего в реакцию с металлом
n(O2) = 0,2/16 = 0,0125 моль
Галогены имеют валентность (I) поэтому их расход на данную реакцию в 2 раза больше.
т.е с металлом реагирует 0,025 моль галогена
молярая масса эквивалентов = 3,173/0,025 = 126,8 моль (галоген - йод)
Ответ: 126,8 г/моль-экв
74. Рассчитайте нормальность концентрированной соляной кислоты (плотность 1,18 г/мл), содержащей 36,5 % НCl.
Дано:
ω(HCl) = 36,5 %
ρ = 1,18 г/мл
Найти: Сн - ?
Решение:
Принимаем для расчета 1 л раствора
Масса раствора составит
mр-ра = V∙ρ = 1000∙1,18 = 1180 г
Найдем массу HCl в данном растворе
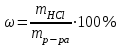 , где
, где 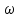 - процентная концентрация раствора
- процентная концентрация раствора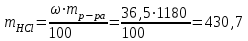 г
гМолярная концентрация эквивалента (нормальная концентрация) – это число молей эквивалентов вещества, содержащихся в одном литре раствора (моль/л).
т.е.
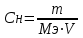
где Мэ – молярная масса эквивалента растворенного вещества
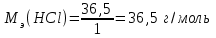
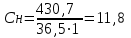 моль/л
моль/лОтвет: 11,8 моль/л
96. Рассчитать массы Ca(OH)2 и Na2CO3, необходимых для умягчения 19 м3 воды, общая жесткость которой равна Жо = 10,5 мг∙экв/л, а вмененная жесткость Жв = 3,6 мг∙экв/л. Принять во внимание, что Na2CO3 дороже Ca(OH)2.
Решение:
Сущность этого метода основана на том, что находящиеся в воде соли жесткости (углекислые, сернокислые и хлористые соли кальция и магния) под действием извести и кальцинированной соды превращаются в нерастворимые в воде соединения кальция и магния и выпадают в осадок. Известь и соду прибавляют к воде в виде растворов.
Временную (карбонатную) жёсткость устраняют добавлением раствора извести Са(ОН)2
Са(НСО3)2 + Са(ОН)2 2CaCO3 + 2H2O
Mg(НСО3)2 + 2Са(ОН)2 Mg(OH)2 + 2CaCO3+ 2H2O
Постоянную (некарбонатную) жёсткость устраняют добавлением соды Na2CO3.
CaCl2 + Na2CO3 CaCO3 + 2NaCl
MgSO4 + Na2CO3 MgCO3 + Na2SO4
Ж0 = m(Ca(OH)2)/[Mэ(Ca(OH)2)V]
Жп = m(Na2CO3)/[Mэ(Na2CO3)V]
Mэ(Ca(OH)2) – эквивалентная масса Ca(OH)2
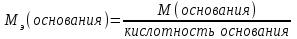
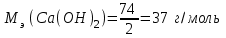
Mэ(Na2CO3) – эквивалентная масса Na2CO3
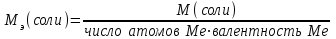
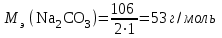
Учитывая, то что Na2CO3 дороже Ca(OH)2 сначала следует провести обработку Ca(OH)2.
m(Ca(OH)2) = ЖВр ∙ [Mэ(Ca(OH)2)V] = 3,6∙37∙19000 = 2530800 г
m(Na2CO3) = (Ж0-ЖВр)∙ [Mэ(Na2CO3)V] = (10,5-3,6)∙53∙19000 = 6948300 г
118. Никелевый и кобальтовый электроды опущены соответственно в растворы Ni(NO3)2 и Co(NO3)2. В каком соотношении должна быть концентрация ионов этих металлов, чтобы потенциалы обоих электродов были одинаковыми?
Решение:
Определяем электродные потенциалы электродов по формуле Нернста
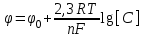 где φо– стандартный электродный потенциал; n – число электронов, принимающих участие в процессе; с– концентрация ионов в растворе, моль/л, R = 8,31кДж/моль – газовая постоянная, Т = 273+25 = 298К, F = 96500Кл/моль – постоянная Фарадея.
где φо– стандартный электродный потенциал; n – число электронов, принимающих участие в процессе; с– концентрация ионов в растворе, моль/л, R = 8,31кДж/моль – газовая постоянная, Т = 273+25 = 298К, F = 96500Кл/моль – постоянная Фарадея.Для Ni/Ni2+
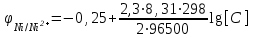
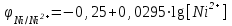
Для Co/Co2+
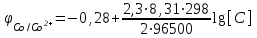
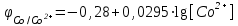
Примем концентрацию раствора соли никеля [Ni2+] = 1моль/л, тогда
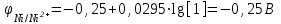
По условию
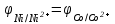 , тогда
, тогда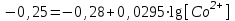
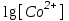 = 0,932
= 0,932[Co2+] = 100,932 = 8,55 моль/л
[Ni2+] / [Co2+] = 1/8,55 ≈ 0,117
Ответ: [Ni2+] : [Со2+] 0,117
140. Составьте электронные уравнения процессов, происходящих на электродах при электролизе водного раствора гидроксида калия и расплава гидроксида калия.
Решение:
Электролиз раствора KOH:
K: 2H2O + 2e → H2 + 2OH-
A: 2H2O - 4e → O2 + 4H+
Суммарно: 2H2O → 2H2 + O2
расплав на катоде
K: К+ + 1е → К
A: 4ОН- + 4е → 2Н2О + О2
Суммарно: 4КОН → 4К + 2H2О + O2
151. В контакте с цинком или железом в растворе серной кислоты коррозия магния будет происходить сильнее. Почему? Дать схему процесса коррозии.
Решение:
При контакте двух металлов, отличающихся по активности, в присутствии электролита возникает короткозамкнутый гальванический элемент.
Чем больше разность потенциалов у металлов, образующих коррозионную пару, тем интенсивнее протекает разрушение одного из них, выступающего анодом.
Выписываем стандартные электродные потенциалы цинка и металлов предложенных в задании:
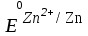 = -0,76 В
= -0,76 В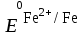 = – 0,44 В
= – 0,44 В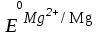 = -2,36 В
= -2,36 ВВ контакте со всеми из этих металлов магний будет являться анодом, т.к. обладает наименьшим электродным потенциалом. Наибольшая разность электродных потенциалов наблюдается в контакте с висмутом, соответственно наиболее активно цинк будет корродировать в контакте с висмутом.
Рассмотрим гальванопары магния с предложенными металлами
Гальванопара магний – цинк в кислой среде.
Схема гальванопары: Ni / Н+ / Zn
Потенциалы:
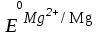
= -2,36 В;
 = -0,76 В;
= -0,76 В; 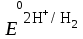 = 0 В.
= 0 В.Восстановитель – Mg, окислитель – Н+.
 Анод Mg (–): 1 Mg – 2ē = Mg2+ - процесс окисления
Анод Mg (–): 1 Mg – 2ē = Mg2+ - процесс окисленияКатод Zn (+): 1 2H+ + 2ē = H2 - процесс восстановления
2 Mg + 2H+ = Zn2+ + H2
Гальванопара магний – железо в кислой среде.
Схема гальванопары: Mg / Н+ / Fe
Потенциалы:
 = -2,36 В;
= -2,36 В;  = – 0,44 В
= – 0,44 В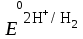 = 0 В.
= 0 В.Восстановитель – Zn, окислитель – Н+.
 Анод Mg (–): 1 Mg – 2ē = Mg 2+ - процесс окисления
Анод Mg (–): 1 Mg – 2ē = Mg 2+ - процесс окисленияКатод Fe (+): 1 2H+ + 2ē = H2 - процесс восстановления
2 Mg + 2H+ = Mg2+ + H2