Файл: Контрольная работа по дисциплине Химия Вопросы 3, 5, 16, 18, 24, 29, 32, 36, 40, 44.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 10.11.2023
Просмотров: 52
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Федеральное государственное автономное образовательное
учреждение высшего образования
«ОМСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ»
кафедра «Химия»
КОНТРОЛЬНАЯ РАБОТА
по дисциплине
«Химия»
Вопросы № 3, 5, 16, 18, 24, 29, 32, 36, 40, 44
Выполнил: ____________________
Группа: __________
1_курс
Номер зачетной книжки: №______
Проверил: ____________________
Омск
Содержание:
3. Периодическая система химических элементов Д.И. Менделеева.
5. Природа сил химического взаимодействия.
16. Окислительно-восстановительный эквивалент.
18. Термохимические законы.
24. Факторы, влияющие на скорость химической реакции.
29. Водные растворы. Способы выражения состава растворов.
32. Сильные и слабые электролиты.
36. Перегонка жидких смесей. Ректификация
40. Ряд стандартных электродных потенциалов
44. Законы Фарадея.
3. Периодическая система химических элементов Д.И. Менделеева.
Периодический закон и Периодическая система химических элементов Д. И. Менделеева – основа современной химии. Они относятся к таким научным закономерностям, которые отражают явления, реально существующие в природе, и поэтому никогда не потеряют своего значения.
Их открытие было подготовлено всем ходом истории развития химии, однако потребовалась гениальность Д. И. Менделеева, его дар научного предвидения, чтобы эти закономерности были сформулированы и графически представлены в виде таблицы.
На основе Периодического закона (свойства элементов периодически изменяются в соответствии с их атомным весом (зарядом ядра)) Д.И. Менделеев создал периодическую систему химических элементов, которая состояла из 7 периодов и 8 групп (короткопериодный вариант таблицы). В настоящее время чаще используется длиннопериодный вариант Периодической системы (7 периодов, 8 групп, отдельно показаны элементы - лантаноиды и актиноиды).
Периоды - это горизонтальные ряды таблицы, они подразделяются на малые и большие. В малых периодах находится 2 элемента (1-й период) или 8 элементов (2-й, 3-й периоды), в больших периодах - 18 элементов (4-й, 5-й периоды) или 32 элемента (6-й, 7-й период). Каждый период начинается с типичного металла, а заканчивается неметаллом (галогеном) и благородным газом.
Группы - это вертикальные последовательности элементов, они нумеруется римской цифрой от I до VIII и русскими буквами А и Б. Короткопериодный вариант Периодической системы включал подгруппы элементов (главную и побочную).
Подгруппа - это совокупность элементов, являющихся безусловными химическими аналогами; часто элементы подгруппы обладают высшей степенью окисления, отвечающей номеру группы.
В А-группах химические свойства элементов могут меняться в широком диапазоне от неметаллических к металлическим (например, в главной подгруппе V группы азот - неметалл, а висмут - металл).
В Периодической системе типичные металлы расположены в IА группе (Li-Fr), IIА (Mg-Ra) и IIIА (In, Tl). Неметаллы расположены в группах VIIА (F-Al), VIА (O-Te), VА (N-As), IVА (C, Si) и IIIА (B). Некоторые элементы А-групп (бериллий Ве, алюминий Al, германий Ge, сурьма Sb, полоний Po и другие), а также многие элементы Б-групп проявляют и металлические, и неметаллические свойства (явление амфотерности).
Для некоторых групп применяют групповые названия: IА (Li-Fr) - щелочные металлы, IIА (Ca-Ra) - щелочноземельные металлы, VIА (O-Po) - халькогены, VIIА (F-At) -галогены, VIIIА (He-Rn) - благородные газы. Форма Периодической системы, которую предложил Д.И. Менделеева, называлась короткопериодной или классической. В настоящее время больше используется другая форма Периодической системы - длиннопериодная.
Периодический закон Д.И. Менделеева и Периодическая система химических элементов стали основой современной химии. Относительные атомные массы приведены по Международной таблице 1983 года. Для элементов 104-108 в квадратных скобках приведены массовые числа наиболее долгоживущих изотопов. Названия и символы элементов, приведенные в круглых скобках, не являются общепринятыми.
Изменение характеристик элементов в периодах слева направо (главная подгруппа):
· заряд ядер атомов увеличивается;
· радиус атомов уменьшается;
· электроотрицательность элементов увеличивается;
· количество валентных электронов увеличивается от 1 до 8 (равно номеру группы);
· высшая степень окисления увеличивается (равна номеру группы);
· число электронных слоев атомов не изменяется;
· металлические свойства уменьшается;
· неметаллические свойства элементов увеличивается;
· основные свойства гидроксидов постепенно ослабевают, кислотные усиливаются.
Изменение характеристик элементов в группе сверху вниз (главная подгруппа):
· заряд ядер атомов увеличивается;
· радиус атомов увеличивается;
· число энергетических уровней (электронных слоев) атомов; увеличивается (равно номеру периода);
· число электронов на внешнем слое атомов одинаково (равно номеру группы);
· прочность связи электронов внешнего слоя с ядром уменьшается;
· электроотрицательность уменьшается;
· металличность элементов увеличивается;
· неметалличность элементов уменьшается;
· основные свойства гидроксидов элементов усиливаются, кислотные ослабевают.
Элементы, которые находятся в одной подгруппе, являются элементами-аналогами, т.к. они имеют некоторые общие свойства (одинаковую высшую валентность, одинаковые формы оксидов и гидроксидов и др.). Эти общие свойства объясняются строением внешнего электронного слоя.
5. Природа сил химического взаимодействия.
Мельчайшей частицей вещества является молекула, образующаяся в результате взаимодействия атомов, между которыми действуют химические связи или химическая связь. Учение о химической связи составляет основу теоретической химии. Химическая связь возникает при взаимодействии двух (иногда более) атомов. Образование связи происходит с выделением энергии.
Химическая связь – это взаимодействие, которое связывает отдельные атомы в молекулы, ионы, кристаллы.
Химическая связь по своей природе едина: она имеет электростатическое происхождение. Но в разнообразных химических соединениях химическая связь бывает различного типа; наиболее важные типы химической связи – это ковалентная (неполярная, полярная), ионная, металлическая. Разновидностями этих типов связи являются донорно-акцепторная, водородная и др. Между атомами металлов возникает металлическая связь.
Химическая связь, осуществляемая за счет образования общей, или поделенной, пары или нескольких пар электронов, называется ковалентной. В образование одной общей пары электронов каждый атом вносит по одному электрону, т.е. участвует «в равной доле» (Льюис, 1916 г.). Ниже приведены схемы образования химических связей в молекулах H2, F2, NH3 и CH4. Электроны, принадлежащие различным атомам, обозначены различными символами.
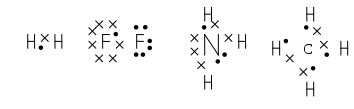
В результате образования химических связей каждый из атомов в молекуле имеет устойчивую двух- и восьмиэлектронную конфигурацию.
При возникновении ковалентной связи происходит перекрывание электронных облаков атомов с образованием молекулярного электронного облака, сопровождающееся выигрышем энергии. Молекулярное электронное облако располагается между центрами обоих ядер и обладает повышенной электронной плотностью по сравнению с плотностью атомного электронного облака.

Осуществление ковалентной связи возможно лишь в случае антипараллельных спинов неспаренных электронов, принадлежащих различным атомам. При параллельных спинах электронов атомы не притягиваются, а отталкиваются: ковалентная связь не осуществляется. Метод описания химической связи, образование которой связано с общей электронной парой, называется методом валентных связей (МВС).
Основные положения МВС
-
Ковалентная химическая связь образуется двумя электронами с противоположно направленными спинами, причем эта электронная пара принадлежит двум атомам. -
Ковалентная связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака.
Химическая связь, возникающая за счет перехода электронов от атома к атому, называется ионной, а соответствующие молекулы химических соединений – ионными. Для ионных соединений в твердом состоянии характерна ионная кристаллическая решетка. В расплавленном и растворенном состоянии они проводят электрический ток, обладают высокой температурой плавления и кипения и значительным дипольным моментом.
Если рассматривать соединения элементов какого-либо периода с одним и тем же элементом, то по мере передвижения от начала к концу периода преимущественно ионный характер связи сменяется на ковалентный. Например, у фторидов 2-го периода LiF, BeF2, CF4, NF3, OF2, F2 степень ионности связи от фторида лития постепенно ослабевает и заменяется типично ковалентной связью в молекуле фтора.
Таким образом, природа химической связи едина: принципиального различия в механизме возникновения ковалентной полярной и ионной связей нет. Эти виды связи отличаются лишь степенью поляризации электронного облака молекулы. Возникающие молекулы отличаются длинами диполей и величинами постоянных дипольных моментов. В химии значение дипольного момента очень велико. Как правило, чем больше дипольный момент, тем выше реакционная способность молекул.
16. Окислительно-восстановительный эквивалент.
Эквивалентом называется весовое количество элемента, которое соединяется с восемью весовыми частями кислорода или с одной весовой частью водорода (точнее 1,008) или замещает их в соединениях.
Эквивалент элементов, образующих однозарядные ионы, равен атомному весу этих элементов. Элементы, обладающие Между атомным весом (А), эквивалентом (Э) и валентностью (В) существуют следующие соотношения:
Грамм-эквивалентом элемента называется количество вещества (выраженное в граммах), численно равное эквивалентному весу данного элемента.
Для нахождения окислительно-восстановительных грамм-эквивалентов необходимо грамм-молекулярный вес соединения разделить на число электронов, теряемых или приобретаемых восстановителем или окислителем (учитывая при этом среду). Например, перманганат калия в присутствии восстановителя в кислом растворе принимает 5 электронов. Его окислительно-восстановительный грамм-эквивалент в кислой среде равен:
Семивалентный марганец в концентрированном щелочном растворе принимает 1 электрон и восстанавливается до шестивалентного.
Поэтому в концентрированном щелочном растворе окислительно-восстановительный грамм-эквивалент равен:
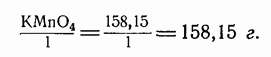
В нейтральном и слабощелочном растворе семивалентный марганец принимает 3 электрона и восстанавливается до четырехвалентного. Окислительно-восстановительный грамм-эквивалент в данном случае равен
Из приведенного примера ясно, как нужно вычислять окислительно-восстановительные эквиваленты. В большинстве случаев для этого даже нет необходимости составлять полные уравнения реакций — достаточно знать, сколько электронов в данной реакции теряет восстановитель или принимает окислитель.
Следует заметить, что одно и то же вещество может участвовать в реакциях как обменных, так и окислительно-восстановительных.
Приведем еще несколько примеров вычисления окислительновосстановительных эквивалентов для некоторых соединений.
18. Термохимические законы.
Одним из важнейших законов природы является закон сохранения энергии (первое начало термодинамики). Энергия не возникает из ничего и не исчезает, она может лишь переходить из одного вида в другой, поэтому в изолированной системе запас энергии постоянен, независимо от протекающих в ней процессов.