Файл: Литература для изучения дисциплины. Составитель доц. С. Н. Тамкович Издание подготовлено в рамках реализации.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 24.11.2023
Просмотров: 249
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
ГЛАВА 2. КИНЕТИКА ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ. ИНГИБИРОВАНИЕ
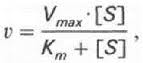
Рис. 5. Уравнение Михаэлиса — Ментен
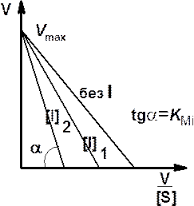
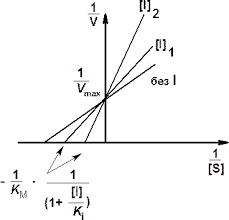
Рис. 6. Графики Лайнуивера — Берка (слева) и Иди-Хофсти (справа) в отсутствие и в присутствии конкурентного ингибитора
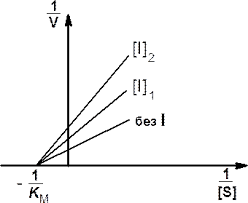
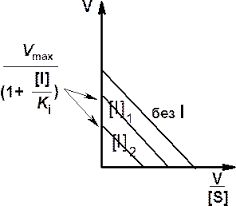
Рис. 7. Графики Лайнуивера — Берка (слева) и Иди-Хофсти (справа) в отсутствие и в присутствии неконкурентного ингибитора
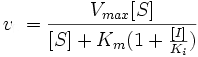

Рис. 8. Уравнение Михаэлиса — Ментен в присутствии конкурентного (слева) и неконкурентного (справа) ингибитора
ЗАДАЧИ И УПРАЖНЕНИЯ
1. Установите соответствие:
| ферменты | катализируемая реакция |
| 1) протеиназа | а) переносит электроны |
| 2) цитохром С | б) расщепляет Н2О2 |
| 3) протеинкиназа | в) фосфорилирует белок |
| 4) каталаза | г) гидролизует 1,4-гликозидные связи |
| 5) ά-амилаза | д) гидролизует пептидные связи |
2. Определите значения кинетических параметров k2 и Км гидролиза метилового эфира N-ацетил-L-валина, катализируемого альфа-химотрипсином, исходя из данных таблицы.
| [S0], М | V0 · 106, М · с-1 |
| 0,2 | 4,57 |
| 0,124 | 3,83 |
| 0,091 | 3,32 |
| 0,071 | 2,95 |
| 0,06 | 2,7 |
Условия реакции:
[E0] = 3,85 · 10-5 M;
pH = 7,8; 25 °C; 0,1 M КСl.

-
Определите значения кинетических параметров k2 и Км гидролиза метилового эфира N-бензоил-L-аминомаслянной кислоты, катализируемого альфа-химотрипсином, исходя из данных таблицы.
[S]0 ∙103, M
V0 ∙107, M∙c-1
2,24
4,28
1,49
3,56
1,12
3,11
0,9
2,74
0,75
2,43
Условия реакции: [E0] = 2,16 · 10-5 M; pH = 7,8; 25 °C; 0,1 M КСl.

| Концентрация Mg-АТФ, мкМ | 100 | 30 | 20 | 15 | 10 |
| Скорость образования продукта (о.е./мин) | 0.3 | 0.19 | 0.14 | 0.09 | 0.05 |
Фруктозо-6-фосфат + АТФ → фруктозо-1,6-дифосфат + АДФ.
Рассчитайте величину KM для АТФ исходя из приведенных ниже данных. Концентрация фруктозо-6-фосфата оставалась постоянной (1 мМ).

4. Измеряли кинетику ферментативной реакции в зависимости от концентрации субстрата в присутствии ингибитора (концентрация 10-5 М) или в его отсутствие; были получены следующие данные:
| [S]0∙10-5, M | Скорость реакции, мкмоль/мин | |
| без ингибитора | с ингибитором | |
| 0.3 | 10.4 | 4.1 |
| 0.5 | 14.5 | 6.4 |
| 1.0 | 22.5 | 11.3 |
| 3.0 | 33.8 | 22.6 |
| 9.0 | 40.5 | 33.8 |
max и KM в отсутствие ингибитора? В его присутствии?
б) Каков тип ингибирования?
в) Чему равна константа связывания ингибитора?

5. Ферменты необратимо ингибируются под действием:
а) липидов;
б) аминокислот;
в) ионов тяжелых металлов;
г) углеводов.
6. Установите соответствие:
| субстрат, определяемый с помощью ферментного электрода | фермент, входящий в состав ферментного электрода |
| 1) мочевина | а) аспарагиназа |
| 2) глюкоза | б) алкогольдегидрогеназа |
| 3) этанол | в) глюкозооксидаза |
| 4) лактат | г) лактатдегидрогеназа |
| 5) аспарагин | д) уреаза |
7. Из приведенных ниже данных для глутаматдекарбоксилазной реакции определите, является ли действие ингибитора – бромпирувата конкурентным или неконкурентным. Вычислите также величину KM для субстрата – глутаминовой кислоты – и значение kiдля фермент-ингибиторного комплекса. Определите значение Vmax.
| Концентрация глутамата, мМ | 14 | 7 | 5 | 3 | 2.3 |
| Скорость образования продукта в отсутствие бромпирувата, мкМ/мин∙102 | 62 | 55 | 45 | 37 | 32 |
| Скорость образования продукта в присутствии 20 мМ бромпирувата, мкМ/мин∙102 | 56 | 42 | 35 | 26 | 21 |

| Концентрация субстрата, мМ | 5 | 10 | 25 | 50 | 100 | |
| Скорость образования продукта в отсутствие фенилаланина, мкмоль / мин ∙ мл | 3 | 5 | 8 | 10 | 12.5 | |
| Скорость образования продукта в присутствии фенилаланина, мкмоль / мин ∙ мл | 5 мМ | 2.5 | 3.7 | 5.0 | 6.0 | 6.7 |
| 10 мМ | 1.8 | 2.3 | 2.9 | 3.1 | 3.2 | |
8. Фенилаланин ингибирует щелочную фосфатазу из кишечника крысы. Определите тип ингибирования, константу диссоциации фермент-ингибиторного комплекса kiиз приведенных далее данных.

9. Карбомоилфосфатсинтетаза катализирует следующую реакцию:
| Концентрация АТФ, мМ | 1.0 | 0.8 | 0.6 | 0.4 | 0.2 | |
| Скорость образования карбомоилфосфата в отсутствие 8-азидо-АТФ, нмоль/мин | 8.0 | 6.7 | 5.8 | 4.4 | 2.7 | |
| Скорость образования карбомоилфосфата в присутствии 8-азидо-АТФ, нмоль/мин | 0.8 мМ | 6.2 | 5.7 | 4.5 | 3.2 | 1.8 |
| 2 мМ | 4.4 | 3.7 | 2.8 | 2.2 | 1.0 | |
| 5 мМ | 3.3 | 3.3 | 2.2 | 1.8 | 0.9 | |
Рассчитайте величину KM для АТФ исходя из приведенных ниже данных. Реакцию, катализируемую карбомоилфосфатсинтетазой, ингибирует 8-азидо-АТФ. Определите характер ингибирования, kiдля фермент-ингибиторного комплекса.

10. Салицилат ингибирует каталитическое действие глутаматдегидрогеназы. Определите путем графического анализа
| Концентрация глутамата, мМ | 1.5 | 2.0 | 3.0 | 4.0 | 8.0 | 16.0 |
| Скорость образования продукта в отсутствие салицилата, мг/мин | 0.21 | 0.25 | 0.28 | 0.33 | 0.44 | 0.43 |
| Скорость образования продукта в присутствии салицилата, мг/мин | 0.08 | 0.10 | 0.12 | 0.13 | 0.16 | 0.18 |
приведенных ниже данных, является ли ингибирование конкурентным или неконкурентным. Предполагается, что концентрация салицилата составляет 40 мМ и поддерживается на постоянном уровне. Вычислите также величину KM и V max для глутамата и значение константы диссоциации ферментно-субстратного комплекса ki.

ГЛАВА 3. БИОЭНЕРГЕТИЧЕСКИЕ ПРОЦЕССЫ. ГЕНЕРИРОВАНИЕ И ХРАНЕНИЕ МЕТАБОЛИЧЕСКОЙ ЭНЕРГИИ
3.1. ОКИСЛЕНИЕ УГЛЕВОДОВ
3.1.1. ГЛИКОЛИЗ
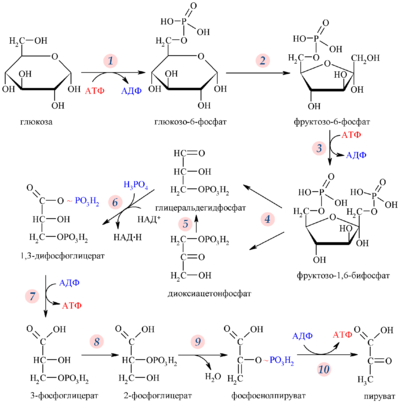
Рис. 9. Гликолиз
ЗАДАЧИ И УПРАЖНЕНИЯ
1. Установите соответствие:
| гликолиз | конечный продукт |
| 1) аэробный | а) лактат |
| 2) анаэробный | б) NADH |
| | в) пируват |
| | г) Н2О |
| | д) АТФ е) ацетилСоА ж) NAD+ |
2. В процессе гликолиза необратимыми являются реакции образования:
а) 3-фосфоглицеральдегида;
б) фруктозо-1,6-дифосфата;
в) глюкозо-6-фосфата;
г) 1,3-дифосфоглицерата;
д) пирувата;
е) фруктозо-6-фосфата.
3. Восстановление NAD+ в процессе гликолиза происходит в реакции:
а) окисления глицеральдегид-3-фосфата;
б) образования глюкозо-6-фосфата;
в) образования 3-фосфоглицерата;
г) превращения 2-фосфоглицерата;
д) образования пирувата.
4. Декарбоксилирование пирувата при спиртовом брожении требует присутствия:
а) тиаминпирофосфата;
б) NAD+;
в) биотина;
г) СоА.
5. Что является конечным продуктом гликолиза:
а) пируват;
б) пропионат;
в) лактат;
г) пируват + лактат;
д) этанол + СО2?
6. Какой из ферментов гликолиза содержит NAD+ в качестве кофермента:
а) гликогенфосфорилаза;
б) фруктозобисфосфатальдолаза;
в) D-глицеральдегидфосфатдегидрогеназа;
г) енолаза;
д) пируваткиназа?
7. Радиоактивную глюкозу, меченную углеродом 14С в положениях 3 и 4, инкубировали в анаэробных условиях в бесклеточном гомогетате печени. В каких положениях будет содержать