ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 29.11.2023
Просмотров: 29
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Федеральное государственное бюджетное образовательное
учреждение высшего образования
С

анкт-Петербургский горный университет
Кафедра общей и технической физики
Отчет
Лабораторная работа №8
По дисциплине ФИЗИКА
(наименование учебной дисциплины согласно учебному плану)
Тема: Термодинамика. Политропный процесс
Выполнил: студент группы НГД-21-10 __________ /Негинский А.Ю./
(группа) (подпись) (Ф.И.О.)
Дата:
Отметка:
Проверил: ____________ / /
(должность) (подпись) (Ф.И.О.)
Санкт-Петербург
2022
Цель работы - изучить законы идеального газа, основные положения классической теории теплоёмкости и определить показатель адиабаты методом Клемана-Дезорма.
Краткие теоретические сведения
-
Явление, изучаемое в работе – адиабатическое расширение газа -
Адиабатный процесс — это процесс, при котором отсутствует теплообмен между системой и окружающей средой.
Адиабата- график зависимости между параметрами состояния идеального газа при ∆Q=0.
Молярная теплоемкость- количество тепла, которое необходимо сообщить одному молю вещества, чтобы повысить его температуру на 1К.
Политропным называется термодинамический процесс, при котором теплоемкость тела остается постоянной.
Закон сохранения энергии в термодинамике - количество тепла Q,
подводимого к системе, идет на увеличение внутренней энергии системы U и
на совершение этой системой работы A над внешними телами: Q=U+A
Соотношение Майера:
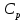 =
=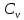 + R
+ Rгде
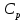 - теплоёмкость газа при постоянном давлении;
- теплоёмкость газа при постоянном давлении;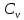 - теплоёмкость газа при постоянном объёме;
- теплоёмкость газа при постоянном объёме;R – универсальная газовая постоянная.
-
Законы и соотношения, на основании которых выведена расчётная формула:
Уравнение Пуассона:
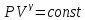 , где - коэффициент Пуассона.
, где - коэффициент Пуассона.Уравнение Менделеева-Клапейрона:
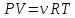 , где
, где 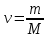 , Т – температура, P – давление, V – объем, m – масса газа,
, Т – температура, P – давление, V – объем, m – масса газа, 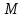 – молярная масса газа, [P] = Па, [V]= м3,
– молярная масса газа, [P] = Па, [V]= м3, 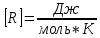 , [T] = K, [m] = кг,
, [T] = K, [m] = кг, 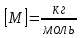
С
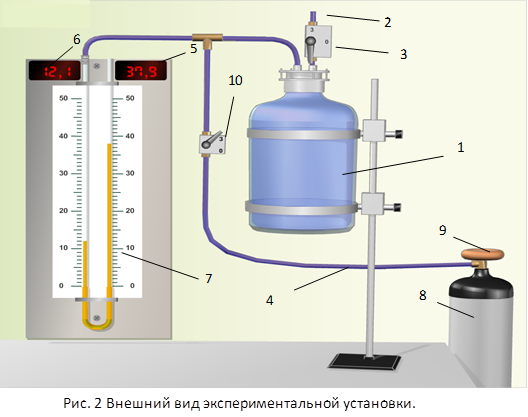 хема установки
хема установки1 – стеклянный сосуд
2,4 – магистраль
3 – выпускной кран
5,6 - цифровое табло
7 – жидкостный манометр
8 – баллон
9 – редуктор
Основные расчётные формулы
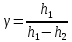 - основная расчётная формула,
- основная расчётная формула,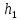 - избыточное давление, созданное накачиванием,
- избыточное давление, созданное накачиванием,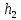 - давление, установившееся после выхода воздуха.
- давление, установившееся после выхода воздуха. Таблицы с результатами измерений и вычислений
Таблица 1
| № | Название прибора | Пределы измерений | Число делений | Цена деления | Класс точности | Абсолютная приборная погрешность |
| 1 | Манометр | 50 мм | 50 | 1 мм | 0,5 | 1 мм |
Таблица 2.
Результаты измерений и вычислений.
| Физическая величина | 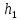 | 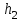 | 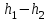 | 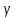 |
| Единица измерения | см | см | см | |
| 1 | 35,8 | 9,6 | 26,2 | 1,37 |
| 2 | 29,0 | 8,0 | 21,0 | 1,38 |
| 3 | 34,0 | 9,6 | 24,4 | 1,39 |
| 4 | 28,8 | 7,4 | 21,4 | 1,35 |
| 5 | 27,8 | 8,8 | 19,0 | 1,46 |
| 6 | 28,3 | 8,8 | 19,5 | 1,45 |
| 7 | 28,6 | 7,6 | 21,0 | 1,36 |
| 8 | 28,4 | 8,2 | 20,2 | 1,41 |
| 9 | 28,2 | 8,4 | 19,8 | 1,42 |
| 10 | 28,2 | 8,0 | 20,2 | 1,40 |
Формула для расчёта погрешности косвенных измерений
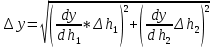 Среднее значение коэффициента Пуассона:
Среднее значение коэффициента Пуассона: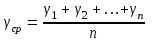 , где n – количество измерений
, где n – количество измеренийПогрешности прямых измерений
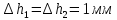
Примеры вычислений
Вычисление физических величин:
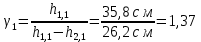
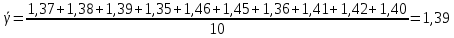
Вычисление погрешности косвенных измерений:
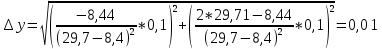
Теоретическое значение коэффициент Пуассона: γ =1,40
Окончательное значение:
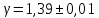
Вывод
Можно утверждать, что измерения в рамках данного эксперимента проведены с относительной точностью, потому что значение коэффициента Пуассона, равное, которое получилось в итоге выполнения самостоятельной работы
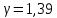 приблизительно соответствует теоретическому значению, равному
приблизительно соответствует теоретическому значению, равному 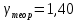 .
.