Файл: Решение По методу валентных связей пространственная конфигурация частицы определяется пространственным распределением гибридных орбиталей вокруг центрального атома..docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 07.12.2023
Просмотров: 246
Скачиваний: 16
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Задачи 109—151 (табл. 1.10). Объясните экспериментально установленное
строение молекулы или иона, используя метод валентных связей. Укажите
тип гибридизации орбиталей центрального атома, изобразите перекрывание
орбиталей и определите, полярна ли эта частица.
| № п/п | Частица | Геометрическая форма частицы | Валентные углы, град |
| 134 | HOF | Тригональная пирамида | H-O-F 97 |
Решение:
По методу валентных связей пространственная конфигурация частицы определяется пространственным распределением гибридных орбиталей вокруг центрального атома. В молекуле HOF - центральный атом кислорода образует две связи с водородом и фтором. Число электронов, участвующих в образовании связей, можно определить из электронного строения атомов. Атом водорода имеет один неспаренный электрон, который образует ковалентную полярную связь с одним из неспаренным электроном кислорода, второй неспаренный электрон кислорода образует с электроном фтора также ковалентную полярную связь. Представим схему образования ковалентных связей в молекуле:
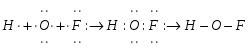
Кислород в молекуле находится в состоянии sp3 – гибридизации:
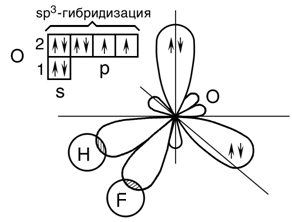
В молекуле HOF имеются две гибридные орбитали с неподеленными парами электронов и две гибридные орбитали, имеющие по одному электрону. Валентный угол между связями равен 97о при тетраэдрическом их расположении. Углы между связями отклоняются от тетраэдрического 109о29′ и прямого 90о. Это обусловлено различием сил взаимного отталкивания орбиталей, заполненных только парой электронов, и орбиталей, перекрывающихся с атомами водорода и фтора. Орбитали с парой электронов, т.е. не имеющие области перекрывания, обладают бόльшим отталкивающим эффектов по сравнению с орбиталями, образующими связь.
В молекуле HOF - две орбитали с парами электронов. Их
влияние на орбитали связи еще сильнее, и угол H-O-F уменьшается до 97о. Молекула HOF полярна, так как имеет несимметричное строение.
Задачи 83—88 (табл. 1.7). Используя метод молекулярных орбиталей, изо-
бразите энергетическую диаграмму и объясните различную длину связи в
молекулах и молекулярных ионах.
| № п/п | Молекула | Длина связи, d*1012, м | Ион | Длина связи, d*1012, м |
| 83 | Cl2 | 199 | Cl2+ | 189 |
Решение:
Процесс образования частицы Cl2 можно представить записью:
Cl[K3s22p5] + Cl[K3s22p5] →
→ Cl2+[ККσ(3s)2σ*(3s)2σ(3px)2π(3py)2π(3pz)2π*(3py)2π*(3pz)2], где уровни 1s2s2p обозначены К. Перекрывание 1s-, 2s-, 2p-атомных орбиталей приводит к заполнению σ(1s)- σ(2s)-, σ(2p)-связывающей и σ*(1s)- σ*(2s)-, σ*(2p)- разрыхляющей молекулярных орбиталей двумя электронами с антипараллельными спинами и не изменяет энергию связывающихся атомов, поэтому их можно не учитывать. В молекуле Cl2 имеется избыток двух электронов на связывающих орбиталях, что соответствует одинарной связи или порядку связи n, равному единице, который для двухатомной частицы рассчитывается по следующей формуле:
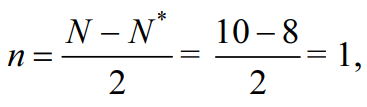
где N, N* — число электронов на связывающих и разрыхляющих орбиталях соответственно.
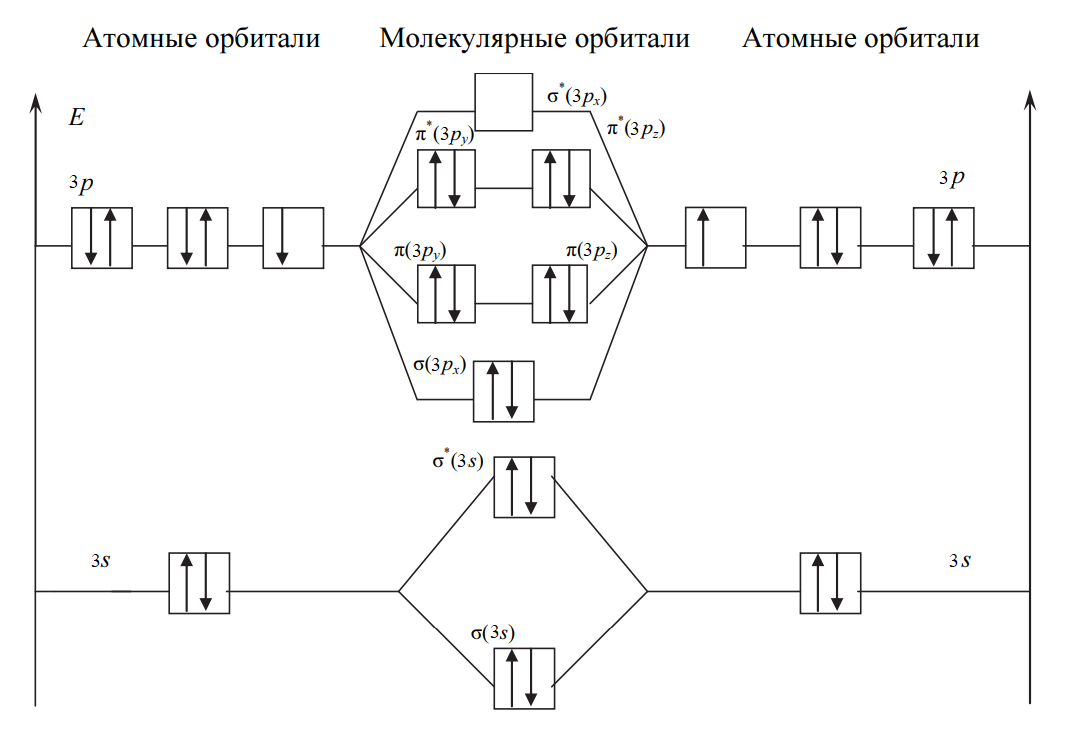
Рис. 1. Энергетическая диаграмма молекулы Cl2
Все электроны в молекуле Cl2 спарены (спины электронов на отдельных молекулярных орбиталях параллельны) и частица не обладает магнитными свойствами (диамагнитна). На рис. 1 представлена энергетическая диаграмма образования молекулы Cl2.
Процесс образования частицы Cl2+ можно представить так:
Cl[К3s23p5]+Cl+[К3s23p4] →
→Cl2+[ККσ(3s)2σ*(3s)2σ(3px)2π(3py)2π(3pz)2π*(3py)2π*(3pz)1], где уровни 1s2s2p обозначены К. В молекулярном ионе Cl2+ имеется избыток трех электронов на связывающих орбиталях, что соответствует полуторной связи или порядку связи, равному 1,5:
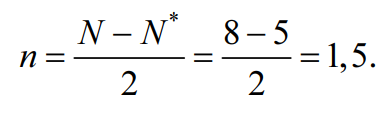
Уменьшение числа электронов на разрыхляющих орбиталях приводит к упрочнению связи и уменьшению межъядерного расстояния (длины связи), порядок связи при этом возрастает. В молекулярном ионе Cl2+ имеется один неспаренный электрон, и частица обладает магнитными свойствами (парамагнитна). На рис. 2 представлена энергетическая диаграмма образования молекулярного иона Cl2+:
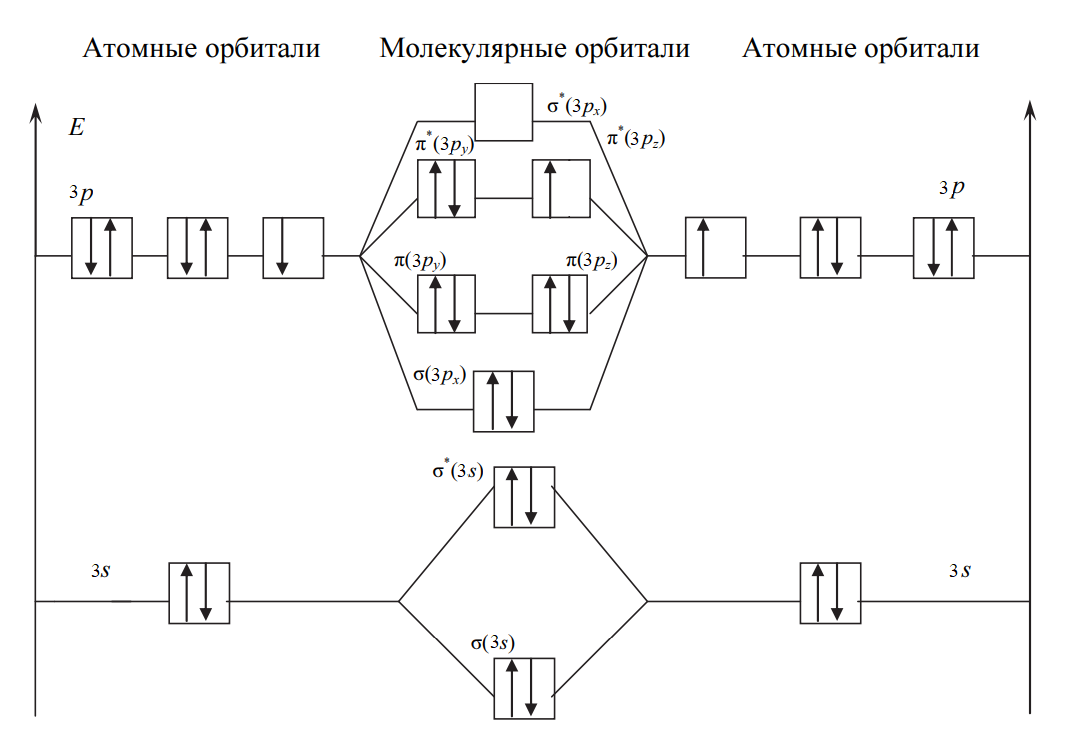
Рис. 2. Энергетическая диаграмма молекулярного иона Cl2+
Задачи 663—674 (табл. 1.43). Рассчитайте, какой объем водорода (н.у.)
выделится при действии избытка соляной кислоты на сплав массой 2 г, состав которого задан массовыми долями компонентов
| № п/п | Сплав | w1, % | w2, % |
| 664 | Sn-Mn | 45 | 55 |
Решение:
Выпишем стандартные электродные потенциалы олова, марганца и водорода в реакциях восстановления ионов:
| 2H+ + 2e = H2 | 0.00 |
| Mn2+ + 2e = Mn | -1.05 |
| Sn2+ + 2e = Sn | -0.14 |
Так как стандартные потенциалы металлов ниже, чем у водорода, металлы вступают в реакцию с разбавленной соляной кислотой с выделением водорода:
Mn + 2HCl → MnCl2 + H2
Sn + 2HCl → SnCl2 + H2
По уравнению реакции при взаимодействии кислоты с 1 моль металла выделяется 1 моль водорода. По условию задачи, если масса сплава равна 2 г, то масса марганца равна 2*55/100 = 1,1 г, тогда масса олова равна 2 – 1,1 = 0,9 г. Определим количества моль металлов:
n(Mn) = m(Mn)/M(Mn) = 1,1/55 = 0,02 моль.
n(Sn) = m(Sn)/M(Sn) = 0,9/118,7 = 0,0076 моль.
Тогда водорода образуется 0,02+0,0076 = 0,0276 моль. При нормальных условиях 1 моль любого газа занимает объем, равный 22,4 л. Тогда 0,0276 моль займет объем 0,0276*22,4 = 0,62 л.
Ответ: 0,62 л.
Задачи 31—44 (табл. 1.4). Объясните изменение первой энергии ионизации
в ряду атомов элементов. Составьте полные электронные формулы атомов
элементов, покажите распределение электронов по энергетическим ячейкам.
| № п/п | Элемент | ||
| Первая энергия ионизации, эВ | |||
| 33 | B | Al | Ga |
| 8,29 | 5,98 | 6,00 | |
Решение:
Энергией ионизации называют энергию, которую нужно затратить для отрыва электрона от атома с превращением его в положительно заряжённый ион. Первый потенциал ионизации соответствует энергии отрыва первого электрона, второй – энергии отрыва второго электрона и т.д.
В главных подгруппах радиусы атомов элементов одинаково возрастают с увеличением заряда ядра. Кроме того, увеличение числа электронных слоёв, промежуточных между ядром атома и внешними электронами, приводит к более сильному экранированию ядра, т.е. к уменьшению его эффективного заряда. Оба эти фактора (растущее удаление внешних электронов от ядра и уменьшение его эффективного заряда) приводит к ослаблению связи внешнего электрона с ядром и, следовательно, к уменьшению потенциала ионизации.
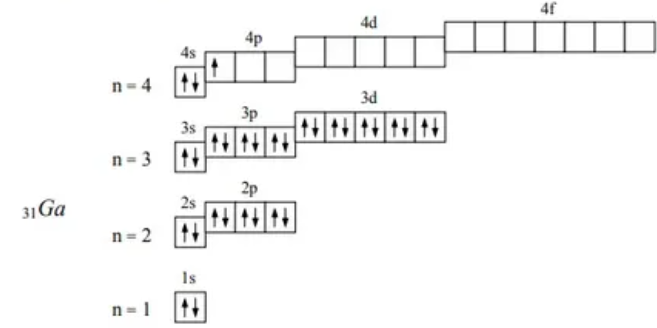
При переходе от Al к Ga радиус атома уменьшается. Это связано с тем, что у Ga заполнение р -подуровня начинается после того, как заполняется 3 d 10-подуровень. Заполнение d -оболочки сопровождается последовательным сжатием атомов, оно оказывается настолько сильным, что компенсирует возрастание радиуса при появлении четвертого энергетического уровня. В результате d -сжатия при переходе от алюминия к галлию наблюдается уменьшение атомного радиуса. Вследствие этого энергии ионизации алюминия и галлия близки по значению, и свойства соединений алюминий +3 во многом схожи со свойствами соединений галлия +3. Металлические свойства резко усиливаются при переходе от бора к алюминию, несколько ослабевают у галлия и вновь постепенно растут при переходе к таллию.
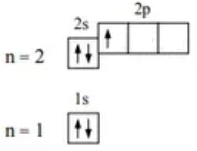
Бор:
5B 1s22s22p1
Алюминий:
13Al 1s22s2
2p63s23p1
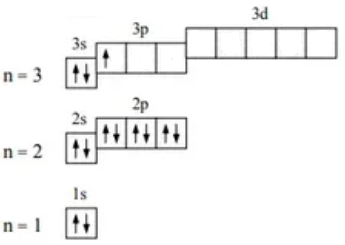
Галлий:
31Ga 1s22s22p63s23p63d104s24p1
Задачи 249—289 (табл. 1.15). Подберите коэффициенты к уравнениям
окислительно-восстановительных реакций, используя метод полуреакций;
укажите тип ОВР и сопряженные окислительно-восстановительные пары.
| № п/п | Уравнение окислительно-восстановительной реакции |
| 268 | NaClO + KI + H2SO4 → NaCl + I2 + K2SO4 + H2O |
Решение:

Реакция относится к межмолекулярным окислительно-восстановительным реакциям.