Файл: Решение Согласно условию задания нам дано v 400 мл., mв 160 г., r 1,33 гмл.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 11.12.2023
Просмотров: 32
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Решение:
Скорость реакции первого порядка характеризуется кинетическим уравнением
v=kc
Первый порядок, например, имеют реакции диссоциации или разложения молекул.
При увеличении давления в системе в 2 раза во столько же раз уменьшится объём (PV = const) и, соответственно, увеличится концентрация каждого из реагирующих газообразных веществ. Кинетическое уравнение реакции будет иметь вид:
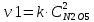 и
и 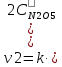
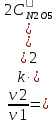
Ответ: скорость реакции увеличится в 4 раза.
11.Рассчитайте стандартную теплоту образования вещества при 298 К, если известен стандартный тепловой эффект реакции
| реакция | тепловой эффект ΔН0 реакции кДж/моль | вещество |
| Н202(ж) = Н20(ж) + 0.5 02 (г) | -98,8 | Н2О (ж) |
В результате реакции из 1 моля перекиси водорода образовалось 1 моль воды и 0.5 моль кислорода. Энтальпия образования простых веществ полагается равной нулю. Следовательно, энтальпия образования кислорода равна 0.
Составим выражение нахождения теплового эффекта для данной реакции:
ΔН = ΔН0(H2O) - ΔН0(H2O2) = -98,8 кДж/моль
Стандартная теплота образования H2O2 = -187 кДж/моль
-98,8 кДж/моль = ΔН0(H2O) – (-187 кДж/моль)
ΔН0(H2O) = -98,8 кДж/моль + (-187 кДж/моль) = -285,8 кДж/моль
Ответ: Стандартная теплота образования жидкой воды равна -285,8 кДж/моль
12.Рассчитайте, сколько тепла выделится (поглотится) при проведении химической реакции, если взято определенное количество данного вещества.
| реакция | тепловой эффект реакции кДж/моль | вещество | вес г |
| С2Н2(г) + Н2(г) = С2Н4(г) | -168,5 | С2Н2(г) | 20 |
Решение:
-
Определим количество вещества:
М(С2Н2) = 12*2+2 = 26 г/моль
ν =
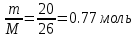
-
ΔН = ΔН0(С2Н4) - ΔН0(С2Н2) = -168,5 кДж/моль
ΔН0(С2Н2) = ΔН0(С2Н4) +168,5 кДж/моль = 52,3+168,5 = 220,8 кДж/моль
-
Количество тепла:
Q = ν· ΔН0(С2Н2) = 0.77·220,8 = 170 кДж.
Ответ: поглощается 170 кДж тепла.
13.Рассчитайте изменение стандартной энтропии системы при протекании химических реакций. 4НСl(г) + О2(г) = 2Н2О(Г) + 2С12(г)
Решение:
ΔS = 2·ΔS0(H2O)+ 2·ΔS0(Сl2) - 4·ΔS0(HCl) - ΔS0(O2) =
= 2·234,4 + 2·222,9 - 4·186,7 - 205 = -37,2
Ответ: ΔS = -37,2.
14.Вычислить тепловой эффект реакций СО(г) + 0.5 О2(г) = СО2(г)
Решение:
Вычислим тепловой эффект реакции при температуре 298 К
ΔН = ΔН0(СO2) - ΔН0(СO) = -393,5 - (-110,5) = -283 кДж/моль
Ответ: ΔН = - 283 кДж/моль.
15.Определите степень окисления и координационное число комплексообразователя в указанных комплексных соединениях. Привести названия соединений. K2[Cd(CN)4]
Решение:
K2[Cd(CN)4] – тетрацианокадмат калия.
Комплексообразователь – кадмий Cd.
Координационное число равно 4, поскольку комплексообразователь в данном соединении координирует количество лигандов равное 4.
В данном случае лиганды – это ионы CN.
Поскольку внешняя сфера в данном случае образована двумя ионами К+ то степень окисления комплекса равна -2: [Cd(CN)4]2-
16.Определить тип гибридизации комплексообразователя. Использовать метод валентных связей. K2[PtCl6]
Решение:
Комплексообразователь – платина Pt имеет координационное число 6 и заряд центрального атома +4.
Электронная формула платины:
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s14f145d9
Согласно методу ВС: Свободные (вакантные) орбитали центрального атома, участвующие в образовании координационных связей, гибридизированы и гибридные орбитали имеют вполне определенное направление в пространстве, то есть тип гибридизации вакантных орбиталей центрального атома определяет как число координированных лигандов
, так и пространственную конфигурацию комплекса.
Соответствующее число орбиталей и тип гибридизации для платины: d2sp3 .
17.Составить уравнения электролитической диссоциации комплексных соединений. Указать заряд катиона и аниона. K2[PdBr4]
Решение:
K2[PdBr4] ↔ 2K+ + PdBr42-
18.Написать координационные формулы следующих комплексных соединений и привести их названия. 3NaF AlF3
Решение:
3NaF AlF3 - Гексафтороалюминат натрия (Криолит).
Координационная формула: Na3[AlF6]
19.Определить величину и знак заряда комплексного иона и составить выражение его константы нестойкости. [Co3+( NH3)5Cl]
Решение:
Заряд комплексного иона: +3+5*0+1*(-1) = +2
Получаем ион [Co3+(NH3)5Cl]2+, который диссоциирует на:
[Co(NH3)5Cl]2+ ↔ Со3+ + 5NH3 + Cl-
Константа нестойкости:
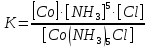
20.Пользуясь методом МО, определить, возможно ли образование молекулы: Ne2
Решение:
В двухатомной молекуле неона 2 × 8 = 16 электронов попарно заполняют все восемь МО. Поскольку среди последних равное количество связывающих и разрыхляющих орбиталей, порядок связи равен нулю и в стационарном состоянии молекула неона неустойчива. Следовательно, образование молекулы Ne2 невозможно.
21.Показать строение молекулы по методу МО, определить порядок связи, предсказать её магнитные свойства: Li2
Два валентных электрона двух атомов Li (2s1) в стационарном состоянии занимают наинизшую по энергии МО и электронная формула молекулы имеет вид:(σ2s)2. Поскольку на связывающей МО находятся два электрона, а на разрыхляющей МО электронов нет, то порядок связи в молекуле равен 1. Наличие внутренних 1s-электронов обуславливает и существенное понижение энергии связи в молекуле Li2 по сравнению с молекулой водорода.
22.Показать строение молекулы по методу ВС. Определить тип гибридизации валентных орбиталей: MgO
Решение:
Согласно методу валентных связей, связь между атомами А и В образуется с помощью общей пары электронов. Изобразим электронные схемы атомов магния и кислорода.
Электронная формула магния:
1s 22s 22p 63s 2
Электронная формула кислорода: 1s 22s 22p 4
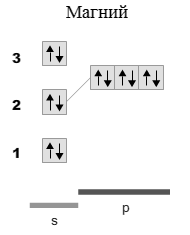
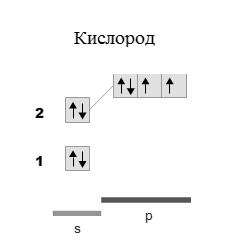
Поскольку в молекуле кислорода на 2p орбитали присутствует 2 неспаренных электрона, то образование молекулы MgO происходит при смешивании одной 3s-орбитали магния и одной 2p-орбитали кислорода, следовательно, тип гибридизации sp.
23.По методу ВС определить количество
Решение:
Согласно методу ВС кратность связи определяется количеством электронных пар, связывающих два атома. При образовании молекулы MgO образуется одна двойная связь, следовательно образуется одна сигма-связь и одна
24.Сколько электронов находится на разрыхляющих МО в молекуле: B2
Решение:
Электронная формула двухатомной молекулы бора:
(σ2s)2 (σ*2s)2 (π2рy)1(π2рz)1. В соответствии с правилом Хунда две верхние вырожденные МО π2р заполняются по одному электрону с одинаковым
направлением спинов.
Количество электронов на разрыхляющих МО равно 2. Порядок связи равен: ½(4 – 2) = 1.
25.Составить электронные формулы и электронные схемы следующих атомов. Определить к какому типу (s, р, d, f) элементов относится каждый из них: Sr
Решение:
Электронная формула стронция:
1s22s22p63s23p64s23d104p65s2
Электронная схема атома стронция:
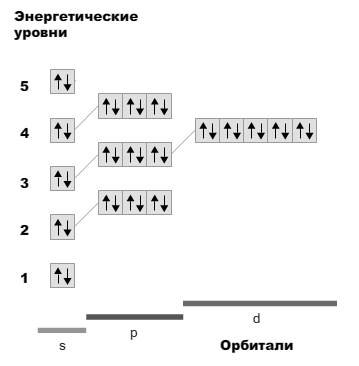
26.Составить электронные формулы и электронные схемы ионов: Fe+2
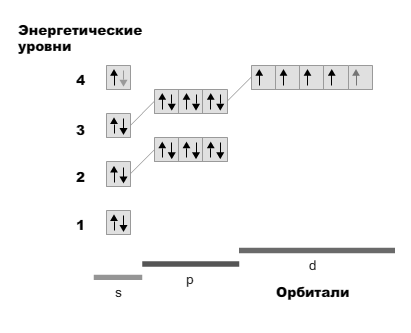
Электронная формула железа Fe:
1s22s22p63s23p64s23d6
Следовательно, электронная формула иона железа Fe+2:
1s 22s 22p 63s 23p64s 13d5
Поскольку на d уровне не может быть 4 электрона, то один электрон «проваливается» с уровня s1.
Электронная схема иона железа:
27.Определить число неспаренных электронов для атомов элементов: Ва
Барий — элемент главной подгруппы второй группы, шестого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 56. Электронная формула:
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s2
Электронная схема атома бария:
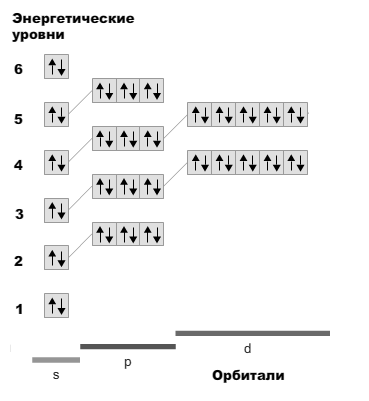
Как видно из его электронной конфигурации, барий не имеет неспаренных электронов в невозбужденном состоянии.
28.Определить, какому элементу соответствует окончание электронной формулы: 4d15s2
Решение:
Этот элемент Иттрий Y. Его электронная формула:
1s 22s 22p 63s 23p64s 23d104p65s24d1
29.Определить, с атомов каких элементов начинают формироваться указанные ниже подуровни: 4f
Решение:
4f-электрон появляется в атоме церия Ce. Его электронная формула: 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f2
30.Составить молекулярные формулы следующих солей. Написать реакции диссоциации солей, указав названия ионов: 1) гидрокарбонат кадмия (III)
2) силикат гидроксомагния.