Файл: Исследование электролитической диссоциации и реакций в растворах электролитов студент группы нтс22 Канаш Ю. М.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 11.12.2023
Просмотров: 14
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
ОТЧЕТ ПО ЛАБОРАТОРНОЙ РАБОТЕ
Исследование электролитической диссоциации и реакций в растворах электролитов
Выполнил: студент группы НТС-22
Канаш Ю.М.
Проверил:
Цель работы: ознакомиться с практическими выводами теории электролитической диссоциации, с реакциями в растворах электролитов и научиться составлять уравнения.
Порядок выполнения работы:
Опыт 1. Образование малорастворимых оснований:
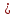 FeCl
FeCl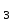 + 2KOH
+ 2KOH 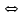 Fe (OH)3
Fe (OH)3 + KCl
+ KClбурый осадок
Fe3+ + 3OH-
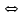 Fe(OH)3
Fe(OH)3
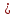 CuSO4 + 2KOH
CuSO4 + 2KOH  Cu (OH)2
Cu (OH)2 + K2SO4
+ K2SO4сине- голубой осадок
Cu2+ + 2OH-
 Cu (OH)2
Cu (OH)2
 NiSO4 + 2KOH
NiSO4 + 2KOH 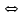 Ni (OH)2
Ni (OH)2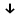 + K2SO4
+ K2SO4 светло-зелёный осадок
Ni2+ + 2OH-
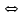 Ni (OH)2
Ni (OH)2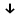
Вывод: реакция получилась, т.к. образовались малорастворимые основания и слабые электролиты.
Опыт 2.Растворение малорастворимых оснований:
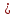 Fe (OH)3
Fe (OH)3 + 3HCl
+ 3HCl 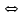 FeCl
FeCl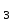
+ 3H2O
желтоватый раствор
Fe (OH)3
 + 3H+
+ 3H+  Fe3+ + 3H2O
Fe3+ + 3H2O Cu (OH)2
Cu (OH)2 + 2HCl
+ 2HCl  CuCl2 + 2 H2O
CuCl2 + 2 H2Oсветло-голубой раствор
Cu (OH)2
 + 2H+
+ 2H+  Сu2+ + 2 H2O
Сu2+ + 2 H2O Ni (OH)2
Ni (OH)2 + 2HCl
+ 2HCl  NiCl2 + 2H2O
NiCl2 + 2H2Oпрозрачный раствор
Ni (OH)2
 + 2H+
+ 2H+  Ni2+ + 2H2O
Ni2+ + 2H2OВывод: растворились в кислоте потому, что образовался ещё более слабый электролит.
Опыт 3.образование малорастворимых солей:
А
 Pb (NO3)2 + 2KJ
Pb (NO3)2 + 2KJ  PbJ2
PbJ2  + 2KNO3
+ 2KNO3жёлтый осадок
Pb2+ + 2J-
 PbJ2
PbJ2 
 3Pb(NO3)2 + 2FeCl
3Pb(NO3)2 + 2FeCl
 3PbCl2
3PbCl2 + 2Fe(NO3)3
+ 2Fe(NO3)3белый осадок
Pb2+ + 2Cl-
 3PbCl2
3PbCl2
Б
-
Na2SO4 + BaCl2 BaSO4
BaSO4 + 2NaCl
+ 2NaCl
белый осадок
Ba2+ + SO42-

BaSO4

-
Cr2(SO4)3 + 3BaCl2 3BaSO4
3BaSO4 + CrCl3
+ CrCl3
белый быстрорастворимый осадок
Ba2+ + SO42-
 Ba2SO4
Ba2SO4
Вывод: реакции идут, т.к. образуются малорастворимые в воде вещества.
Опыт 4.Изучение свойств амфотерных гидроксидов:
ZnSO4 + 2 NaOH
 Zn(OH)2
Zn(OH)2 +3Na2SO4
+3Na2SO4белый осадок
Добавляем по каплям NaOH до образования осадка.
Zn2+ + 2OH-
 Zn(OH)2
Zn(OH)2
-
Zn(OH)2 +2HCl
+2HCl  ZnCl2 +2H2O
ZnCl2 +2H2O
Zn(OH)2
 +2H+
+2H+  Zn2+ 2H2O
Zn2+ 2H2Oб) Zn(OH)2
 + 2 NaOH(в избытке)
+ 2 NaOH(в избытке)  Na2[Zn(OH)4]
Na2[Zn(OH)4]белый осадок
Zn(OH)2
 + 2OH-
+ 2OH-  [Zn(OH)4]2-
[Zn(OH)4]2--
Al2 (SO4)3 + 6NaOH 2Al(OH)3
2Al(OH)3 + 3Na2SO4
+ 3Na2SO4
белый осадок
Добавляем по каплям NaOH до образования осадка.
3Al3+ + 3OH-
 Al(OH)3
Al(OH)3
а) Al(OH)3
 + 3HCl
+ 3HCl  AlCl3 + 3 H2O
AlCl3 + 3 H2OAl(OH)3

+ 3H+
 Al3+ + 3H2O
Al3+ + 3H2Oб) Al(OH)3
 + 3NaOH (в избытке)
+ 3NaOH (в избытке)  Na3 [Al (OH)6]
Na3 [Al (OH)6]белый осадок
Al(OH)3
 + 3OH-
+ 3OH-  [Al (OH)6]3-
[Al (OH)6]3- -
Сr2 (SO4)3 + NaOH 2Сr(OH)3
2Сr(OH)3 + 3Na2SO4
+ 3Na2SO4
белый осадок
Добавляем по каплям NaOH до образования осадка.
Cr3+ + 3OH-
 Cr(OH)3
Cr(OH)3
а) Cr(OH)3
 + 3HCl
+ 3HCl  CrCl3 + 3H2O
CrCl3 + 3H2Oсветло-синий раствор
Cr(OH)3
 + 3H+
+ 3H+  Cr3+ + 3H2O
Cr3+ + 3H2Oб) Cr(OH)3
 + 3NaOH(избыток)
+ 3NaOH(избыток)  Na3[Cr(OH)6]
Na3[Cr(OH)6] зелёный раствор
Cr (OH)3
 + 3OH-
+ 3OH- [Cr(OH)6]3-
[Cr(OH)6]3- Вывод: в кислой среде амфотерный гидроксид реагирует как основание, а в щелочной как кислота.
Опыт 5.Образование малодиссоциированных соединений:
NH4Cl + NaOH
 NH4OH + NaCl
NH4OH + NaCl/ \
NH3 H2O
бесцветный раствор с запахом аммиака
NH4+ + OH-
 NH4OH
NH4OH NH3 + H2O
NH3 + H2OВывод: реакция идёт, т.к. образуется вода и выделяется газ- аммиак в результате разложения гидроксида аммония.
Опыт 6.Образование комплексов:
2 CuSO4 + 2NH4OH
 [Cu (OH)]2SO4
[Cu (OH)]2SO4 + (NH4)2SO4
+ (NH4)2SO4голубой раствор
[Cu (OH)]2SO4
 + 8NH4OH
+ 8NH4OH [Cu (NH3)4] SO4 + [Cu (NH3)4](OH)2 + 8 H2O
[Cu (NH3)4] SO4 + [Cu (NH3)4](OH)2 + 8 H2Oвасильково-синий раствор
Вывод: реакция идёт, т.к. образуется малодиссоциированное соединение – комплексные ионы в растворе.
Опыт 7.Образование газов:
Na2CO3 + H2SO4
 Na2SO4 + H2O + CO2
Na2SO4 + H2O + CO2бесцветный раствор, активное выделение газа
CO32-+2H+
 CO2 + H2O
CO2 + H2ONa2S + H2SO4
 H2S + Na2SO4
H2S + Na2SO4выпал белый осадок, появился неприятный запах тухлых яиц
S2- + 2H+
 H2S
H2SВывод: неустойчиво, т.к. образуется слабый электролит.
Вывод: В ходе лабораторной работы ознакомились с практическими выводами теории электролитической диссоциации, с реакциями в растворах малорастворимых оснований, изучили свойства амфотерных гидроксидов, образование малодиссоциированных соединений, комплексных соединений и газов.