Файл: "Современные методы дезинфекции и стерилизации стоматологических инструментов".docx
Добавлен: 11.01.2024
Просмотров: 78
Скачиваний: 6
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
КАРАГАНДИНСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ
Кафедра терапевтической стоматологии с курсом ортопедической стоматологии
На тему: "Современные методы дезинфекции и стерилизации стоматологических инструментов".
Выполнила: Ст. гр. Стом.4-008
Мусаева Ж.З.
Караганда 2014 г.
Содержание
Введение 3
Химическая дезинфекция 5
Контроль качества предстерилизационной очистки 8
Техника постановки азопирамовой, амидолириновой, фенолфталеиновой проб 9
Стерилизация 10
Контроль качества стерилизации 12
Заключение 16
Список использованной литературы 17
Введение
Одной из важнейших условий для проведении стоматологических мероприятий является обеспечение современным дезинфекционным и стерилизационным оборудованием, отвечающим установленным требованиям безопасности, качества и эффективности.
Стерилизация - уничтожение всех форм патогенных и непатогенных микроорганизмов.
Стерилизации подвергаются изделия медицинского назначения, соприкасающиеся с раневой поверхностью, кровью, с диагностическими и лекарственными препаратами, вводимыми парентерально, а также инструментарий, который при контакте со слизистыми оболочками может вызвать их повреждение.
Процесс стерилизации проводится поэтапно и включает в себя:
предварительную дезинфекцию;
предстерилизационную очистку;
собственно стерилизацию;
контроль качества стерилизации.
Перед предстерилизационной очисткой и стерилизацией дезинфекции подвергаются изделия медицинского назначения, использованные при:
гнойных операциях;
оперативных манипуляциях:
инфекционных больных;
пациентов, являющихся носителями патогенных микроорганизмов и HBs-Ag, перенесших гепатит с неуточненным диагнозом;
пациентов, относящихся к группам риска заболевания СПИДом, гепатитом;
изделия, использованные для введения живых вакцин;
все изделия при наличии эпидемиологических показаний в регионе.
стерилизация дезинфекция стоматологический инструмент
Дезинфекция - удаление или уничтожение живых возбудителей инфекционных болезней в (на) абиотических объектах окружающей среды.
Дезинфекция медицинских изделий проводится на месте их использования (в отделениях, кабинетах) с применением физических и химических агентов. Наиболее надежной принято считать физическую дезинфекцию.
Обеззараживание физическими методами представлено в трех вариантах.
1. Кипячение в дистиллированной воде в течение 30 минут или в 2,0% растворе питьевой соды (15 минут) при полном погружении предмета.
2. Обработка водяным насыщенным паром под избыточным давлением (0,5 кгс/см2) при температуре 110°С, время выдержки - 20 минут, осуществляется в паровых стерилизаторах или дезинфекционных камерах.
3. Дезинфекция сухим горячим воздухом при температуре 120°С с экспозицией 45 минут, для чего используются воздушные стерилизаторы (сухожаровые шкафы).
Химическая дезинфекция
Применяются различные химические вещества и их сочетания (дезинфектанты). Основные дезинфицирующие агенты и режимы химической дезинфекции представлены в табл. 2,3
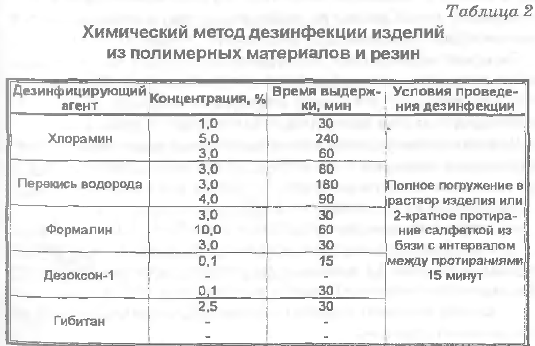

Примечание: режим дезинфекции дан в трех вариантах:
при гнойных заболеваниях, кишечных и воздушно-капельных инфекциях бактериальной и вирусной этиологии;
при туберкулезе;
при вирусных гепатитах.
Температура дезинфицирующих растворов не менее 18°С.
Предстерилизационная обработка стоматологического инструментария
Предстерилизационная очистка предназначена для удаления с изделий белковых, механических и лекарственных загрязнений с целью усиления эффекта последующей (см. табл. в разделе "Пропедевтика хирургической стоматологии").
Очистке подвергается инструментарий после его использования и предварительной дезинфекции. Ее осуществляют ручным или механизированным способом в моющих растворах. Рецептуры моющих растворов представлены в табл. 4.
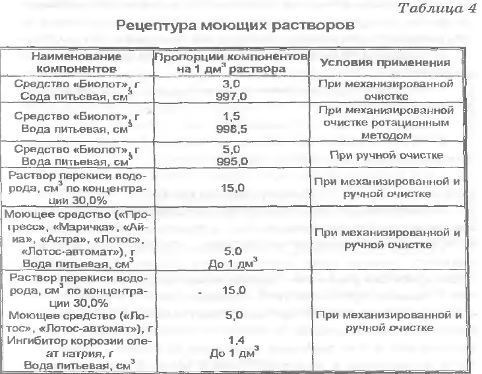
Для уменьшения коррозии металлических предметов, обрабатываемых в растворах с перекисью водорода, рекомендуется применять ингибитор коррозии - 0,14% р-р олеата натрия.
Процесс очистки включает в себя:
ополаскивание проточной водой по 30 с на предмет;
замачивание в моющем растворе при полном погружении изделия в течение 15 минут, температура раствора 50°С (если используется средство "Биолот" температура 40"С);
мойка каждого изделия в моющем растворе щеткой по 30 с каждый предмет;
ополаскивание в проточной воде 3-5 мин;
ополаскивание в дистиллированной воде 30 с;
сушка горячим воздухом при 85 "С до полного исчезновения влаги.
Пользоваться моющим раствором можно до загрязнения, о чем свидетельствует появление его розовой окраски. Раствор, содержащий "Биолот", применяют однократно. Температуру растворов в процессе очистки не поддерживают. Неизмененный раствор можно подогревать до 6 раз.
Инструменты с коррозийными пятнами и наличием оксидной пленки очищают химическим способом (не более двух раз в квартал). Для этого используется специальный состав. Уксусная кислота - 5,0 г (по 100% концентрации), хлорид натрия-1,0 г, вода дистиллированная - до 100,0 см3. В растворе изделия замачивают, а затем промывают проточной водой. Экспозиция для скальпелей из нержавеющей стали - 2 минуты, для инструментов с оксидной пленкой - 3 минуты, при сильном коррозийном поражении - 6 минут с механической очисткой ершом или ватномарлевым тампоном.
Контроль качества предстерилизационной очистки
Качество предстерилизационной очистки определяют путем постановки химических реакций на наличие:
крови и белковых загрязнений (азопирамовая и амидопириновая пробы);
остаточных количеств щелочи моющих растворов (фенолфталеиновая проба);
жира (проба с Суданом III).
Контролю качества очистки подлежит 1% изделий каждого наименования, обработанных в смену.
Азопирамовая проба
Приготовление реактива.100 г амидопирина и 1,0-1,5 г солянокислого анилина смешивают в сухой посуде, затем заливают 95% этиловым спиртом до 1,0 литра. Смесь тщательно перемешивают. Реактив готов после полного растворения компонентов. Срок хранения раствора в холодильнике в плотно закрытой емкости 2 месяца, при комнатной температуре - не более 1 месяца.
Перед постановкой пробы готовят рабочий раствор. Смешивают равные объемные количества вышеуказанного реактива (азопирам) и 3% раствора перекиси водорода. Проба должна быть поставлена в течение 30-40 минут. В противном случае возможно спонтанное окрашивание реактива.
Амидопириновая проба
Для постановки пробы необходимы: 5% раствор амидопирина (на 95% этиловом спирте), 30% раствор уксусной кислоты и 3% раствор перекиси водорода. Последние два реактива готовят на дистиллированной воде. Рабочий раствор получают путем смешивания равных количеств этих растворов.
Фенолфталеиновая проба
Применяют 1% спиртовый раствор фенолфталеина. Раствор можно использовать в течение месяца, при условии его хранения в холодильнике.
Техника постановки азопирамовой, амидолириновой, фенолфталеиновой проб
Наружные поверхности изделий протирают рабочим раствором реактива или наносят несколько капель. Для контроля очистки шприцев в них вносят 3-4 капли реагента и несколько раз продвигают поршнем. Затем реактив через 30-60 секунд вытесняют на белую марлевую салфетку.
При положительной азопирамовой пробе немедленно или не позднее 1 минуты появляется фиолетовое, затем розово-сиреневое или буроватое окрашивание реактива.
Положительная амидопириновая проба сопровождается сине-фиолетовым окрашиванием реактива. Окрашивание реактивов, наступившее позже 1 минуты, не учитывается.
Фенолфталеиновая проба считается положительной при появлении розового цвета реактива.
Проба с Суданом III
Растворяют 0,2 г измельченной краски судан III и 0,2 г метиленового синего в 70 мл подогретого до 60°С 95% этилового спирта. Затем добавляют 10 мл 20-25% раствора аммиака и 20 мл дистиллированной воды. Приготовленный раствор может храниться в плотно закрытом флаконе в холодильнике до 6 месяцев.
Реактивом смачивают поверхность изделия, которое могло быть загрязнено жирами. Через 10 секунд краситель обильно смывают водой. Появление пятен, окрашенных в желтый цвет, свидетельствует о жировом загрязнении.
Стерилизация
Стерилизацию проводят паровым, воздушным и химическим методами. Выбор метода зависит от характеристик изделий, подвергающихся стерилизации.
Паровой метод
Действующий агент - водяной насыщенный пар под избыточным давлением. Стерилизация осуществляется в паровыx стерилизаторах. Применяется один из трех режимов (табл. 5):

Рекомендуется для изделий из коррозиестойкого металла, стекла, изделий из резины, латекса и отдельных полимерных материалов.
Все изделия, простерилизованные в стерилизационных коробках без фильтров, в двойной мягкой упаковке из бязи или в пергаментной бумаге и прочих разрешенных материалах, считаются стерильными в течение 72 часов. В случаях стерилизации в коробках с фильтрами этот срок увеличивается до 20 суток. По истечении указанных сроков предметы подвергаются повторной стерилизации.
Воздушный метод
Действующий агент - сухой горячий воздух. Используются воздушные стерилизаторы. Стерилизация осуществляется в одном из двух режимов:
1. Первый: температура - 180°С, время выдержки - 60 мин.
2. Второй: температура - 160°С, время выдержки - 150 мин.
Метод рекомендуется для изделии из металла, стекла и силиконовой резины. Изделия, простерилизованные в разрешенном упаковочном материале, могут храниться, в течение 20 суток. Если стерилизация данным методом производилась без упаковки, то стерильный материал должен быть использован сразу после стерилизации.
Химический метод
Используются растворы химических веществ и специальные газы.
Перекись водорода - 6% раствор. Применяется для стерилизации предметов из полимерных материалов, резин, стекла, коррозиестойких металлов. Изделие погружается в раствор на 360 минут при температуре стерилизационного раствора 18°С. Экспозиция может укорачиваться до 180 минут, если раствор изначально подогреть до 50°С (температура в процессе стерилизации не поддерживается). Готовый раствор перекиси водорода можно хранить в закрытой емкости в темном месте 7 суток. По истечении этого срока раствор применяется после химического переконтроля на содержание активно действующего вещества.
Дезоксон-1 (1% раствор уксусной кислоты) применяется по той же технологии. Температура раствора должна быть не ниже 18°С, время выдержки - 45 минут. Раствор дезоксона-1 используется только в течение одних суток.
Пары 40% раствора формальдегида в этиловом, спирте. Стерилизацию проводят в микроанаэростатах или в дополнительно оборудованной скороварке "Минутка". Предметы упаковывают двумя слоями полиэтиленовой пленки толщиной 0,06-02 мм, пергамента и другими разрешенными упаковочными мате - риалами. Режим стерилизации: температура в камере 80°С, количество рабочего раствора - 375,0 мг/дм'!. Время выдержки для изделий из полимерных материалов - 180 минут, для изделий из металла и стекла - 120 минут. Простерилизованный материал в упаковке из полиэтиленовой пленки может храниться 5 лет. В иной упаковке стерильность сохраняется 20 суток.
Предметы из пластмасс и резин, контактирующих с кровью, подвергаются предварительной дегазации (48 часов при комнатной температуре).
Смесь ОБ (окись этилена с бромистым метилом 1: 2,5 по весу) и окись этилена - газообразные вещества. Применяемое оборудование - микроанаэростат, специально оборудованная скороварка "Минутка". Стерилизуют предметы в упаковке из двух слоев (двойные пакеты из рекомендованных материалов). Стерилизация проводится при температуре 18°С, 35°С и 55°С. Срок хранения изделий после стерилизации в полиэтиленовой пленке - 5 лет, в иной упаковке до 20 суток.
Простерилизованные предметы применяются после обязательной дегазации (газы токсичны для человека и животных; в вентилируемом помещении. Точные сроки дегазации указаны в ТУ (технические условия) для конкретных изделий.
Наибольшие трудности возникают при дезинфекции наконечников. Согласно инструкции Главного СЭУ Министерства здравоохранения РФ дезинфекция стоматологических наконечников проводится путем тщательного двукратного протирания наружных частей и канала для бора стерильным ватно-марлевым тампоном, смоченным 1 % р-ром хлорамина, 2 % р-ром лизоформина. Интервал между протираниями 15 минут. Для стерилизации наконечников используют масляные стерилизаторы.
Контроль качества стерилизации
Контроль качества стерилизации осуществляется физическим, химическими и бактериологическими методами. Физический и химический методы используются в оперативном контроле технологического цикла стерилизации, т.е. результаты учитываются в процессе стерилизации или сразу после ее окончания.
Физический метод
Метод предполагает измерение температуры, давления и времени.
Контроль температурного режима проводится с помощью максимальных термометров. Диапазон измерения от 0 до 150°С для паровых стерилизаторов, от 0 до 200°С для воздушных стерилизаторов. Упакованные термометры размещают в контрольные точки. По окончании цикла стерилизации регистрируются показания термометров, которые сопоставляются с регламентированной температурой.
Хронометраж стерилизации проводят с помощью механического секундомера или наручных механических часов.
Давление в паровом стерилизаторе измеряют мановакуум метром. Диапазон измерения 1-5 кгс/см2.
Обнаружение неудовлетворительных результатов показывает на возможные нарушения: режима стерилизации, правильности загрузки или исправности аппарата.
Химический метод
Химический контроль проводят с помощью химических тестов и термических индикаторов. Используются химические вещества, иногда в смеси с органическим красителем, изменяющие свое агрегатное состояние и цвет при определенной температуре.
Упакованные химические тесты нумеруют и размещают в паровые и воздушные стерилизаторы. Обычно индикаторные соединения запаивают в стеклянные трубочки. При равномерном расплавлении и изменении цвета теста результат считается удовлетворительным.
Для контроля работы паровых стерилизаторов применяются вещества, температура плавления которых соответствует температурному режиму работы данного аппарата:
Амидопирин (белый кристаллический порошок или кристаллы без запаха), интервал температуры плавления 104 - 107°С.
Антипирин (белый кристаллический порошок или бесцветные кристаллы без запаха), 108-111°С.
Резорцин (белый или со слабым желтоватым оттенком кристаллический порошок со слабым запахом), 105-110°.
Бензойная кислота (бесцветные игольчатые кристаллы или белый кристаллический порошок), 114-120°С.
Д (+) - Манноза (бесцветные кристаллы в виде ромбических призм), 127-131°С.
Никотинамид (белый мелкокристаллический порошок со слабым запахом), 125-131°С.
Контроль температурного режима работы воздушных стерилизаторов осуществляется тестами с другими химическими веществами:
Левомицетин (белый или с желтовато-зеленоватым оттенком кристаллический порошок), интервал температуры плавления 141 - 146°С.
Винная кислота (бесцветные кристаллы), 168-169°С.
Гидрохинон (бесцветные или светло-серые серебристые кристаллы), 164-170°С.
Тиомочевина (блестящие кристаллы), 165-171°С.
Обнаружение не оплавленного теста указывает на несоблюдение температурных параметров режима стерилизации. Стерилизацию повторяют с закладкой новых химических тестов. При повторном неудовлетворительном результате прекращают использовать стерилизатор. Проводят тщательную проверку его состояния с контролем измерительной аппаратуры.
Бактериологический метод
Метод предназначен для контроля работы стерилизаторов с помощью биотестов. Биотесты представляют собой споры бактериальных культур, помещенных в стеклянные трубки или чашечки из алюминиевой фольги.
Используют тест-культуры ВКМ В-718 и штамм С. Биотесты готовят бактериологические лаборатории в соответствии с официальной методикой. В случаях неудовлетворительного результата (рост культур) проводится анализ параметров стерилизационного цикла.
Дополнительно может применяться контроль на стерильность смывов с простерилизованного инструментария.
Наиболее частые причины негативных результатов контроля стерилизации:
неисправность аппаратуры и контрольно-измерительных приборов;
неполное удаление воздуха из рабочей камеры парового стерилизатора;
перегрузка и неправильная загрузка стерилизационной камеры;
несоблюдение параметров стерилизации;
использование нерегламентированного упаковочного материала;
нарушение режима вентиляции парового стерилизатора;
использование в химической стерилизации веществ после длительного хранения без контроля на содержание активно действующего начала.
Заключение
Уничтожение микроорганизмов химическими и физическими способами подчиняется экспоненциальному закону. Это означает, что неизбежно имеется конечная вероятность того, что микроорганизм может выжить не зависимо от степени проведенной обработки. Для конкретной обработки вероятность выживания определена количествами и типами микроорганизмов и условий их существования до и во время обработки.
Список использованной литературы
1. Терапевтическая стоматология/ Авторы: Е.В. Боровский, В.С. Иванов, Ю.М. Максимовский, Л.Н. Максимовская/ Москва "медицина" 2002г.
2. http://gooddoctor. ucoz.ru/publ/terapija_stomatologicheskaja/lekcii_konspekty/rezhimy_dezinfekcii_i_sterilizacii_v_stomatologii/25-1-0-8
3. http://www.studfiles.ru/preview/1147871/
4. http://tellcall.ru/2011-06-07-18-54-11/24-2011-06-21-13-07-40.html