Файл: Реферат по дисциплине химия по теме Окислительновостановительные реакции.docx
Добавлен: 12.01.2024
Просмотров: 109
Скачиваний: 3
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Государственное автономное профессиональное образовательное учреждение «Бавлинский аграрный колледж»
Реферат
по дисциплине: химия
по теме:
«Окислительно-востановительные реакции»
Выполнил: Студент 2 курса
596 группы Садыков.Р
Проверил преподаватель:_________
______________________
Г.Бавлы 2022
.
ОСНОВНЫЕ ПОНЯТИЯ
Степень окисления элементов и сущность окислительно-восстановительных явлений
Окислительно-восстановительные реакции имеют очень широкое распространение и являются чрезвычайно важными для обмена веществ в живых организмах, для многих промышленных процессов, связанных с получением химических веществ. Они имеют огромное значение в теории и практике.
Окислительно-восстановительные реакции - это такие реакции, которые протекают с изменением степени окисления атомов элементов, входящих в состав реагирующих веществ.
Например,
NaOH + HCl = NaCl + H2O ― реакция идет без изменения степени окисления. Такого типа реакции называются обменными.
Zn0 + HCl- = H20 + Zn2+Cl2 – реакция протекает с изменением степени окисления, следовательно, это окислительно-восстановительная реакция (ОВР).
Z
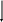 n0 - 2e Zn2+ 1 восстановитель, окисление
n0 - 2e Zn2+ 1 восстановитель, окисление2H+ + 2e H20 1 окислитель, восстановление
Сущность окислительно-восстановительных процессов состоит в переходе валентных электронов от восстановителя к окислителю. При окислительно-восстановительных реакциях одновременно протекают два взаимосвязанных процесса: окисление и восстановление.
Окисление ― это процесс отдачи электрона. Этот процесс сопровождается повышением степени окисления элемента. Вещество, отдающее электрон, называется восстановителем.
Восстановление ― это процесс присоединения электронов. Этот процесс сопровождается понижением степени окисления элемента. Вещество, принимающее электрон, является окислителем.
Состояние атома в молекуле характеризуется с помощью понятия «степени окисления».
Под степенью окисления понимают заряд атома элемента в соединении, вычисленный из предположения о том, что молекула состоит только из ионов.
Степень окисления ― понятие условное, т.к. большинство соединений не являются ионами, чаще встречаются соединения с ковалентной связью. Степень окисления ― величина переменная. Вычисление степени окисления производится на основании того, что молекула любого вещества в целом электронейтральна, т.е. алгебраическая сумма степеней окисления всех атомов в молекуле равна нулю. Степень окисления атома обозначается арабскими цифрами со знаком (+) или (–) после цифры.
В простых веществах (О2, Н2, N2) степень окисления элемента всегда равна нулю, так как в этих соединениях электронная плотность равномерно распределена между атомами в молекуле и не наблюдается одностороннего оттягивания электронных пар, участвующих в образовании химических связей. В простейших ковалентных соединениях значение положительной степени окисления элемента соответствует числу оттянутых от атома связывающих электронных пар, а величина отрицательной степени окисления ― числом притянутых электронных пар.
В соединениях некоторые элементы проявляют всегда постоянную степень окисления, но для большинства элементов она в различных соединениях различна. В каждом конкретном случае степень окисления рассчитывается по формуле соединения.
Для определения степени окисления элементов в химических соединениях следует руководствоваться следующими положениями:
1. Постоянную степень окисления имеют щелочные металлы (+1), щелочноземельные металлы (+2), фтор (-1). Для водорода в большинстве соединений характерна степень окисления 1+, а в гидридах металлов и в некоторых других соединениях она равна 1-. Кислород в соединениях проявляет главным образом степень окисления 2-, к исключениям относятся пероксидные соединения, степень окисления кислорода в которых равна 1-, и фторид кислорода OF2, в котором она равна 2+.
2. Так как молекула электронейтральна, то алгебраическая сумма степеней окисления атомов элементов с учетом состава молекулы равна нулю.
Принимая во внимание это положение, легко определить степень окисления элементов в соединении. Для этого надо знать формулу соединения и степени окисления других элементов, входящих в состав этого соединения.
Например, необходимо вычислить степень окисления серы в серной кислоте:
Н2SO4 (1+)·2 + X + (2-)·4 =0 X=6+
Находим, что степень окисления серы равна 6+.
3. Степень окисления элементов в молекулах простых веществ О2, Сl2 и т.п. равна нулю.
4. Степень окисления металлов в атомарном состоянии согласно рентгенографическим исследованиям, установившим равномерное
распределение электронной плотности в них, также равна нулю (Сг, Zn и т.п.).
5. Понятие о степени окисления является условным и не всегда характеризует настоящее состояние атомов в соединениях, но оно весьма удобно и полезно при классификации различных соединений, рассмотрении окислительно-восстановительных процессов, предсказания направления течения и продуктов химических реакций и т.д.
Составление уравнений ОВР
Для составления уравнений окислительно-восстановительных реакций обычно используют два метода:
1) метод электронного баланса,
2) электронно-ионный метод.
При расчете коэффициентов в окислительно-восстановительных реакциях пользуются правилом электронного баланса: суммарное число электронов, теряемых восстановителем, должно быть равно суммарному числу электронов, приобретаемых окислителем.
В данном руководстве мы остановимся на рассмотрении метода электронного баланса.
Метод электронного баланса
Метод электронного баланса основан на определении общего числа электронов, перемещавшихся от восстановителя к окислителю. Для составления уравнения окислительно-восстановительной реакции необходимо, прежде всего, знать химические формулы исходных веществ и получающихся продуктов. Исходные вещества нам известны, а продукты реакции устанавливаются либо экспериментально, либо на основании известных свойств элементов. Участие воды в реакции выясняется при составлении уравнения.
При составлении уравнения окислительно-восстановительной реакции необходимо соблюдать следующую логическую последовательность операций: рассмотрим реакцию взаимодействия Sb2S5 и HNO3.
1. Устанавливаем формулы веществ, получающихся в результате реакции: Sb2S5 + HNO3 = H3SbO4+NO+H2SO4 .
2. Определяем степени окисления элементов
, которые изменили ее в процессе реакции
Sb2S2-5 + HN5+O3 = H3SbO4+N2+O+H2S6+O4 .
3.Определяем изменения, происшедшие в значениях степени окисления и устанавливаем окислитель и восстановитель.
В данной реакции степень окисления атомов серы S2- повысилась с 2- до 6+; следовательно, S2- является восстановителем. А степень окисления атомов азота N5+ понизилась с 5+ до 2+; следовательно, N5+ является окислителем. На основании этого составляем схему электронного баланса реакции:
N5+ + 3e N2+ │ 40 окислитель, процесс восстановления
S2- - 40e S6+ │ 3 восстановитель, процесс окисления
Пользуясь правилом электронного баланса, определяем общее число перемещающихся электронов нахождения наименьшего кратного. В данном случае оно равно 120.
4. Находим основные коэффициенты, то есть коэффициенты при окислителе и восстановителе
3 Sb2S5 + 40 HNO3 = H3SbO4 + NO + H2SO4 .
5. Согласно закону сохранения массы расставляем коэффициенты в правой части уравнения (продукты реакции) перед окисленной и восстановленной формами:
3 Sb2S5 + 40 HNO3 = H3SbO4 + 40 NO + 15 H2SO4 .
6. Проверяем число атомов каждого элемента (кроме водорода и кислорода) в исходных веществах и продуктах реакции и подводим баланс по этим элементам, расставляя коэффициенты:
3 Sb2S5 + 40 HNO3 = 6 H3SbO4 + 40 NO + 15 H2SO4 .
7. Проверяем число атомов водорода в левой и правой частях уравнения и определяем число участвующих в реакции молекул воды
3 Sb2S5 + 40 HNO3 + 4 Н2О = H3SbO4 + 40 NO + 15 H2SO4 .
8. Проверяем сумму атомов кислорода в левой и правой частях уравнения. Если баланс по кислороду сходится, то уравнение реакции составлено правильно.
Все вышеописанные операции производятся последовательно с одним и тем же уравнением и переписывать реакцию несколько раз не имеет смысла. Уравнение реакции окисления сульфида сурьмы азотной кислотой, с учетом схемы электронного баланса, запишется следующим образом:
3 Sb2S5 + 40 HNO3 + 4 Н2О = H3SbO4 + 40 NO + 15 H
2SO4 .
| 3 | 5S2- - 40ē = 5S6+ | восстановитель (окисление) |
| 40 | N5+ + 3ē = N2+ | окислитель (восстановление) |
Особые случаи составления уравнений окислительно-восстановительных реакций
Рассмотренная методика составления окислительно-восстановительных реакций применима к большинству простых и сложных процессов. Но в некоторых специальных случаях необходимы дополнительные пояснения.
1. Если число электронов, отдаваемое восстановителем, и число электронов, присоединяемое окислителем, имеют общий наибольший делитель, то при нахождении коэффициентов оба числа делят на него. Например, в реакции
HCl7+O4 + 4S4+O2 + 4H2O = 4H2S6+O4 + HCl1-
основными коэффициентами для восстановителя и окислителя будут не 6 и 2, а 4 и 1.
Если число участвующих в реакции электронов нечетно, а в результате получается четное число атомов, то коэффициенты удваиваются. Например, в реакции
2Fe3+Cl3 + 2HJ1- = J20 + 2Fe2+Cl2 + 2HCl
основными коэффициентами будут не 1 и 1, а 2 и 2.
2. Окислитель или восстановитель иногда дополнительно расходуется на связывание получающихся продуктов (солеобразование).
Например, в реакции
Cu + 2HNO3 + 6HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
на окисление на связывание на 3 атома восстановителя Сu0 требуется для окисления 2 молекулы окислителя HNO3; кроме того, на образование нитрата меди - трех молекул - требуется еще 6 молекул HNO3 для связывания трех атомов меди. Таким образом, общий расход азотной кислоты: 2 молекулы на окисление плюс 6 молекул на связывание (солеобразование), то есть всего 8 молекул HNO3. И окончательно уравнение примет вид:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O.
З. Если в реакции число элементов, изменяющих свою степень окисления, больше двух, то устанавливают общее число электронов, отдаваемых восстановителями, и общее число электронов, присоединяемых окислителями, а в остальном соблюдается общий порядок составления уравнения реакции. Например,