ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 08.05.2019
Просмотров: 934
Скачиваний: 1
Учитывая данные о Ф. высших растений, водорослей и фотосинтезирующих бактерий, обобщенное ур-ние Ф. можно записать в виде:
А - кислород в случае высших растений и водорослей, S либо др. элементы - в бактериальном Ф.
Мол. механизм Ф. и структура фотосинтетич. аппарата.
С использованием изотопных меток показано, что источником O2 в Ф. является только вода:
Ф. пространственно и во времени разделяется на два сравнительно обособленных процесса: световую стадию окисления воды и темновую стадию восстановления CO2 (рис. 1). Обе эти стадии осуществляются у высших растений и водорослей в специализир. органеллах клетки - хлоропластах. Исключение - синезеленые водоросли (цианобактерии), у к-рых нет аппарата Ф., обособленного от цитоплазматич. мембран.
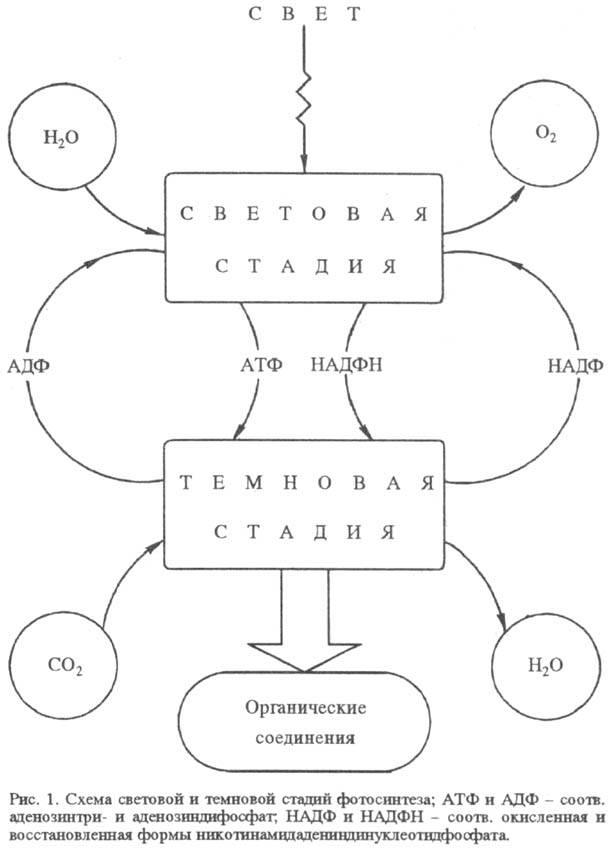
Хлоропласт, представляющий собой замкнутую структуру, отделенную от остальной части клетки оболочкой, заключает в себе весь фотосинтетич. аппарат. Световая стадия реализуется в мембранных структурах хлоропласта (т. наз. тилакои-дах), тогда как темновая стадия происходит в жидком содержимом хлоропласта (строме) при участии водорастворимых ферментов. У фотосинтезирующих бактерий хлоропласты отсутствуют, но световая стадия также осуществляется в мембранных образованиях - в т. наз. хроматофорах.
Световая стадия. Миним. функциональная единица, еще способная осуществлять световую стадию Ф.,- тилакоид. Он представляет собой микроскопич. плоский диск, образованный белковолипидными мембранами, в к-рых находятся пигменты. В эти мембраны встроены все компоненты, необходимые для окисления воды, восстановления кофермента никотинамиддинуклеотидфосфата (НАДФ) до НАДФН и синтеза АТФ из аденозиндифосфата. Световая стадия инициируется поглощением кванта света пигментами, организованными в спец. светособирающие комплексы. Среди пигментов преобладает хлорофилл а. К вспомогат. пигментам относятся хлорофилл b, каротиноиды и др. Наличие светособирающей структуры из неск. сотен или десятков молекул пигментов на каждый фотохимически активный (реакционный) центр на 2-3 порядка увеличивает сечение захвата излучения и обеспечивает возможность Ф. при слабом освещении.
Часть вспомогат. пигментов, спектрально наиб. близких к фотохимически активному хлорофиллу, непосредственно окружает каждый из реакционных центров, образуя т. наз. антенны.
Высокая эффективность переноса возбуждения от молекулы, поглотившей квант, к фотохим. центру определяется спектр. св-вами и структурной организацией пигментов светособирающего комплекса и антенны, окружающей фотохим. центр. Эти пигменты обеспечивают передачу возбуждения за время менее 100 пс в пределах времени жизни синглетно возбужденного состояния хлорофилла.
В реакц. центре Ф., куда почти со 100%-ной вероятностью переносится возбуждение, происходит первичная р-ция между фотохимически активной молекулой хлорофилла а (у бактерий - бактериохлорофилла) и первичным акцептором электрона (ПА). Дальнейшие р-ции в тилакоидных мембранах происходят между молекулами в их осн. состояниях и не требуют возбуждения светом. Эти р-ции организованы в электронтранспортную цепь - последовательность фиксированных в мембране переносчиков электрона. В электронтранс-портной цепи высших растений и водорослей содержится два фотохим. центра (фотосистемы), действующих последовательно (рис. 2), в бактериальной электронтранспортной цепи - один (рис. 3).
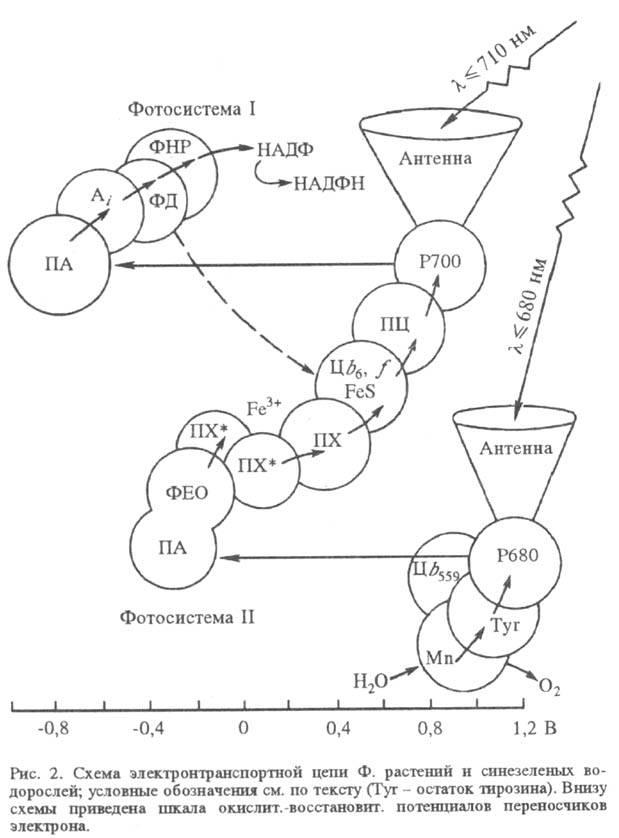
В фотосистеме II высших растений и водорослей синглетно возбужденный хлорофилл а в центре Р680 (число 680 обозначает, что максимум спектральных изменений системы при возбуждении светом находится вблизи 680 нм) отдает электрон через промежуточный акцептор к феофитину (ФЕО, безмагниевый аналог хлорофилла), образуя катион-радикал . Анион-радикал восстановленного феофитина служит далее донором электрона для связанного пластохинона (ПХ*; отличается от убихинонов заместителями в хиноидном кольце), координированного с ионом Fe3+ (в бактериях имеется аналогичный Fе3+-убихинонный комплекс). Далее электрон переносится по цепи, включающей свободный пластохинон (ПХ), присутствующий в избытке по отношению к остальным компонентам цепи, затем цитохромы (Ц) b6 и f, образующие комплекс с железо-серным центром, через медьсодержащий белок пластоцианин (ПЦ; мол. м. 10400) к реакционному центру фотосистемы I.
Центры быстро восстанавливаются, принимая электрон через ряд промежут. переносчиков от воды. Образование O2 требует последоват. четырехкратного возбуждения реакционного центра фотосистемы П и катализируется мембранным комплексом, содержащим Mn.
Хлорофилл a в фотосистеме I, имеющий максимум поглощения вблизи 700 нм (центр Р700), является первичным фотовозбуждаемым донором электрона, к-рый он отдает первичному акцептору (ПА; его природа однозначно не установлена), а затем, через ряд промежут. переносчиков (Ai) -растворимому белку ферредоксину (ФД), восстанавливающему с помощью фермента ферредоксин-НАДФ-редуктазы (ФНР) НАДФ до НАДФН. Катион-радикал окисленного пигмента восстанавливается пластоцианином.
В зрелых хлоропластах имеются граны (стопки тилакои-дов), в мембранах к-рых присутствуют все компоненты злек-тронтранспортной цепи, и т. наз. агранальные тилакоиды, не содержащие фотосистемы II.
Благодаря асимметрич. расположению компонентов электронтранспортной цепи относительно плоскости мембраны при разделении зарядов между хлорофиллом в каждом из двух фотосинтетич. центров и акцептором электрона на тилако-идной мембране создается разность электрич. потенциалов (плюс - на внутренней, минус - на внешней ее стороне). Перенос электрона пластохиноном сопровождается транспортом протонов, к-рые захватываются снаружи тилакоида при восстановлении пластохинона и освобождаются внутрь тилакоида при окислении пластогидрохинона. Перенос электронов сопряжен с синтезом АТФ из аденозиндифосфата (АДФ) и неорг. фосфата. Предполагают, что обратный транспорт протонов из тилакоидов в строму через белковый сопрягающий фактор (Н+-АТФ-синтетазу) сопровождается образованием АТФ.

Фотосистема I может действовать автономно без контакта с системой II. В этом случае циклический перенос электрона (на схеме показан пунктиром) сопровождается синтезом АТФ, а не НАДФН. Образующиеся в световой стадии кофермент
НАДФН и АТФ используются в темновой стадии Ф., в ходе к-рой снова образуется НАДФ и АДФ.
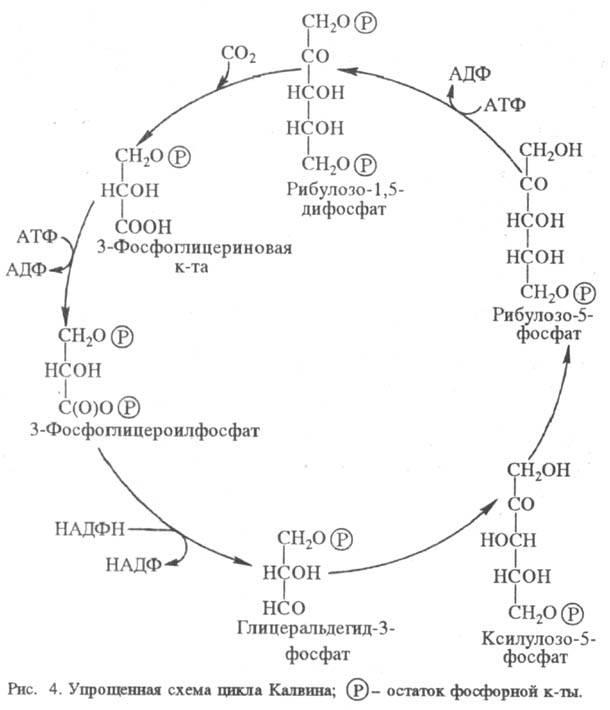
Электронтранспортные цепи фотосинтезирующих бактерий в основных своих чертах аналогичны отдельным фрагментам таковых в хлорогшастах высших растений. На рис. 3 показана электронтранспортная цепь пурпурных бактерий.
Темновая стадия Ф. Все фотосинтезирующие организмы, выделяющие O2, а также нек-рые фотосинтезирующие бактерии сначала восстанавливают CO2 до фосфатов Сахаров в т. наз. цикле Калвина. У фотосинтезирующих бактерий встречаются, по-видимому, и др. механизмы. Большинство ферментов цикла Калвина находится в растворимом состоянии в строме хлоропластов.
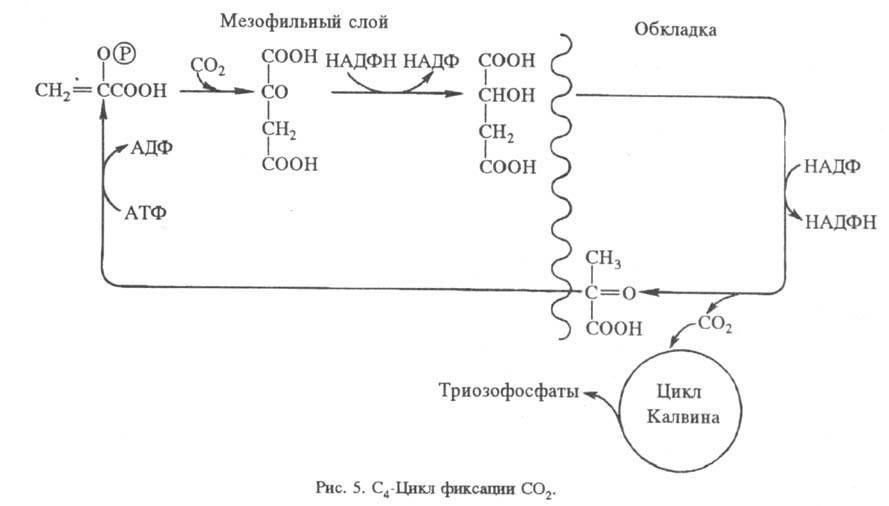
Упрощенная схема цикла показана на рис. 4. Первая стадия - карбоксилирование рибулозо-1,5-дифосфата и гидролиз продукта с ооразованием двух молекул 3-фосфоглицериновой к-ты. Эта С3-кислота фосфорили-руется АТФ с образованием 3-фос-фоглицероилфосфата, к-рый затем восстанавливается НАДФН до гли-церальдегид-3-фосфата. Полученный триозофосфат затем вступает в ряд р-ций изомеризации, конденсации и перегруппировок, дающих 3 молекулы рибулозо-5-фосфата. Последний фосфорилируется при участии АТФ с образованием риоу-лозо-1,5-дифосфата и, т. обр., цикл замыкается. Одна из 6 образующихся молекул глицеральдегид-3-фос-фата превращается в глюко-зо-6-фосфат и используется затем для синтеза крахмала либо выделяется из хлоропласта в цитоплазму. Глицеральдегид-3-фосфат может также превращаться в 3-глицеро-фосфат и затем в липиды. Триозофосфаты, поступающие из хлоропласта, превращаются в осн. в сахарозу, к-рая переносится из листа в др. части растения.
В одном полном обороте цикла Калвина расходуется 9 молекул АТФ и 6 молекул НАДФН для образования одной молекулы 3-фосфоглицериновой к-ты. Энергетич. эффективность цикла (отношение энергии фотонов, необходимых для фотосинтеза АТФ и НАДФН, к DG0 образования углевода из CO2) с учетом действующих в строме хлоропласта концентраций субстратов составляет 83%. В самом цикле Калвина нет фотохим. стадий, но световые стадии могут косвенно влиять на него (в т. ч. и на р-ции, не требующие АТФ или НАДФН) через изменения концентраций ионов Mg2+ и H+, а также уровня восстановленности ферредоксина.
Нек-рые высшие растения, приспособившиеся к высокой интенсивности света и к теплому климату (напр., сахарный тростник, кукуруза), способны предварительно фиксировать CO2 в дополнит. С4-цикле. При этом CO2 сначала включается в обмен четырехуглеродных дикарбоновых к-т, к-рые затем декарбоксилируются там, где локализован цикл Калвина. С4-Цикл характерен для растений с особым анатомич. строением листа и разделением ф-ций между двумя типами клеток: мезофильных, где сосредоточено карбоксилирование фосфоенолиировиноградной к-ты, и клеток обкладки сосудистого пучка, где функционирует цикл Калвина. Образующаяся в С4-цикле щавелевоуксусная кислота восстанавливается НАДФН до яблочной, к-рая перемещается в клетки сосудистой обкладки и здесь подвергается окислит, декарбоксили-рованию, образуя пировиноградную к-ту, CO2 и НАДФН. Два последних используются в цикле Калвина, а пировиноградная к-та возвращается в С4-цикл (рис. 5). Физиол. смысл С4-цикла состоит в запасании CO2 и повышении, т. обр., общей эффективности процесса.
Для кактусов, молочая и др. засухоустойчивых растений характерно частичное разделение фиксации CO2 и Ф. во времени (САМ-обмен, или обмен по типу толстянковых; САМ сокр. от англ. Crassulaceae acid metabolism). Днем устьица (каналы, через к-рые осуществляется газообмен с атмосферой) закрываются, чтобы уменьшить испарение воды. При этом поступление CO2 также затруднено. Ночью устьица открываются, происходит фиксация CO2 в виде фосфоенол-пировиноградной к-ты с образованием С4-кислот, к-рые днем декарбоксилируются, а освобождаемый при этом CO2 включается в цикл Калвина (рис. 6).
Ф. галобактерий. Единственный известный в природе не-хлорофилльный способ запасания энергии света осуществляют бактерии Halobacterium halobium. Ha ярком свету при пониженной концентрации O2 они образуют в своих мембранах пурпурный белок бактериородопсин . В результате индуцированной светом цис-транс-изомеризации ретиналя (хромофора этого пигмента) происходит поглощение H+ и синтез АТФ. Последний используется для частичного обеспечения энерге-тич. потребностей клетки.
Историческая справка. Ок. 1770 Дж. Пристли обнаружил, что растения выделяют O2. В 1779 Я. Ингенхауз установил, что для этого необходим свет и что O2 выделяют только зеленые части растений. Ж. Сенебье в 1782 показал, что для питания растений требуется CO2; в нач. 19 в. H. Соссюр, исходя из закона сохранения массы, подтвердил, что большая часть массы растений создается из CO2 и воды. В 1817 П. Пельтье и Ж. Каванту выделили зеленый пигмент хлорофилл. Позже К.А. Тимирязев показал близость спектра действия Ф. и спектра поглощения хлорофилла. Ю. Сакс в сер. 19 в., по-видимому, первым осознал, что этот продукт накапливается в хлоропластах, а Т.В. Энгельман доказал, что именно там же выделяется и O2.
В работах Ф. Блэкмана (1905), P. Эмерсона и У. Арнолда (1932), а также P. Хилла (1936-41) показано наличие световой и темновой стадий Ф. и экспериментально реализована световая стадия в отсутствие CO2 с использованием искусств. акцепторов электрона. Тем самым были получены подтверждения представлений об образовании O2 путем окисления воды. Окончательно это было доказано масс-спектрометрич. методом (С. Рубен, M. Камен, а также А.П. Виноградов и Р.В. Тейс, 1941).
В 1935-41 К. Ван Ниль обобщил данные по Ф. высших растений и бактерий и предложил общее ур-ние, охватывающее все типы Ф. X. Гаффрон и К. Воль, а также Л. Дёйсенс в 1936-52 на основе количеств. измерений выхода продуктов Ф. поглощенного света и содержания хлорофилла сформулировали представление о "фотосинтетич. единице" - ансамбле молекул пигмента, осуществляющих светосбор и обслуживающих фотохим. центр.
В 40-50-х гг. M. Калвин, используя изотоп 14C, выявил механизм фиксации CO2. Д. Арнон (1954) открыл фотофос-форилирование (инициируемый светом синтез АТФ из АДФ и H3PO4) и сформулировал концепцию электронного транспорта в мембранах хлоропластов. P. Эмерсон и Ч.M. Льюис (1942-43) обнаружили резкое снижение эффективности фотосинтеза при 700 нм (красное падение, или первый эффект Эмерсона), а в 1957 Эмерсон наблюдал неаддитивное усиление Ф. при добавлении света низкой интенсивности с 650 нм к дальнему красному свету (эффект усиления, или второй эффект Эмерсона). На этом основании в 60-х гг. сформулировано представление о последовательно действующих фотосистемах в электронтранспортной цепи Ф. с максимумами в спектрах действия вблизи 680 и 700 HM.
Осн. закономерности образования O2 при окислении воды в Ф. установлены в работах Б. Кока и П. Жолио (1969-70). Близится к завершению выяснение мол. организации мембранного комплекса, катализирующего этот процесс. В 80-х гг. методом рентгеновского структурного анализа детально изучена структура отдельных компонентов фотосинтетич. аппарата, включая реакционные центры и светособирающие комплексы (И. Дайзенхофер, X. Михель, P. Хубер).
