ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 29.03.2024
Просмотров: 82
Скачиваний: 0
Давление, установившееся в баллоне,
![]() ,
,
где Н
- атмосферное
давление,
![]() -атмосферное
-атмосферное![]() давление,
измеряемое разностью уровней жидкости
в манометре1.
давление,
измеряемое разностью уровней жидкости
в манометре1.
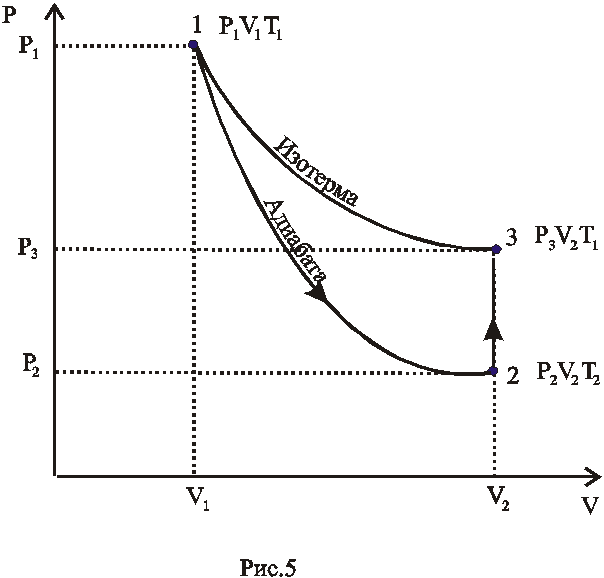
Таким образом,
состояние воздуха внутри баллона,
которое назовем первым состоянием,
будет характеризоваться параметрами:
![]() ;V
;Т1.
Этому состоянию газа соответствует
точка 1
рис.5. Затем открываем на короткое время
кран 3
(рис.4),
соединяем баллон с окружающей средой.
Этот процесс расширения можно считать
адиабатическим.
;V
;Т1.
Этому состоянию газа соответствует
точка 1
рис.5. Затем открываем на короткое время
кран 3
(рис.4),
соединяем баллон с окружающей средой.
Этот процесс расширения можно считать
адиабатическим.
Давление в сосуде
установится равным атмосферному P2=
Н
, температура
понизится до Т2<Т1,
а объем будет равен
![]() .
Следовательно, в конце адиабатического
процесса у воздуха в баллоне будут
параметрыH;
V2;
T2(T2
< T1)
(рис.5 точка 2).
.
Следовательно, в конце адиабатического
процесса у воздуха в баллоне будут
параметрыH;
V2;
T2(T2
< T1)
(рис.5 точка 2).
Переход из первого состояния во второе является адиабатическим, к такому переходу применим уравнение Пуассона
![]() . (13)
. (13)
Через три-четыре минуты после закрытия клапана воздух в баллоне нагреется изохорически до комнатной температуры t1 , а давление повышается до Р3 = H+h2(точка 3 на рис.5) h2-разность уровней в манометре, когда температура в баллоне стала равной комнатной. Сравнивая конечное состояние «3» с первоначальным состоянием «1», видим, что они принадлежат одной и той же изотерме.
![]() (14)
(14)
Возведем (14) в
степень ,
получим
![]() и разделим его на (13):
и разделим его на (13):![]() прологарифмируем -
прологарифмируем -![]() ,
отсюда
,
отсюда![]() .
Принимая во внимание, чтоР1=H+h1,
P2=H,P3=H+h2,
т.е. давления мало отличаются друг от
друга, разность логарифмов можно принять
пропорциональными разностям самих
давлений и
.
Принимая во внимание, чтоР1=H+h1,
P2=H,P3=H+h2,
т.е. давления мало отличаются друг от
друга, разность логарифмов можно принять
пропорциональными разностям самих
давлений и
![]() ,
,
откуда
![]() .
(15)
.
(15)
Последняя формула есть рабочая.
Порядок выполнения работы
1. Осторожно ( чтобы
не выплеснуть жидкость из манометра )
накачайте в баллон воздух, так чтобы
разность уровней в коленах манометра
составляла 80-100 мм. Так как при нагнетании
воздуха в баллон температура его
возрастает ,то перед тем как снять
показание давления, надо выждать одну
минуту, пока через стенки баллона
температура воздуха в нем не выравняется
с температурой окружающей среды. Процесс
выравнивания температуры можно заметить
по небольшому изменению уровней жидкости
в коленах манометра, которое прекращается,
как только произойдет выравнивание
температур. В это время снимите значение
![]() ,
равное разности уровней.
,
равное разности уровней.
2. Проведите над газом процесс адиабатического расширения (помните, что он должен пройти без теплообмена с окружающей средой ). Для этого откройте кран 3, при этом слышится характерное шипение. Как только оно прекратится, кран следует быстро закрыть. Расширяясь воздух в сосуде охладится .
3.Предоставьте
возможность газу в баллоне через стенки
нагреться до температуры окружающей
среды, т.е. до первоначальной температуры
![]() .
При нагревании газа давление в баллоне
повышается, и уровень жидкости в коленах
манометра изменяется. После выравнивания
температуры снимите значение
.
При нагревании газа давление в баллоне
повышается, и уровень жидкости в коленах
манометра изменяется. После выравнивания
температуры снимите значение![]() .
.
4. Подставьте в рабочую формулу значения h1 и h2 вычислите значение .Опыт повторите 5 - 7 раз.
Все полученные опытом и вычисленные результаты сводят в таблицу.
|
№ опыта |
|
|
|
|
|
|
1 |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
3 |
|
|
|
|
|
|
средние значения |
|
|
|
|
|
Контрольные вопросы
1. Цель работы.
2. Что такое молярная и удельная теплоемкости ?
3. Какие и сколько теплоемкостей различают у газа ?
4. Какая теплоемкость больше и почему ? Уравнение Р. Майера.
5.Формулы Cv и Сp через число степеней свободы.
6.Сколько и какие степени свободы у одно- , двух- и трех- атомного газа ?
7. Записать показатель
адиабаты
![]() через число степеней свободы.
через число степеней свободы.
8. Каким способом
вы определили
![]() .
.
9. Какие процессы при этом осуществлялись над газом ?
10. Поясните изохорический, изобарический, изотермический и адиабатический процессы: процессы, анализ, графики.
11. Как изменялись параметры газа: P, V, T в данной работе ?
12. Вывод рабочей формулы.
Литература
1. Яворский и др., Курс физики, т.1, 1973… П. 10.5 и 11.6
2. Савельев. Курс общей физики, т.1, 1970… П. 102
3 .Зисман и Тодес. Курс общей физики, т.1, 1974, П. 33 и 34
Лабораторная работа №1.13
Определение приращения энтропии при плавлении олова
Краткая теория
Термодинамика - раздел физики, в котором изучается связь между различными макроскопическими величинами и энергетическими характеристиками системы. Особенностью термодинамического подхода является отсутствие представлений о внутреннем строении системы, что делает выводы термодинамики наиболее общими, хотя и более формальными.
Первое начало термодинамики
Количество теплоты dQ, сообщаемое системе, расходуется на изменение внутренней энергии системы dU и совершение работы против внешних сил
![]() .
.
Первое начало термодинамики выполняется в любых системах и при любых условиях. Однако, первое начало не позволяет указать направление самопроизвольных процессов в природе, на этот вопрос отвечает второе начало термодинамики.
Теплота не может сама собой переходить от менее нагретого тела к более нагретому.
Однако эта формулировка не запрещает принудительно переходить теплу от менее нагретого к более нагретому. При таком переходе происходят изменения либо в термодинамической системе, либо в окружающей среде.
Невозможен такой периодический процесс, единственным результатом которого было бы превращение всей полученной машиной теплоты в работу.