ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 15.07.2024
Просмотров: 248
Скачиваний: 0
СОДЕРЖАНИЕ
Вопрос 4
Основные компоненты пищи
Для роста, развития и нормального функционирования организму человека необходим полноценный пищевой рацион. Он складывается из соединений первичного синтеза (питательных веществ) - белков, жиров (липидов), углеводов, а также из биологически активных веществ - алкалоидов, флавоноидов, витаминов, гликозидов и других соединений, которые относятся к соединениям вторичного происхождения.
Вопрос 6
Белки—полимеры аминокислот
Полимеры – гигантские молекулы, построенные из последовательно связанных друг с другом достаточно простых фрагментов, – являются основой растительных и животных тканей. Так, белки – это полимеры аминокислот, небольших молекул, содержащих аминогруппу и карбоксильную группу. Эти две группы из разных молекул, взаимодействуя друг с другом, образуют химическую связь между молекулами, при этом отдельные молекулы связываются в очень длинные цепи. Простейшие из белков, например инсулин, состоят примерно только из 50 остатков аминокислот, тогда как во многих белках вместе связаны сотни остатков аминокислот. В организме животных белки как служат для построения тканей, так и участвуют в различных биохимических процессах. Например, белок коллаген принадлежит к обычным «строительным материалам» организма, в частности входит в состав сухожилий. Тонкий «канатик» сухожилий из перекрученных между собой молекул коллагена обладает прочностью легкой стальной проволоки. Другой «строительный» белок – кератин – содержится в тканях копыт, волос, рогов и перьев. Актин и миозин входят в состав мышечной ткани. Белки также являются основным, а в некоторых случаях и единственным компонентом ферментов – клеточных катализаторов, которые ускоряют протекание биохимических реакций, и антител, защищающих организм от микроорганизмов, несущих инфекцию. Осуществление столь разных функций оказывается возможным благодаря различию физической структуры белков. В зависимости от пространственного строения и химических свойств боковых цепей, имеющихся в отдельных аминокислотах, в целом молекула белка может оказаться как вытянутой в тонкую длинную нить, так и свернутой в клубок. Белок может содержать группы, несущие электрический заряд, а также атомы серы, способные связывать отдельные аминокислоты одной цепи или разных цепей мостиковыми связями. Так, в инсулине две аминокислотные цепи связаны друг с другом атомами серы. В цитохроме С атом серы образует связь с молекулой небелкового характера (гемом)
Аминокислоты
Все живые организмы различаются по способности синтезировать аминокислоты,
необходимые для биосинтеза белков. В организме человека синтезируется только часть
аминокислот, другие должны доставляться с пищей. Первые из них называются заменимыми,
вторые — незаменимыми (см. рис. 2.4). Заменимые аминокислоты способны заменять одна
другую в рационе, так как они превращаются друг в друга или синтезируются из промежуточных
продуктов углеводного или липидного обмена. Для незаменимых аминокислот такие пути обмена
существуют только у растений и некоторых микроорганизмов, например Е. coli.
Жизнедеятельность человека обеспечивается ежедневным потреблением с пищейсбалансированной смеси, содержащей восемь незаменимых аминокислот и две частично
заменимые. Незаменимые представлены аминокислотами с разветвленной цепью углерода —
лейцином, изо-лейцином и валином, ароматическими — фенилаланином, триптофаном и
алифатическими — треонином, лизином и метионином. Так как из ме-тионина и фенилаланина в
организме синтезируется цистеин и тирозин, соответственно, то наличие в пище в достаточном
количестве этих двух заменимых аминокислот сокращает потребность в незаменимых пред-
шественниках.
К частично заменимым аминокислотам относят аргинин и гистидин, так как в организме они
синтезируются довольно медленно. Недостаточное потребление аргинина и гистидина с пищей у
взрослого человека в целом не сказывается на развитии, однако может возникнуть экзема или
нарушиться синтез гемоглобина. В аргинине и гистидине особенно нуждается молодой организм.
Отсутствие в пище хотя бы одной незаменимой аминокислоты вызывает отрицательный
азотистый баланс, нарушение деятельности центральной нервной системы, остановку роста и
тяжелые клинические последствия типа авитаминоза. Нехватка одной незаменимой аминокислоты
приводит к неполному усвоению других. Данная закономерность подчиняется закону Либиха, по
которому развитие живых организмов определяется тем незаменимым веществом, которое
присутствует в наименьшем количестве.
Вопрос 8
Пептидами называются соединения, образованные из аминокислот с помощью пептидных связей. Условно считают, что пептиды содержат менее 50 АК, а более длинные полипептиды уже относят к белкам.
Структурные особенности пептидов:
Пептиды могут содержать D-аминокислоты, так, антибиотик пенициллин содержит L-цис и D-вал (рис. 3.7)
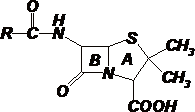
Рис. 3.7 Строение антибиотика пенициллина – циклического депептида
Пептиды могут содержать аналоги АК, например депептид карнозин представляет собой β-аланин-гистидин.
Пептиды образуют циклические структуры. Эту особенность можно видеть в молекулах пенициллина, грамицидина, валиномицина и других.
В состав пептидов могут входить небелковые АК, например грамицидин содержит орнитин – более короткий гомолог лизина.
Физико-химические свойства пептидов определяются аминокислотным составом, то есть пептиды могут быть нейтральными или заряженными, проявлять кислотные или основные свойства, они имеют изоэлектрическую точку и поэтому могут быть разделены электрофоретическими методами или же храматографически.
В природе существует два вида пептидов, один из которых синтезируется и выполняет физиологическую роль в процессе жизнидеятельности организма, другой образуется за счет химического или ферментативного гидролиза белков в организме или вне его. Пептиды, образующиеся в процессе гидролиза вне организма (in vitro), широко используются для анализа аминокислотной последовательности белков.
Ферментативное образование пептидов происходит в желудочно-кишечном тракте человека в процессе переваривания белков пищи. Оно начинается в желудке под действием пепсина, гастриксина и заканчивается в желудке под действием пепсина, гастриксина и заканчивается в кишечнике при участии трипсина, химотрипсина, амино- и карбоксипептидаз. Распад коротких пептидов завершается ди- и трипептидами с образованием свободных аминокислот, которые расходуются на синтез белков и других активных соединений.
Для многих природных пептидов установлена структура и роль. На рис. 3.7 отображены физиологическое значение и функциональная роль наиболее распространенных групп пептидов, от которых зависят здоровье человека и органолептические и санитарно-гигиенические свойства пищевых продуктов.
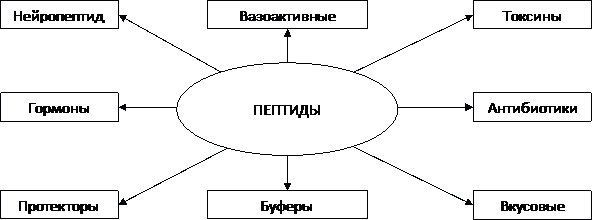
Вопрос 11
Понятие о новых формах белковой пищи
егодня в условиях постоянно растущего общества и ограниченности ресурсов перед человеком стоит необходимость создания современных продуктов питания, обладающих функциональными свойствами и отвечающих требованиям науки о здоровом питании.
Новые формы белковой пищи – это продуты питания, получаемые на основе различных белковых фракций продовольственного сырья с применением научно обоснованных способов переработки, и имеющие определённый химический состав, структуру и свойства.
Широкое признание получили различные растительные белковые источники: зернобобовые, хлебные и крупяные и побочные продукты их переработки, масличные; овощи и бахчёвые, вегетативная масса растений.
При этом для производства белковых продуктов преимущественно используются соя и пшеница.
Продукты переработки соевых белков подразделяются на три группы, отличающиеся по содержанию белка: муку и крупу получают путём помола в них содержится 40÷45% белка от общей массы продукта; соевые концентраты получают путём удаления водорастворимых компонентов, они содержат 65÷70% белка; соевые изоляты получают экстракцией белка, они содержат не менее 90% белка.
На основе сои получают текстурированные белковые продукты, в которых соевые белки используют, например, вместо белков мяса. Гидролизованные соевые белки называются модифицированными. Их используют как функциональные и вкусовые добавки к пище.
Сегодня на основе сои также выпускают соевое молоко, соевый соус, тофу (соевый творог) и др. продукты питания.
Из пшеницы или пшеничной муки методом водной экстракции получают сухую пшеничную клейковину с содержанием белка 75÷80%.
В то же время наличие лимитирующих аминокислот в растительных белках определяет их неполноценность. Выходом здесь является совместное использование различных белков, что обеспечивает эффект взаимного обогащения. Если при этом достигают повышения аминокислотного скора каждой незаменимой лимитирующей аминокислоты по сравнению отдельным использованием исходных белков, то говорят об эффекте простого обогащения, если после смешивания аминокислотный скор каждой аминокислоты превышает 1,0, то – это эффект истинного обогащения. Использование подобных сбалансированных белковых комплексов обеспечивает повышение усвояемости растительных белков до 80÷100%.
Создание промышленных технологий производства концентрированных белковых продуктов из растительного сырья, в частности сои, - одно из основных направлений увеличения ресурсов продовольствия и кормов, совершенствования структуры питания населения.
В большинстве промышленно развитых стран (США, Японии, Бельгии, Дании и др.) уже накоплен практический опыт по переработке сои с получением соевых белков и разнообразного ассортимента высококачественных пищевых продуктов на их основе. Как правило, эти производства работают по экологически чистой безотходной технологии, выпуская помимо пищевых высококонцентрированных белков также высококачественные корма и биологически активные препараты.
Особое внимание к белкам сои обусловлено следующими факторами:
1. Доступность сырья (посевы сои в мире занимают более 70 млн га, общий объем производства семян сои составляет около 160 млн т, с 1 га можно получить до 731 кг белка).
2. Уникальный химический состав семян сои (содержание белка 40 %, липидов 20 %), обеспечивающий ренельность промышленной переработки.
3. Высокая биологическая и пищевая ценность и хорошие функциональные свойства соевых белковых продуктов.
4. Большой исторический опыт использования продуктов переработки сои в питании.
Современные технологии получения белковых продуктов из растительного сырья строятся на двух основных технологических подходах:
1. Глубокое фракционирование макронутриентов сырья с максимизацией выхода белков, их очистка, концентрированно и при необходимости модификация функциональных и медико-биологических характеристик.
2. Оптимальное фракционирование макро- и микронутриентов сырья с получением белково-липидных и белково-углеводных композитов заданного состава с максимальным сохранением фитохимического потенциала сопутствующих микронутриентов.
Хотя употребление сои в пищу известно уже несколько тысячелетий, в основном оно приходилось на продукты из полножирной сои - соевое молоко, тофу, темпе и т. д. Только в XX в. стали развиваться технологии производства концентрированных соевых белков. В начале века появилась соевая мука, которую получали из целых семян, прессовых жмыхов, а позднее из обезжиренных соевых шротов. Сильный бобовый привкус ограничивал рост рынка соевой муки, поэтому значительные усилия были предприняты для разработки технологий "удаления плохого вкуса".
Для российской пищевой промышленности наибольший интерес представляют белковые продукты из соевого шрота (изоляты, концентраты, обезжиренная мука, текстурированные белки). Технологии их производства можно отнести к первому подходу, так как при их получении ставилась задача достижения максимального выхода белкового компонента после исчерпывающего извлечения липидов.