ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 30.07.2024
Просмотров: 71
Скачиваний: 0
СОДЕРЖАНИЕ
Глава I. Спектральные методы анализа органических веществ
2.3 Способы изображения электронных спектров
2.4 Взаимосвязь электронных спектров и структуры органических молекул. Хромофоры и ауксохромы
2.5 Применение уф-спектроскопии для количественного определения органических веществ
2.5.1 Определение концентрации вещества по молярному коэффициенту поглощения
Спектрофотометрический анализ по непосредственному измерению оптической плотности может быть проведен для веществ, обладающих лишь определенными особенностями строения (ароматические соединения, соединения с сопряженными кратными связями, соединения ряда металлов и др.).
Величина поглощенного излучения прямо пропорциональна числу молекул растворенного вещества на пути «луча» и поэтому возрастает с увеличением концентрации и/или толщины слоя образца (т.е., с длиной оптического пути в кювете).
При любой длине волны интенсивность света, выходящего из раствора (I), связана с интенсивностью света, входящего в раствор (Iо), соотношением, называемым законом Бера-Бугера-Ламберта:
lg (I0/I) = abc где а - коэффициент поглощения,
константа, зависящая от длины
волны, но не зависящая от
концентрации;
b - длина оптического пути;
c - концентрация.
При с, выраженной в молях на литр раствора и b – в сантиметрах, a принимает значение молярного коэффициента поглощения () (в старых работах молярный коэффициент экстинкции).
Если концентрация выражена в граммах на 100 мл раствора, то а принимает значение удельного коэффициента поглощения (Е1%1см).
Таким образом:
Молярный коэффициент поглощения () - оптическая плотность одномолярного раствора вещества при толщине слоя 1см.
Удельный коэффициент поглощения (Е1%1см ) – оптическая плотность раствора, содержащего 1 г вещества в 100 мл раствора при той же толщине слоя.
Переход от удельного показателя поглощения к молярному осуществляется по формуле:
= Е1% 1см ·М/10 где М - молекулярная масса
Величина молярного коэффициента поглощения пропорциональна вероятности определенного электронного перехода.
Для переходов с низкой вероятностью этот коэффициент имеет незначительную величину (от 10 до 103), для переходов с высокой вероятностью - около 105.
Величину радиации, поглощенной раствором, можно охарактеризовать поглощением А (в старых работах «оптическая плотность, D») или пропусканием Т, которые связаны соотношениями:
А = lg (I0/ I)
Т = I/I0
А = - lgТ
C учетом сказанного математическая запись закона светопропускания может быть представлена в следующем виде:
А = εbc
При описании спектра обычно приводят только положения максимумов поглощения, а также соответствующие значения , например максгексан = 235 нм ( 5400). Указывают и растворитель, поскольку он может влиять и на , и на .
2.3 Способы изображения электронных спектров
Электронные спектры поглощения записываются в виде зависимости поглощения от длины волны (ангстрем, нанометр) или частоты (см-1). Величина поглощения может быть выражена процентом поглощения [(I0 – I)/ I0 · 100% ], процентом пропускания [(I/I0) · 100%], оптической плотностью А (А = lg I0/I), коэффициентом молярного поглощения (ε) или его логарифмом (lgε).
Вид
спектра поглощения зависит от выбора
координат (рис.2.2.).
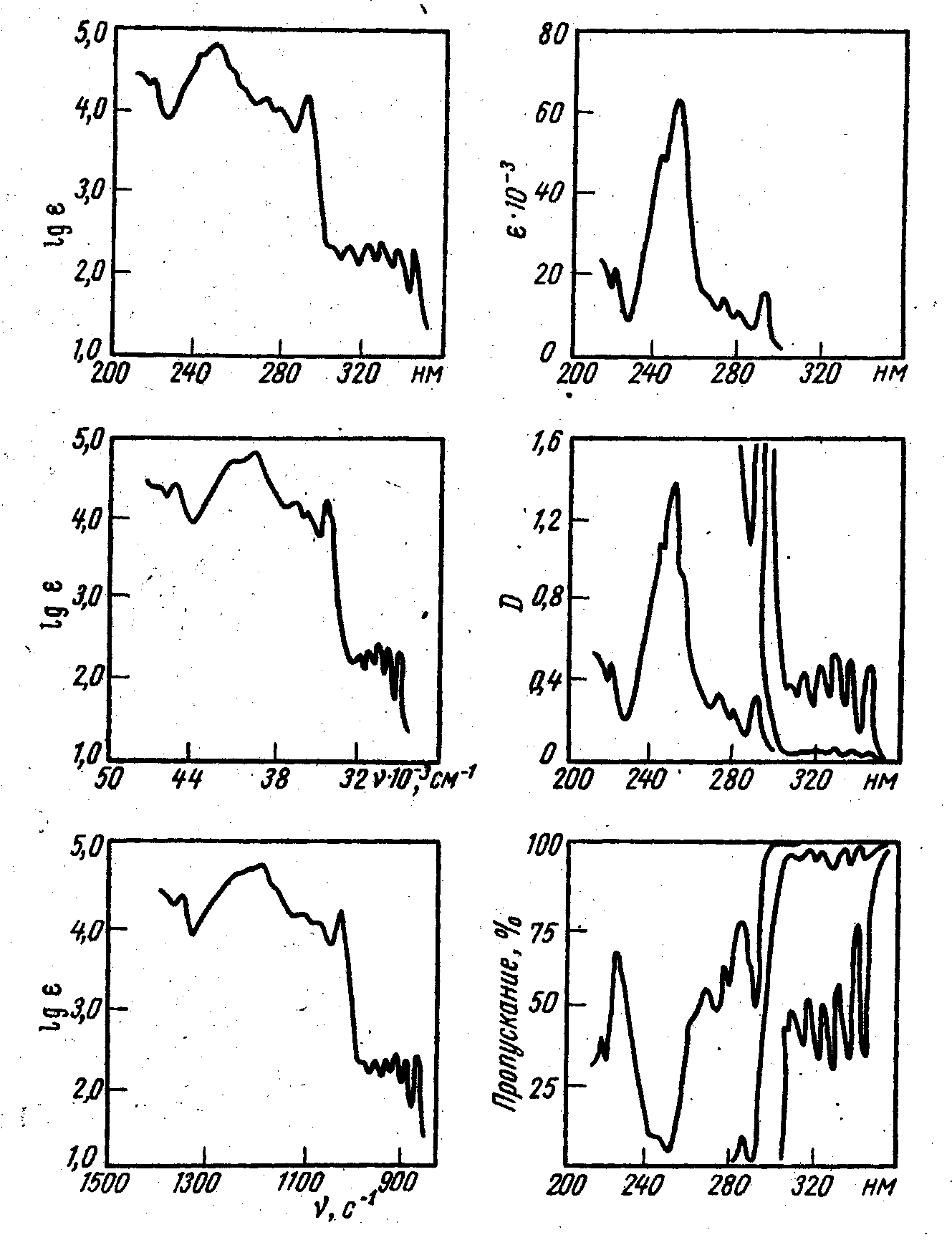
Рис. 2.2. Электронный спектр поглощения фенантрена в различных координатах
Приведем несколько важных замечаний относительно условий получения рабочей спектральной кривой А = f(λ).
Выше было отмечено, что электронные спектры могут быть получены для любого агрегатного состояния вещества. Тем не менее, для решения обычной структурной задачи средствами электронной спектроскопии обычно используют технику съемки растворов веществ. Для спектрофотометрического анализа в УФ-области пригодны многие растворители, в том числе вода, спирты, хлороформ, низшие углеводороды, эфиры, разведенные растворы аммиака, едкого натра, хлористоводородной или серной кислоты. Следует использовать растворители, не содержащие примесей, поглощающих в данной спектральной области; для спектрофотометрии выпускаются специальные растворители, гарантирующие отсутствие примесей. Ниже в таблице 2.1. приведены области поглощения органических растворителей, наиболее часто используемых в УФ-спектроскопии.
Таблица 2.1.
Области поглощения растворителей, наиболее часто используемых в УФ-спектроскопии
|
Растворитель |
Область поглощения, нм |
|
ацетонитрил |
190 |
|
вода |
191 |
|
циклогексан |
195 |
|
гексан |
195 |
|
метанол |
201 |
|
этанол |
204 |
|
диэтиловый эфир |
215 |
|
хлористый метилен |
220 |
|
хлороформ |
237 |
|
четыреххлористый углерод |
257 |
Для снижения величины ошибки при определении оптической плотности А концентрация раствора и толщина слоя его подбираются такими, чтобы оптическая плотность в исследуемой спектральной области находилось в пределах от 0,2 до 0,7.
В зависимости от способности вещества к поглощению это обычно достигается при использовании концентраций от 0,01 до 0,00001% (кюветы с толщиной слоя 10 мм).
Электронная спектроскопия – спектроскопия низких концентраций!
Так, для соединения с молекулярным весом ~100, имеющим ε ~ 10000, условию А = 0.5 (при b = 1 см) соответствует концентрация раствора порядка 0.005 г/л. Учитывая, что для исследования используются кюветы, объем которых, как правило, не превышает 5мл, получаем для навески вещества такого объема раствора величину порядка 0.025 мг. Поэтому обычно предварительно готовят раствор, концентрация которого в 10-100 раз превышает необходимую концентрацию. Затем, используя пипетки и мерные колбы, проводят разбавление до требуемой концентрации. Следует помнить, что:
Сведения о концентрации раствора и толщины кюветы всегда должны сопровождать выдаваемый прибором спектр А = f(λ).
2.4 Взаимосвязь электронных спектров и структуры органических молекул. Хромофоры и ауксохромы
Простая функциональная группа, ответственная за поглощение с характеристическими величинами и , называется хромофором.
Обычно предполагают, что спектры веществ сходны, если их молекулы содержат одинаковые хромофоры. Если молекула содержит два хромофора, разделенных более чем одной простой связью, спектр соединения представляет собой сумму спектральных характеристик индивидуальных хромофоров. Если, однако, два хромофора разделены только одной простой связью (т.е. хромофоры сопряжены), спектр соединения уже не будет суммой спектров индивидуальных хромофоров. В этом случае две простые группы образуют новый, больший хромофор с новыми спектральными характеристиками.
Таблица 2.2
Основные хромофорные группы
|
Хромофор |
Тип перехода |
λmax |
log(ε) |
|
нитрилы |
n → π* |
160 |
<1.0 |
|
алкины |
π→ π* |
170 |
3.0 |
|
алкены |
π→ π* |
175 |
3.0 |
|
спирты |
n→σ* |
180 |
2.5 |
|
простые эфиры |
n→σ* |
180 |
3.5 |
|
Продолжение таблицы 2.2. |
|||
|
кетоны |
π→ π* |
180 |
3.0 |
|
n → π* |
280 |
1.5 |
|
|
альдегиды |
π→ π* |
190 |
2.0 |
|
n → π* |
290 |
1.0 |
|
|
амины |
n→σ* |
190 |
3.5 |
|
кислоты |
n → π* |
205 |
1.5 |
|
сложные эфиры |
n → π* |
205 |
1.5 |
|
амиды |
n → π* |
210 |
1.5 |
|
тиоспирты |
n → π* |
210 |
3.0 |
|
нитросоединения |
n → π* |
271 |
<1.0 |
|
азосоединения |
n → π* |
340 |
<1.0 |