ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 05.07.2024
Просмотров: 156
Скачиваний: 0
|
№ 40 Молекулярно-биологические методы, используемые в диагностике инфекционных болезней (ПЦР, рестрикционный анализ и др.).
Полимеразная цепная реакция позволяет обнаружить микроб в исследуемом материале (воде, продуктах, материале от больного) по наличию в нем ДНК микроба без выделения последнего в чистую культуру. Для проведения этой реакции из исследуемого материала выделяют ДНК, в которой определяют наличие специфичного для данного микроба гена. Обнаружение гена осуществляют его накоплением. Для этого необходимо иметь праймеры комплементарного З'-концам ДНК. исходного гена. Накопление (амплификация) гена выполняется следующим образом. Выделенную из исследуемого материала ДНК нагревают. При этом ДНК распадается на 2 нити. Добавляют праймеры. Смесь ДНК и праймеров охлаждают. При этом праймеры, при наличии в смеси ДНК искомого гена, связываются с его комплементарными участками. Затем к смеси ДНК и праймера добавляют ДНК-полимеразу и нуклеотиды. Устанавливают температуру, оптимальную для функционирования ДНК-полимеразы. В этих условиях, в случае комплементарное™ ДНК гена и праймера, происходит присоединение нуклеотидов к З'-концам праймеров, в результате чего синтезируются две копии гена. После этого цикл повторяется снова, при этом количество ДНК гена будет увеличиваться каждый раз вдвое. Проводят реакцию в специальных приборах — амплификаторах. ПЦР применяется для диагностики вирусных и бактериальных инфекций. Рестрикционный анализ. Данный метод основан на применении ферментов, носящих название рестриктаз. Рестриктазы представляют собой эндонук-леазы, которые расщепляют молекулы ДНК, разрывая фосфатные связи не в произвольных местах, а в определенных последовательностях нуклеотидов. Особое значение для методов молекулярной генетики имеют рестриктазы, которые узнают последовательности, обладающие центральной симметрией и считывающиеся одинаково в обе стороны от оси симметрии. Точка разрыва ДНК может или совпадать с осью симметрии, или быть сдвинута относительно нее. В настоящее время из различных бактерий выделено и очищено более 175 различных рестриктаз, для которых известны сайты (участки) узнавания (рестрикции). Выявлено более 80 различных типов сайтов, в которых может происходить разрыв двойной спирали ДНК. В геноме конкретной таксономической единицы находится строго определенное (генетически задетерминированное) число участков узнавания для определенной рестриктазы. Если выделенную из конкретного микроба ДНК обработать определенной рестриктазой, то это приведет к образованию строго определенного количества фрагментов ДНК фиксированного размера. Размер каждого типа фрагментов можно узнать с помощью электрофореза в агарозном геле: мелкие фрагменты перемещаются в геле быстрее, чем более крупные фрагменты, и длина их пробега больше. Гель окрашивают бромистым этидием и фотографируют в УФ-излучении. Таким образом можно получить рестрикционную карту определенного вида микробов. Сопоставляя карты рестрикции ДНК, выделенных из различных штаммов, можно определить их генетическое родство, выявить принадлежность к определенному виду или роду, а также обнаружить участки, подвергнутые мутациям. Этот метод используется также как начальный этап метода определения последовательности нуклеотидных пар (секвенирования) и метода молекулярной гибридизации. Метод молекулярной гибридизации позволяет выявить степень сходства различных ДНК. Применяется при идентификации микробов для определения их точного таксономического положения. Метод основан на способности двухцепочечной ДНК при повышенной температуре (90 °С) в щелочной среде денатурировать, т. е. расплетаться на две нити, а при понижении температуры на 10 °С вновь восстанавливать исходную двухцепочечную структуру. Метод требует наличия молекулярного зонда. Зондом называется одноцепочечная молекула нуклеиновой кислоты, меченная радиоактивными нуклидами, с которой сравнивают исследуемую ДНК. Для проведения молекулярной гибридизации исследуемую ДНК расплетают указанным выше способом, одну нить фиксируют на специальном фильтре, который затем помещают в раствор, содержащий радиоактивный зонд. Создаются условия, благоприятные для образования двойных спиралей. В случае наличия комплементарности между зондом и исследуемой ДНК, они образуют между собой двойную спираль. Риботипирование и опосредованная транскрипцией амплификация рибосомальной РНК. Последовательность нуклеотидных оснований в оперонах, кодирующих рРНК, отличается консервативностью, присущей каждомувиду бактерий. Эти опероны представлены на бактериальной хромосоме в нескольких копиях. Фрагменты ДНК, полученные после обработки ее рестриктазами, содержат последовательности генов рРНК, которые могут быть обнаружены методом молекулярной гибридизации с меченой рРНК соответствующего виды бактерий. Количество и локализация копий оперонов рРНК и рестрикционный состав сайтов как внутри рРНК-оперона, так и по его флангам варьируют у различных вида бактерий. На основе этого свойства построен метод риботипирования, который позволяет производить мониторинг выделенных штаммов и определение их вида. В настоящее время риботипирование проводится в автоматическом режиме в специальных приборах. Опосредованная транскрипцией амплификация рРНК используется для диагностики смешанных инфекций. Этот метод основан на обнаружении с помощью молекулярной гибридизации амплифицированных рРНК, специфичных для определенного вида бактерий. Исследование проводится в три этапа: 1. Амплификация пула рРНК на матрице выделенной из исследуемого материала ДНК при помощи ДНК-зависимой РНК-полимеразы. 2. Гибридизация накопленного пула рРНК с комплементарными видоспецифическим рРНК олигонуклеотидами, меченными флюорохромом или ферментами. 3. Определение продуктов гибридизации методами денситометрии, иммунофермент-ного анализа (ИФА). Реакция проводится в автоматическом режиме в установках, в которых одномоментное определение рРНК, принадлежащих различным видам бактерий, достигается разделением амплифицированного пула рРНК на несколько проб, в которые вносятся комплементарные видоспецифическим рРНК меченые олигонуклеотиды для гибридизации. |
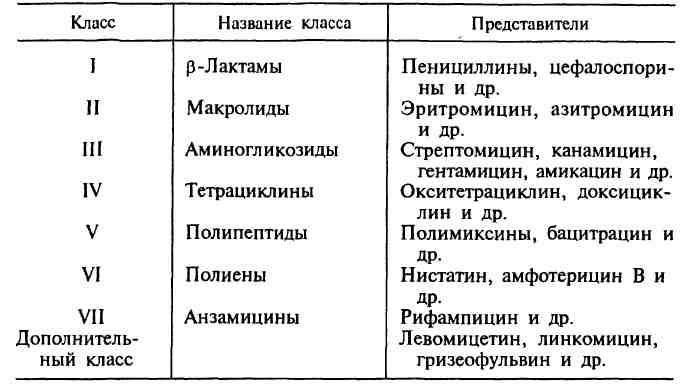
№ 42 Антибиотики. Природные и синтетические. История открытия природных антибиотиков. Классификация антибиотиков по химической структуре, механизму, спектру и типу действия. Способы получения.
Антибиотики — химиотерапевтические вещества, продуцируемые микроорганизмами, животными клетками, растениями, а также их производные и синтетические продукты, которые обладают избирательной способностью угнетать и задерживать рост микроорганизмов, а также подавлять развитие злокачественных новообразований. За тот период, который прошел со времени открытия П.Эрлиха, было получено более 10 000 различных антибиотиков, поэтому важной проблемой являлась систематизация этих препаратов. В настоящее время существуют различные классификации антибиотиков, однако ни одна из них не является общепринятой. В основу главной классификации антибиотиков положено их химическое строение.
Наиболее важными классами синтетических антибиотиков являются хинолоны и фторхинолоны (например, ципрофлоксацин), сульфаниламиды (сульфадиметоксин), имидазолы (метронидазол), нитрофураны (фурадонин, фурагин). По спектру действия антибиотики делят на пять групп в зависимости от того, на какие микроорганизмы они оказывают воздействие. Кроме того, существуют противоопухолевые антибиотики, продуцентами которых также являются актиномицеты. Каждая из этих групп включает две подгруппы: антибиотики широкого и узкого спектра действия. Антибактериальные антибиотики составляют самую многочисленную группу препаратов. Преобладают в ней антибиотики широкого спектра действия, оказывающие влияние на представителей всех трех отделов бактерий. К антибиотикам широкого спектра действия относятся аминогликозиды, тетрациклины и др. Антибиотики узкого спектра действия эффективны в отношении небольшого круга бактерий, например полет-миксины действуют на грациликутные, ванкомицин влияет на грамположительные бактерии. В отдельные группы выделяют противотуберкулезные, противолепрозные, противосифилитические препараты. Противогрибковые антибиотики включают значительно меньшее число препаратов. Широким спектром действия обладает, например, амфотерицин В, эффективный при кандидозах, бластомикозах, аспергиллезах; в то же время нистатин, действующий на грибы рода Candida, является антибиотиком узкого спектра действия. Антипротозойные и антивирусные антибиотики насчитывают небольшое число препаратов. Противоопухолевые антибиотики представлены препаратами, обладающими цитотоксическим действием. Большинство из них применяют при многих видах опухолей, например митоми-цин С. Действие антибиотиков на микроорганизмы связано с их способностью подавлять те или иные биохимические реакции, происходящие в микробной клетке. В зависимости от механизма действия различают пять групп антибиотиков: 1. антибиотики, нарушающие синтез клеточной стенки. К этой группе относятся, например, β-лактамы. Препараты этой группы характеризуются самой высокой избирательностью действия: они убивают бактерии и не оказывают влияния на клетки микроорганизма, так как последние не имеют главного компонента клеточной стенки бактерий — пептидогликана. В связи с этим β -лактамные антибиотики являются наименее токсичными для макроорганизма; 2. антибиотики, нарушающие молекулярную организацию и синтез клеточных мембран. Примерами подобных препаратов являются полимиксины, полиены; 3. антибиотики, нарушающие синтез белка; это наиболее многочисленная группа препаратов. Представителями этой группы являются аминогликозиды, тетрациклины, макроли-ды, левомицетин, вызывающие нарушение синтеза белка на разных уровнях; 4. антибиотики — ингибиторы синтеза нуклеиновых кислот. Например, хинолоны нарушают синтез ДНК, рифампицин — синтез РНК; 5. антибиотики, подавляющие синтез пуринов и аминокислот. К этой группе относятся, например, сульфаниламиды. Источники антибиотиков. Основными продуцентами природных антибиотиков являются микроорганизмы, которые, находясь в своей естественной среде (в основном, в почве), синтезируют антибиотики в качестве средства выживания в борьбе за существование. Животные и растительные клетки также могут вырабатывать некоторые вещества с селективным антимикробным действием (например, фитонциды), однако широкого применения в медицине в качестве продуцентов антибиотиков они не получили. Таким образом, основными источниками получения природных и полусинтетических антибиотиков стали: • Актиномицеты (особенно стрептомицеты) — ветвящиеся бактерии. Они синтезируют большинство природных антибиотиков (80 %). • Плесневые грибы — синтезируют природные бета-лактамы (грибы рода Cephalosporium и Penicillium)H фузидиевую кислоту. • Типичные бактерии — например, эубактерии, бациллы, псевдомонады — продуцируют бацитрацин, полимиксины и другие вещества, обладающие антибактериальным действием. Способы получения. Существует три основных способа получения антибиотиков: • биологический синтез (так получают природные антибиотики — натуральные продукты ферментации, когда в оптимальных условиях культивируют микробы-продуценты, которые выделяют антибиотики в процессе своей жизнедеятельности); • биосинтез с последующими химическими модификациями (так создают полусинтетические антибиотики). Сначала путем биосинтеза получают природный антибиотик, а затем его первоначальную молекулу видоизменяют путем химических модификаций, например присоединяют определенные радикалы, в результате чего улучшаются противомикробные и фармакологические характеристики препарата; • химический синтез (так получают синтетические аналоги природных антибиотиков, например хлорамфеникол/левомицетин). Это вещества, которые имеют такую же структуру, |
№ 43 Осложнения антибиотикотерапии, их предупреждение.
Как и всякие лекарственные средства, практически каждая группа антимикробных химиопрепаратов может оказывать побочное действие, причем и на макроорганизм, и на микробы, и на другие лекарственные средства. Осложнения со стороны макроорганизма Наиболее частыми осложнениями антимикробной химиотерапии являются: Токсическое действие препаратов. Как правило, развитие этого осложнения зависит от свойств самого препарата, его дозы, способа введения, состояния больного и проявляется только при длительном и систематическом применении антимикробных химиотерапевтических препаратов, когда создаются условия для их накопления в организме. Особенно часто такие осложнения бывают, когда мишенью действия препарата являются процессы или структуры, близкие по составу или строению к аналогичным структурам клеток макроорганизма. Токсическому действию антимикробных препаратов особенно подвержены дети, беременные, а также пациенты с нарушением функций печени, почек. Побочное токсическое влияние может проявляться как нейротоксическое (например, гликопептиды и аминогликозиды оказывают ототоксическое действие, вплоть до полной потери слуха за счет воздействия на слуховой нерв); нефротоксическое (полиены, полипептиды, аминогликозиды, макролиды, гликопептиды, сульфаниламиды); общетоксическое (противогрибковые препараты — полиены, имидазолы); угнетение кроветворения (тетрациклины, сульфаниламиды, левомицетин/хлорамфеникол, который содержит нитробензен — супрессор функции костного мозга); тератогенное [аминогликозиды, тетрациклины нарушают развитие костей, хрящей у плода и детей, формирование зубной эмали (коричневая окраска зубов), левомицетин/хлорамфеникол токсичен для новорожденных, у которых ферменты печени не полностью сформированы («синдром серого ребенка»), хинолоны — действуют на развивающуюся хрящевую и соединительную ткани]. Предупреждение осложнений состоит в отказе от противопоказанных данному пациенту препаратов, контроле за состоянием функций печени, почек и т. п. Дисбиоз (дисбактериоз). Антимикробные химиопрепараты, особенно широкого спектра, могут воздействовать не только на возбудителей инфекций, но и на чувствительные микроорганизмы нормальной микрофлоры. В результате формируется дисбиоз, поэтому нарушаются функции ЖКТ, возникает авитаминоз и может развиться вторичная инфекция (в том числе эндогенная, например кандидоз, псевдомембранозный колит). Предупреждение последствий такого рода осложнений состоит в назначении, по возможности, препаратов узкого спектра действия, сочетании лечения основного заболевания с противогрибковой терапией (например, назначением нистатина), витаминотерапей, применением эубиотиков и т. п. Отрицательное воздействие на иммунную систему. К этой группе осложнений относят прежде всего аллергические реакции. Причинами развития гиперчувствительности может быть сам препарат, продукты его распада, а также комплекс препарата с сывороточными белками. Возникновение такого рода осложнений зависит от свойств самого препарата, от способа и кратности его введения, индивидуальной чувствительности пациента к препарату. Аллергические реакции развиваются примерно в 10 % случаев и проявляются в виде сыпи, зуда, крапивницы, отека Квинке. Относительно редко встречается такая тяжелая форма проявления аллергии, как анафилактический шок. Такое осложнение чаще дают бета-лактамы (пенициллины), рифамицины. Сульфаниламиды могут вызвать гиперчувствительность замедленного типа. Предупреждение осложнений состоит в тщательном сборе аллергоанамнеза и назначении препаратов в соответствии с индивидуальной чувствительностью пациента. Кроме того, антибиотики обладают некоторым иммунодепрессивным действием и могут способствовать развитию вторичного иммунодефицита и ослаблению напряженности иммунитета. Эндотоксический шок (терапевтический). Это явление, которое возникает при лечении инфекций, вызванных грамотрицательными бактериями. Введение антибиотиков вызывает гибель и разрушение клеток и высвобождение больших количеств эндотоксина. Это закономерное явление, которое сопровождается временным ухудшением клинического состояния больного. Взаимодействие с другими препаратами. Антибиотики могут способствовать потенцированию действия или инактивации других препаратов (например, эритромицин стимулирует выработку ферментов печени, которые начинают ускоренно метаболизировать лекарственные средства разного назначения). Побочное воздействие на микроорганизмы. Применение антимикробных химиопрепа-ратов оказывает на микробы не только прямое угнетающее или губительное воздействие, но также может привести к формированию атипичных форм микробов (например, к образованию L-форм бактерий или изменению других свойств микробов, что значительно затрудняет диагностику инфекционных заболеваний) и персистирующих форм микробов. Широкое использование антимикробных лекарственных средств ведет также к формированию антибиотикозависимости (редко) и лекарственной устойчивости — антибиотикорезистентности (достаточно часто). |
|
|
||
|
№ 41 Понятие о химиотерапии. История открытия химиопрепаратов.
Химиотерапия — специфическое антимикробное, антипаразитарное лечение при помощи химических веществ. Эти вещества обладают важнейшим свойством — избирательностью действия против болезнетворных микроорганизмов в условиях макроорганизма. Основоположником химиотерапии является немецкий химик, лауреат Нобелевской премии П.Эрлих, который установил, что химические вещества, содержащие мышьяк, губительно действуют на спирохеты и трипаносомы, и получил в 1910 г. первый химиотерапевтический препарат — сальварсан (соединение мышьяка, убивающее возбудителя, но безвредное для микроорганизма). В 1935 г. другой немецкий химик Г.Домагк обнаружил среди анилиновых красителей вещество — пронтозил, или красный стрептоцид, спасавший экспериментальных животных от стрептококковой инфекции, но не действующий на эти бактерии вне организма. За это открытие Г.Домагк был удостоен Нобелевской премии. Позднее было выяснено, что в организме происходит распад пронтозила с образованием сульфаниламида, обладающего антибактериальной активностью как in vivo, так и in vitro. Механизм действия сульфаниламидов (сульфонамидов) на микроорганизмы был открыт Р.Вудсом, установившим, что сульфаниламиды являются структурными аналогами парааминобензойной кислоты (ПАБК), участвующей в биосинтезе фолиевой кислоты, необходимой для жизнедеятельности бактерий. Бактерии, используя сульфаниламид вместо ПАБК, погибают. Первый природный антибиотик был открыт в 1929 г. английским бактериологом А.Флемингом. При изучении плесневого гриба Penicillium notatum, препятствующего росту бактериальной культуры, А. Флеминг обнаружил вещество, задерживающее рост бактерий, и назвал его пенициллином. В 1940 г. Г. Флори и Э. Чейн получили очищенный пенициллин. В 1945 г. А Флеминг, Г. Флори и Э. Чейн стали Нобелевскими лауреатами. В настоящее время имеется огромное количество химиотерапевтических препаратов, которые применяются для лечения заболеваний, вызванных различными микроорганизмами. |
||
|
|
|
№ 44 Механизмы лекарственной устойчивости возбудителей инфекционных болезней. Пути ее преодоления.
Антибиотикорезистентность — это устойчивость микробов к антимикробным химиопрепаратам. Бактерии следует считать резистентными, если они не обезвреживаются такими концентрациями препарата, которые реально создаются в макроорганизме. Резистентность может быть природной и приобретенной. Природная устойчивость. Некоторые виды микробов природно устойчивы к определенным семействам антибиотиков или в результате отсутствия соответствующей мишени (например, микоплазмы не имеют клеточной стенки, поэтому не чувствительны ко всем препаратам, действующим на этом уровне), или в результате бактериальной непроницаемости для данного препарата (например, грамотрицательные микробы менее проницаемы для крупномолекулярных соединений, чем грамположительные бактерии, так как их наружная мембрана имеет «маленькие» поры). Приобретенная устойчивость. Приобретение резистентности — это биологическая закономерность, связанная с адаптацией микроорганизмов к условиям внешней среды. Она, хотя и в разной степени, справедлива для всех бактерий и всех антибиотиков. К химиопрепаратам адаптируются не только бактерии, но и остальные микробы — от эукариотических форм (простейшие, грибы) до вирусов. Проблема формирования и распространения лекарственной резистентности микробов особенно значима для внутрибольничных инфекций, вызываемых так называемыми «госпитальными штаммами», у которых, как правило, наблюдается множественная устойчивость к антибиотикам (так называемая полирезистентность). Генетические основы приобретенной резистентности. Устойчивость к антибиотикам определяется и поддерживается генами резистентности (r-генами) и условиями, способствующими их распространению в микробных популяциях. Приобретенная лекарственная устойчивость может возникать и распространяться в популяции бактерий в результате: • мутаций в хромосоме бактериальной клетки с последующей селекцией (т. е. отбором) мутантов. Особенно легко селекция происходит в присутствии антибиотиков, так как в этих условиях мутанты получают преимущество перед остальными клетками популяции, которые чувствительны к препарату. Мутации возникают независимо от применения антибиотика, т. е. сам препарат не влияет на частоту мутаций и не является их причиной, но служит фактором отбора. Далее резистентные клетки дают потомство и могут передаваться в организм следующего хозяина (человека или животного), формируя и распространяя резистентные штаммы. Мутации могут быть: 1) единичные (если мутация произошла в одной клетке, в результате чего в ней синтезируются измененные белки) и 2) множественные (серия мутаций, в результате чего изменяется не один, а целый набор белков, например пени-циллинсвязывающих белков у пенициллин-резистентного пневмококка); • переноса трансмиссивных плазмид резистентности (R-плазмид). Плазмиды резистентности (трансмиссивные) обычно кодируют перекрестную устойчивость к нескольким семействам антибиотиков. Впервые такая множественная резистентность была описана японскими исследователями в отношении кишечных бактерий. Сейчас показано, что она встречается и у других групп бактерий. Некоторые плазмиды могут передаваться между бактериями разных видов, поэтому один и тот же ген резистентности можно встретить у бактерий, таксономически далеких друг от друга. Например, бета-лактамаза, кодируемая плазмидой ТЕМ-1, широко распространена у грамотрицательных бактерий и встречается у кишечной палочки и других кишечных бактерий, а также у гонококка, резистентного к пенициллину, и гемофильной палочки, резистентной к ампициллину; • переноса транспозонов, несущих r-гены (или мигрирующих генетических последовательностей). Транспозоны могут мигрировать с хромосомы на плазмиду и обратно, а также с плазмиды на другую плазмиду. Таким образом гены резистентности могут передаваться далее дочерним клеткам или при рекомбинации другим бактериям-реципиентам. Реализация приобретенной устойчивости. Изменения в геноме бактерий приводят к тому, что меняются и некоторые свойства бактериальной клетки, в результате чего она становится устойчивой к антибактериальным препаратам. Обычно антимикробный эффект препарата осуществляется таким образом: агент должен связаться с бактерией и пройти сквозь ее оболочку, затем он должен быть доставлен к месту действия, после чего препарат взаимодействует с внутриклеточными мишенями. Реализация приобретенной лекарственной устойчивости возможна на каждом из следующих этапов: • модификация мишени. Фермент-мишень может быть так изменен, что его функции не нарушаются, но способность связываться с химиопрепаратом (аффинность) резко снижается или может быть включен «обходной путь» метаболизма, т. е. в клетке активируется другой фермент, который не подвержен действию данного препарата. • «недоступность» мишени за счет снижения проницаемости клеточной стенки и клеточных мембран или «эффлюко-механизма, когда клетка как бы «выталкивает» из себя антибиотик. • инактивация препарата бактериальными ферментами. Некоторые бактерии способны продуцировать особые ферменты, которые делают препараты неактивными (например, бета-лактамазы, аминогликозид-модифицирующие ферменты, хлорамфениколацетилтрансфераза). Бета-лактамазы — это ферменты, разрушающие бета-лактамное кольцо с образованием неактивных соединений. Гены, кодирующие эти ферменты, широко распространены среди бактерий и могут быть как в составе хромосомы, так и в составе плазмиды. Для борьбы с инактивирующим действием бета-лактамаз используют вещества — ингибиторы (например, клавулановую кислоту, сульбактам, тазобактам). Эти вещества содержат в своем составе бета-лактамное кольцо и способны связываться с бета-лактамазами, предотвращая их разрушительное действие на бета-лактамы. При этом собственная антибактериальная активность таких ингибиторов низкая. Клавулановая кислота ингибирует большинство известныхбета-лактамаз. Ее комбинируют с пеницил-линами: амоксициллином, тикарциллином, пиперациллином. Предупредить развитие антибиотикорезистентности у бактерий практически невозможно, но необходимо использовать антимикробные препараты таким образом, чтобы не способствовать развитию и распространению устойчивости (в частности, применять антибиотики строго по показаниям, избегать их использования с профилактической целью, через 10—15 дней ан-тибиотикотерапии менять препарат, по возможности использовать препараты узкого спектра действия, ограниченно применять антибиотики в ветеринарии и не использовать их как фактор роста). |
№ 45 Методы определения чувствительности бактерий к антибиотикам.
Для определения чувствительности бактерий к антибиотикам (антибиотикограммы) обычно применяют: • Метод диффузии в агар. На агаризованную питательную среду засевают исследуемый микроб, а затем вносят антибиотики. Обычно препараты вносят или в специальные лунки в агаре, или на поверхности посева раскладывают диски с антибиотиками («метод дисков»). Учет результатов проводят через сутки по наличию или отсутствию роста микробов вокруг лунок (дисков). Метод дисков — качественный и позволяет оценить, чувствителен или устойчив микроб к препарату. • Методы определения минимальных ингибирующих и бактерицидных концентраций, т. е. минимального уровня антибиотика, который позволяет in vitro предотвратить видимый рост микробов в питательной среде или полностью ее стерилизует. Это количественные методы, которые позволяют рассчитать дозу препарата, так как концентрация антибиотика в крови должна быть значительно выше минимальной ингибирующей концентрации для возбудителя инфекции. Введение адекватных доз препарата необходимо для эффективного лечения и профилактики формирования устойчивых микробов. Есть ускоренные способы, с применением автоматических анализаторов. Определение чувствительности бактерий к антибиотикам методом дисков. Исследуемую бактериальную культуру засевают газоном на питательный агар или среду АГВ в чашке Петри. Среда АГВ: сухой питательный рыбный бульон, агар-агар, натрий фосфат двузамещенный. Среду готовят из сухого порошка в соответствии с инструкцией. На засеянную поверхность пинцетом помещают на одинаковом расстоянии друг от друга бумажные диски, содержащие определенные дозы разных антибиотиков. Посевы инкубируют при 37 °С до следующего дня. По диаметру зон задержки роста исследуемой культуры бактерий судят о ее чувствительности к антибиотикам. Для получения достоверных результатов необходимо применять стандартные диски и питательные среды, для контроля которых используются эталонные штаммы соответствующих микроорганизмов. Метод дисков не дает надежных данных при определении чувствительности микроорганизмов к плохо диффундирующим в агар полипептидным антибиотикам (например, полимиксин, ристомицин). Если эти антибиотики предполагается использовать для лечения, рекомендуется определять чувствительность микроорганизмов методом серийных разведений. Определение чувствительности бактерий к антибиотикам методом серийных разведений. Данным методом определяют минимальную концентрацию антибиотика, ингибирующую рост исследуемой культуры бактерий. Вначале готовят основной раствор, содержащий определенную концентрацию антибиотика (мкг/мл или ЕД/мл) в специальном растворителе или буферном растворе. Из него готовят все последующие разведения в бульоне (в объеме 1 мл), после чего к каждому разведению добавляют 0,1 мл исследуемой бактериальной суспензии, содержащей 106—107 бактериальных клеток в 1 мл. В последнюю пробирку вносят 1 мл бульона и 0,1 мл суспензии бактерий (контроль культуры). Посевы инкубируют при 37 °С до следующего дня, после чего отмечают результаты опыта по помутнению питательной среды, сравнивая с контролем культуры. Последняя пробирка с прозрачной питательной средой указывает на задержку роста исследуемой культуры бактерий под влиянием содержащейся в ней минимальной ингибирующей концентрации (МИК) антибиотика. Оценку результатов определения чувствительности микроорганизмов к антибиотикам проводят по специальной готовой таблице, которая содержит пограничные значения диаметров зон задержки роста для устойчивых, умеренно устойчивых и чувствительных штаммов, а также значения МИК антибиотиков для устойчивых и чувствительных штаммов. К чувствительным относятся штаммы микроорганизмов, рост которых подавляется при концентрациях препарата, обнаруживаемых в сыворотке крови больного при использовании обычных доз антибиотиков. К умеренно устойчивым относятся штаммы, для подавления роста которых требуются концентрации, создающиеся в сыворотке крови при введении максимальных доз препарата. Устойчивыми являются микроорганизмы, рост которых не подавляется препаратом в концентрациях, создаваемых в организме при использовании максимально допустимых доз. Определение антибиотика в крови, моче и других жидкостях организма человека. В штатив устанавливают два ряда пробирок. В одном из них готовят разведения эталонного антибиотика, в другом — исследуемой жидкости. Затем в каждую пробирку вносят взвесь тест-бактерий, приготовленную в среде Гисса с глюкозой. При определении в исследуемой жидкости пенициллина, тетрациклинов, эритромицина в качестве тест-бактерий используют стандартный штамм S. aureus, а при определении стрептомицина — Е. coli. После инкубирования посевов при 37 °С в течение 18—20 ч отмечают результаты опыта по помутнению среды и ее окрашиванию индикатором вследствие расщепления глюкозы тест-бактериями. Концентрация антибиотика определяется умножением наибольшего разведения исследуемой жидкости, задерживающей рост тест-бактерий, на минимальную концентрацию эталонного антибиотика, задерживающего рост тех же тест-бактерий. Например, если максимальное разведение исследуемой жидкости, задерживающее рост тест-бактерий, равно 1 :1024, а минимальная концентрация эталонного антибиотика, задерживающего рост тех же тест-бактерий, 0,313 мкг/мл, то произведение 1024- 0,313=320 мкг/мл составляет концентрацию антибиотика в 1 мл. Определение способности S. aureus продуцировать бета-лактамазу. В колбу с 0,5 мл суточной бульонной культуры стандартного штамма стафилококка, чувствительного к пенициллину, вносят 20 мл расплавленного и охлажденного до 45 °С питательного агара, перемешивают и выливают в чашку Петри. После застывания агара в центр чашки на поверхность среды помещают диск, содержащий пенициллин. По радиусам диска петлей засевают исследуемые культуры. Посевы инкубируют при 37 °С до следующего дня, после чего отмечают результаты опыта. О способности исследуемых бактерий продуцировать бета-лакта-мазу судят по наличию роста стандартного штамма стафилококка вокруг той или другой исследуемой культуры (вокруг диска). |
№ 46 Принципы рациональной антибиотикотерапии.
Профилактика развития осложнений состоит прежде всего в соблюдении принципов рациональной антибиотикотерапии (антимикробной химиотерапии): • Микробиологический принцип. До назначения препарата следует установить возбудителя инфекции и определить его индивидуальную чувствительность к антимикробным химиотерапевтическим препаратам. По результатам антибиотикограммы больному назначают препарат узкого спектра действия, обладающий наиболее выраженной активностью в отношении конкретного возбудителя, в дозе, в 2—3 раза превышающей минимальную ингибирующую концентрацию. Если возбудитель пока неизвестен, то обычно назначают препараты более широкого спектра, активные в отношении всех возможных микробов, наиболее часто вызывающих данную патологию. Коррекцию лечения проводят с учетом результатов бактериологического исследования и определения индивидуальной чувствительности конкретного возбудителя (обычно через 2-3 дня). Начинать лечение инфекции нужно как можно раньше (во-первых, в начале заболевания микробов в организме меньше, во-вторых, препараты активнее действуют на растущих и размножающихся микробов). • Фармакологический принцип. Учитывают особенности препарата — его фармакокинетику и фармакодинамику, распределение в организме, кратность введения, возможность сочетания препаратов и т. п. Дозы препаратов должны быть достаточными для того, чтобы обеспечить в биологических жидкостях и тканях микробостатические или микробоцидные концентрации. Необходимо представлять оптимальную продолжительность лечения, так как клиническое улучшение не является основанием для отмены препарата, потому что в организме могут сохраняться возбудители и может быть рецидив болезни. Учитывают также оптимальные пути введения препарата, так как многие антибиотики плохо всасываются из ЖКТ или не проникают через гематоэнцефалический барьер. • Клинический принцип. При назначении препарата учитывают, насколько безопасным он будет для данного пациента, что зависит от индивидуальных особенностей состояния больного (тяжесть инфекции, иммунный статус, пол, наличие беременности, возраст, состояние функции печени и почек, сопутствующие заболевания и т.п.) При тяжелых, угрожающих жизни инфек-циях особое значение имеет своевременная ан-тибиотикотерапия. Таким пациентам назначают комбинации из двух-трех препаратов, чтобы обеспечить максимально широкий спектр действия. При назначении комбинации из нескольких препаратов следует знать, насколько эффективным против возбудителя и безопасным для пациента будет сочетание данных препаратов, т. е. чтобы не было антагонизма лекарственных средств в отношении антибактериальной активности и не было суммирования их токсических эффектов. • Эпидемиологический принцип. Выбор препарата, особенно для стационарного больного, должен учитывать состояние резистентности микробных штаммов, циркулирующих в данном отделении, стационаре и даже регионе. Следует помнить, что антибиотикоре-зистентность может не только приобретаться, но и теряться, при этом восстанавливается природная чувствительность микроорганизма к препарату. Не изменяется только природная устойчивость. • Фармацевтический принцип. Необходимо учитывать срок годности и соблюдать правила хранения препарата, так как при нарушении этих правил антибиотик может не только потерять свою активность, но и стать токсичным за счет деградации. Немаловажна также и стоимость препарата. |
|
|
||
|
|
|
№ 47 Понятие об инфекции. Условия возникновения инфекционного процесса.
Термин инфекция или синоним инфекционный процесс обозначает совокупность физиологических и патологических восстановительно-приспособительных реакций, возникающих в восприимчивом макроорганизме при определенных условиях окружающей внешней среды в результате его взаимодействия с проникшими и размножающимися в нем патогенными или условно-патогенными бактериями, грибами и вирусами и направленных на поддержание постоянства внутренней среды макроорганизма (гомеостаза). Сходный процесс, но вызванный простейшими, гельминтами и насекомыми — представителями царства Animalia, носит название инвазия. В основе инфекционного процесса лежит феномен паразитизма, т. е. такой формы взаимоотношений между двумя организмами разных видов, при которой один из них, называемый паразитом, использует другого, называемого хозяином, в качестве источника питания и как место постоянного или временного обитания, причем оба организма находятся между собой в антагонистических отношениях. В отличие от сапрофитического образа существования паразитизм — это жизнь в живой среде. Неотъемлемым критерием паразитизма является патогенное воздействие паразита на организм хозяина и ответная, защитная реакция со стороны организма хозяина. Паразитизм — свойство, закрепленное за видом и передающееся по наследству. Все возбудители инфекционных и инвазионных болезней человека, животных и растений относятся к паразитам, т. е. способны к паразитической форме существования в живой системе. Возникновение, течение и исход инфекционного процесса определяются тремя группами факторов: 1) количественные и качественные характеристики микроба — возбудителя инфекционного процесса; 2) состояние макроорганизма, степень его восприимчивости к микробу; 3) действие физических, химических и биологических факторов окружающей микроб и макроорганизм внешней среды, которая и обуславливает возможность установления контактов между представителями разных видов, общность территории обитания разных видов, пищевые связи, плотность и численность популяций, особенности передачи генетической информации, особенности миграции и т. д. При этом по отношению к человеку под условиями внешней среды прежде всего следует понимать социальные условия его жизнедеятельности. Первые два биологических фактора являются непосредственными участниками инфекционного процесса, развивающегося в макроорганизме под действием микроба. При этом микроб определяет специфичность инфекционного процесса, а решающий интегральный вклад в форму проявления инфекционного процесса, его длительность, степень тяжести проявлений и исход вносит состояние макроорганизма, прежде всего факторы его неспецифической резистентности, на помощь которым приходят факторы специфического приобретенного иммунитета. Третий, экологический, фактор оказывает на инфекционный процесс опосредованное воздействие, снижая или повышая восприимчивость макроорганизма, либо снижая и повышая инфицирующую дозу и вирулентность возбудителя, активируя механизмы заражения и соответствующие им пути передачи инфекции, и т. д. |
№ 48 Формы инфекции.
В зависимости от свойств возбудителя, условий заражения, иммунологических особенностей макроорганизма формируются различные формы инфекционного процесса, который может протекать в виде носительства, латентной инфекции и инфекционной болезни. При носительстве возбудитель размножается, циркулирует в организме, происходит формирование иммунитета и очищение организма от возбудителя, но отсутствуют субъективные и клинически выявляемые симптомы болезни (нарушение самочувствия, лихорадка, интоксикация, признаки органной патологии). Такое течение инфекционного процесса характерно для ряда вирусных и бактериальных инфекций (вирусного гепатита А, полиомиелита, менингококковой инфекции и некоторых других). О подобном течении инфекционного процесса можно судить по наличию специфических антител у лиц, не имевших клинических проявлений данной инфекционной болезни и не иммунизированных против нее. В соответствии с носительством конкретных типов возбудителей применяют термины «бактерионосительство» («бациллоносительство»), «вирусоносительство», «гельминтоносительство». Термин «паразитоносительство» обозначает носительство патогенных паразитов вообще или носительство простейших. Различают следующие виды носительства: реконвалесцентное, иммунное, «здоровое», инкубационное, транзиторное. При латентной инфекции инфекционный процесс также длительно не проявляет себя клинически, но возбудитель сохраняется в организме, иммунитет не формируется и на определенном этапе при достаточно длительном сроке наблюдения возможно появление клинических признаков болезни. Такое течение инфекционного процесса наблюдается при туберкулезе, сифилисе, герпетической инфекции, цитомегаловирусной инфекции и др. Перенесенная в той или иной форме инфекции не всегда гарантирует от повторного заражения, особенно при генетической предрасположенности, обусловленной дефектами в системе специфических и неспецифических защитных механизмов, или кратковременности иммунитета. Повторное заражение и развитие инфекции, вызванной тем же возбудителем, обычно в форме клинически выраженной инфекционной болезни (например, при менингококковой инфекции, скарлатине, дизентерии, роже, называются реинфекцией. Одновременное возникновение двух инфекционных процессов называется микст-инфекцией. Возникновение инфекционного процесса, вызванного активацией нормальной флоры, населяющей кожу и слизистые оболочки, обозначается как аутоинфекция. Последняя развивается, как правило, в результате резкого ослабления защитных механизмов, в частности приобретенного иммунодефицита. Например в результате тяжелых оперативных вмешательств, соматических заболеваний, применения стероидных гормонов, антибиотиков широкого спектра действия с развитие дисбактериоза, лучевых поражений и др. Возможно также на фоне инфекции, вызванной одним возбудителем; заражение и развитие инфекционного процесса, вызванного другим видом возбудителя; в этих случаях говорят о суперинфекции. Для изучения патогенеза инфекции, разработки методов ее диагностики, лечения и профилактики широко используют экспериментальную инфекцию, т. е. воспроизведение инфекции на лабораторных животных. Несмотря на большое значение экспериментальной инфекции, полученные результаты применительно к человеку нуждаются в подтверждении в клинических условиях. |
№ 49 Стадии развития и характерные признаки инфекционной болезни.
Под инфекционной болезнью следует понимать индивидуальный случай определяемого лабораторно и/или клинически инфекционного состояния данного макроорганизма, обусловленного действием микробов и их токсинов, и сопровождающегося различными степенями нарушения гомеостаза. Это частный случай проявления инфекционного процесса у данного конкретного индивидуума. Об инфекционной болезни говорят тогда, когда происходит нарушение функции макроорганизма, сопровождающееся формированием патологического морфологического субстрата болезни. Для инфекционного заболевания характерны определенные стадии развития: 1. Инкубационный период — время, которое проходит с момента заражения до начала клинических проявлений болезни. В зависимости от свойств возбудителя, иммунного статуса макроорганизма, характера взаимоотношений между макро- и микроорганизмом инкубационный период может колебаться от нескольких часов до нескольких месяцев и даже лет; 2. Продромальный период — время появления первых клинических симптомов общего характера, неспецифических для данного заболевания, например слабость, быстрая утомляемость, отсутствие аппетита и т. д.; 3. Период острых проявлений заболевания — разгар болезни. В это время проявляются типичные для данного заболевания симптомы: температурная кривая, высыпания, местные поражения и т. п.; 4. Период реконвалесценции — период угасания и исчезновения типичных симптомов и клинического выздоровления. Не всегда клиническое выздоровление сопровождается освобождением макроорганизма от микроорганизмов. Иногда на фоне полного клинического выздоровления практически здоровый человек продолжает выделять в окружающую среду патогенные микроорганизмы, т.е. наблюдается острое носительство, иногда переходящее в хроническое носительство (при брюшном тифе — пожизненное). Заразность инфекционной болезни — свойство передавать возбудителя от инфицированного к здоровому восприимчивому организму. Инфекционные болезни характеризуются воспроизводством (размножением) заразного начала, способного вызвать инфекцию у восприимчивого организма. Инфекционные заболевания широко распространены среди населения. По массовости они занимают третье место после сердечно-сосудистых и онкологических болезней. Инфекционные болезни отрицательно влияют на здоровье людей и наносят значительный экономический ущерб. Существуют кризисные инфекционные болезни (например, ВИЧ-инфекция), которые в силу своей высокой эпидемичности и летальности угрожают всему человечеству. Инфекционные болезни различают по степени распространенности среди населения; условно их можно разделить на пять групп: • имеющие наибольшую распространенность (более 1000 случаев на 100 000 населения) — грипп, ОРВИ; • широко распространенные (более 100 случаев на 100 000 населения) — вирусный гепатит А, шигеллезы, острые кишечные заболевания неустановленной этиологии, скарлатина, краснуха, ветряная оспа, эпидемический паротит; • часто встречающиеся (10—100 случаев на 100 000 населения) — сальмонеллезы без брюшного тифа, гастроэнтероколиты установленной этиологии, вирусный гепатит В, коклюш, корь; • сравнительно малораспространенные (1—10 случаев на 100 000 населения) — брюшной тиф, паратифы, иерсиниозы, бруцеллез, менингококковая инфекция, клещевой энцефалит, геморрагические лихорадки; • редко встречающиеся (менее 1 случая на 100 000 населения) — полиомиелит, лептоспироз, дифтерия, туляремия, риккетсиозы, малярия, сибирская язва, столбняк, бешенство. |
|
|