ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 05.07.2024
Просмотров: 163
Скачиваний: 0
|
№ 72 Оценка иммунного статуса: основные показатели и методы их определения.
Несмотря на вариабельность иммунологических показателей в норме, иммунный статус можно определить путем постановки комплекса лабораторных тестов, включающих оценку состояния факторов неспецифической резистентности, гуморального (В-система) и клеточного (Т-система) иммунитета. Оценка иммунного статуса проводится в клинике при трансплантации органов и тканей, аутоиммунных заболеваниях, аллергиях, для выявления иммунологической недостаточности при различных инфекционных и соматических заболеваниях, для контроля эффективности лечения болезней, связанных с нарушениями иммунной системы. В зависимости от возможностей лаборатории оценка иммунного статуса чаше всего базируется на определении комплекса следующих показателей: 1) общего клинического обследования; 2) состояния факторов естественной резистентности; 3) гуморального иммунитета; 4) клеточного иммунитета; 5) дополнительных тестов. При общем клиническом обследовании учитывают жалобы пациента, анамнез, клинические симптомы, результаты общего анализа крови (включая абсолютное число лимфоцитов), данные биохимического исследования. Гуморальный иммунитет определяют по уровню иммуноглобулинов классов G, M, A, D, Е в сыворотке крови, количеству специфических антител, катаболизму иммуноглобулинов, гиперчувствительности немедленного типа, показателю В-лимфоцитов в периферической крови, бласттрансформации В-лимфоцитов под действием В-клеточных митогенов и другим тестам. Состояние клеточного иммунитета оценивают по количеству Т-лимфоцитов, а также субпопуляций Т-лимфоцитов в периферической крови, бласттрансформации Т-лимфоцитов под действием Т-клеточных митогенов, определению гормонов тимуса, уровню секретируемых цитокинов, а также постановкой кожных проб с аллергенами, контактной сенсибилизацией динитрохлорбензолом. Для постановки кожных аллергических проб используются антигены, к которым в норме должна быть сенсибилизация, например проба Манту с туберкулином. Способность организма к индукции первичного иммунного ответа может дать контактная сенсибилизация динитрохлорбензолом. В качестве дополнительных тестов для оценки иммунного статуса можно использовать такие тесты, как определение бактерицидное™ сыворотки крови, титрование СЗ-, С4-компонентов комплемента, определение содержания С-реактивного белка в сыворотке крови, определение ревматоидных факторов и других аутоантител. Таким образом, оценка иммунного статуса проводится на основании постановки большого числа лабораторных тестов, позволяющих оценить состояние как гуморального и клеточного звеньев иммунной системы, так и факторов неспецифической резистентности. Все тесты разделены на две группы: тесты 1-го и 2-го уровня. Тесты 1-го уровня могут быть выполнены в любой клинической иммунологической лаборатории первичного звена здравоохранения, они используются для первичного выявления лиц с явно выраженной иммунопатологией. Для более точной диагностики используются тесты 2-го уровня.
|
№ 73 Расстройства иммунной системы: первичные и вторичные иммунодефициты.
Иммунодефициты — это нарушения нормального иммунного статуса, обусловленные дефектом одного или нескольких механизмов иммунного ответа. Различают первичные, или врожденные (генетические), и вторичные, или приобретенные, иммунодефициты. Первичные, или врожденные, иммунодефициты. В качестве первичных иммунодефицитов выделяют такие состояния, при которых нарушение иммунных гуморальных и клеточных механизмов связано с генетическим блоком, т. е. генетически обусловлено неспособностью организма реализовывать то или иное звено иммунологической реактивности. Расстройства иммунной системы могут затрагивать как основные специфические звенья в функционировании иммунной системы, так и факторы, определяющие неспецифическую резистентность. Возможны комбинированные и селективные варианты иммунных расстройств. В зависимости от уровня и характера нарушений различают гуморальные, клеточные и комбинированные иммунодефициты. Врожденные иммунодефицитные синдромы и заболевания представляют собой довольно редкое явление. Причинами врожденных иммунодефицитов могут быть удвоение хромосом, точечные мутации, дефект ферментов обмена нуклеиновых кислот, генетически обусловленные нарушения мембран, повреждения генома в эмбриональном периоде и др. Как правило, первичные иммунодефицита проявляются на ранних этапах постнатального периода и наследуются по аутосомно-рецессивному типу. Проявляться первичные иммунодефициты могут в виде недостаточности фагоцитоза, системы комплемента, гуморального иммунитета (В-системы), клеточного иммунитета (Т-системы) или же в виде комбинированной иммунологической недостаточности. Вторичные, или приобретенные, иммунодефициты Вторичные иммунодефициты в отличие от первичных развиваются у лиц с нормально функционировавшей от рождения иммунной системой. Они формируются под воздействием окружающей среды на уровне фенотипа и обусловлены нарушением функции иммунной системы в результате различных заболеваний или неблагоприятных воздействий на организм. При вторичных иммунодефицитах могут поражаться Т- и В-системы иммунитета, факторы неспецифической резистентности, возможны также их сочетания. Вторичные иммунодефицита встречаются значительно чаще, чем первичные. Вторичные иммунодефицита, как правило, преходящи и поддаются иммунокоррекции, т. е. восстановлению нормальной деятельности иммунной системы. Вторичные иммунодефицита могут быть: после перенесенных инфекций (особенно вирусных) и инвазий (протозойные и гельминтозы); при ожоговой болезни; при уремии; при опухолях; при нарушении обмена веществ и истощении; при дисбиозах; при тяжелых травмах, обширных хирургических операциях, особенно выполняемых под общим наркозом; при облучении, действии химических веществ; при старении, а также медикаментозные, связанные с приемом лекарств. По времени возникновения выделяют антенатальные (например, ненаследственные формы синдрома ДиДжорджи), перинатальные (например, нейтропения новорожденного, вызванная изосенсибилизацией матери к антигенам нейтрофилов плода) и постнатальные вторичные иммунодефицита. По клиническому течению выделяют компенсированную, субкомпенсированную и декомпенсированную формы вторичных иммуноде-фицитов. Компенсированная форма сопровождается повышенной восприимчивостью организма к инфекционным агентам, вызывающим оппортунистические инфекции. Субкомпенсированная форма характеризуется склонностью к хронизации инфекционных процессов. Декомпенсированная форма проявляется в виде генерализованных инфекций, вызванных условно-патогенными микробами (УПМ) и злокачественными новообразованиями. Известно разделение вторичных иммунодефицитов на: Физиологические, новорожденные, пубертатного периода, беременности и лактации, старения, биоритмичности, экологические, сезонные, эндогенные интоксикации, радиационные, СВЧ, патологические, постинфекционные, стрессовые, регуляторно-метаболические, медикаментозные, онкологические. Иммунодефициты, как первичные, так и особенно вторичные, широко распространены среди людей. Они являются причиной проявления многих болезней и патологических состояний, поэтому требуют профилактики и лечения с помощью иммунотропных препаратов. |
№ 74 Реакция агглютинации. Компоненты, механизм, способы постановки. Применение.
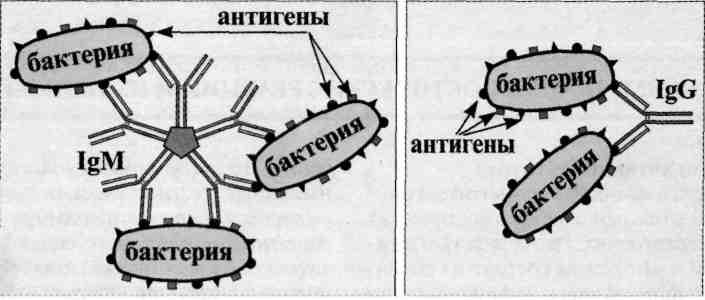
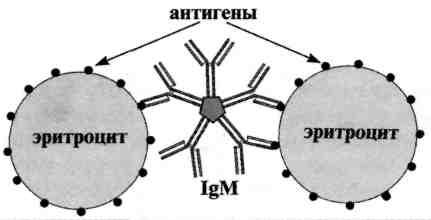
Реакция агглютинации — простая по постановке реакция, при которой происходит связывание антителами корпускулярных антигенов (бактерий, эритроцитов или других клеток, нерастворимых частиц с адсорбированными на них антигенами, а также макромолекулярных агрегатов). Она протекает при наличии электролитов, например при добавлении изотонического раствора натрия хлорида. Применяются различные варианты реакции агглютинации: развернутая, ориентировочная, непрямая и др. Реакция агглютинации проявляется образованием хлопьев или осадка (клетки, «склеенные» антителами, име ющими два или более антигенсвязывающих центра — рис. 13.1). РА используют для: 1) определения антител в сыворотке крови больных, например, при бруцеллезе (реакции Райта, Хеддельсона), брюшном тифе и паратифах (реакция Видаля) и других инфекционных болезнях; 2) определения возбудителя, выделенного от больного; 3) определения групп крови с использованием моноклональных антител против алло-антигенов эритроцитов. Для определения у больного антител ставят развернутую реакцию агглютинации: к разведениям сыворотки крови больного добавляют диагностикум (взвесь убитых микробов,) и через несколько часов инкубации при 37 ˚С отмечают наибольшее разведение сыворотки (титр сыворотки), при котором произошла агглютинация, т. е. образовался осадок. Характер и скорость агглютинации зависят от вида антигена и антител. Примером являются особенности взаимодействия диагностикумов (О- и H-антигенов) со специфическими антителами. Реакция агглютинации с О-диагностикумом (бактерии, убитые нагреванием, сохранившие термостабильный О-антиген) происходит в виде мелкозернистой агглютинации. Реакция агглютинации с Н-диагностикумом (бактерии, убитые формалином, сохранившие термолабильный жгутиковый Н-антиген) — крупнохлопчатая и протекает быстрее. Если необходимо определить возбудитель, выделенный от больного, ставят ориентировочную реакцию агглютинации, применяя диагностические антитела (агглютинирующую сыворотку), т. е. проводят серотипирование возбудителя. Ориентировочную реакцию проводят на предметном стекле. К капле диагностической агглютинирующей сыворотки в разведении 1:10 или 1:20 добавляют чистую культуру возбудителя, выделенного от больного. Рядом ставят контроль: вместо сыворотки наносят каплю раствора натрия хлорида. При появлении в капле с сывороткой и микробами хлопьевидного осадка ставят развернутую реакцию агглютинации в пробирках с увеличивающимися разведениями агглютинирующей сыворотки, к которым добавляют по 2—3 капли взвеси возбудителя. Агглютинацию учитывают по количеству осадка и степени просветления жидкости. Реакцию считают положительной, если агглютинация отмечается в разведении, близком к титру диагностической сыворотки. Одновременно учитывают контроли: сыворотка, разведенная изотоническим раствором натрия хлорида, должна быть прозрачной, взвесь микробов в том же растворе — равномерно мутной, без осадка. Разные родственные бактерии могут агглютинироваться одной и той же диагностической агглютинирующей сывороткой, что затрудняет их идентификацию. Поэтому пользуются адсорбированными агглютинирующими сыворотками, из которых удалены перекрестно реагирующие антитела путем адсорбции их родственными бактериями. В таких сыворотках сохраняются антитела, специфичные только к данной бактерии.
|
|
№ 75 Реакция Кумбса. Механизм. Компоненты. Применение.
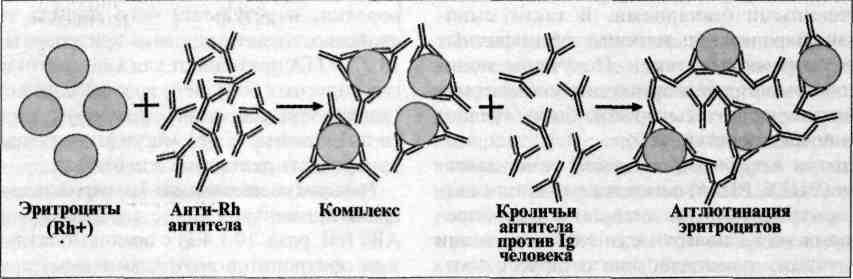
Реакцию агглютинации для определения антирезусных антител (непрямую реакцию Кумбса) применяют у больных при внутрисосудистом гемолизе. У некоторых таких больных обнаруживают антирезусные антитела, которые являются неполными, одновалентными. Они специфически взаимодействуют с резус-положительными эритроцитами, но не вызывают их агглютинации. Наличие таких неполных антител определяют в непрямой реакции Кумбса. Для этого в систему антирезусные антитела + резус-положительные эритроциты добавляют антиглобулиновую сыворотку (антитела против иммуноглобулинов человека), что вызывает агглютинацию эритроцитов. С помощью реакции Кумбса диагностируют патологические состояния, связанные с внутрисосудистым лизисом эритроцитов иммунного генеза, например гемолитическую болезнь новорожденных: эритроциты резус-положительного плода соединяются с циркулирующими в крови неполными антителами к резус-фактору, которые перешли через плаценту от резус-отрицательной матери. Механизм. Сложность выявления неполных (моновалентных) антител связана с тем, что эти антитела, связываясь с эпитопами специфического антигена, не образуют структуру решетки и реакция между антигенами и антителами не выявляется ни агглютинацией, ни преципитацией, ни другими тестами. Для выявления образовавшихся комплексов антиген — антитело приходится использовать дополнительные тест-системы. Для выявления неполных антител, например к резус-антигену эритроцитов в сыворотке крови беременной женщины, реакция ставится в два этапа: 1) к двукратным разведениям испытуемой сыворотки добавляют эритроциты, содержащие резус-антиген, и выдерживают при 37 °С в течение часа; 2) к тщательно отмытым после первого этапа эритроцитам добавляют кроличью античеловеческую анти-глобулиновую сыворотку (в заранее оттитрованном рабочем разведении). После инкубации в течение 30 мин при 37 °С результаты оценивают по наличию гемагглютинации (положительная реакция). Необходимо ставить контроль ингредиентов реакции: 1) антиглобулиновая сыворотка + заведомо сенсибилизированные специфическими антителами эритроциты; 2) обработанные нормальной сывороткой эритроциты + антиглобулиновая сыворотка; 3) обработанные исследуемой сывороткой резус-отрицательные эритроциты + антиглобулиновая сыворотка.
|
№ 76 Реакция пассивной гемагглютинации. Компоненты. Применение.
Реакция непрямой (пассивной) гемагглютинации (РНГА, РПГА) основана на использовании эритроцитов (или латекса) с адсорбированными на их поверхности антигенами или антителами, взаимодействие которых с соответствующими антителами или антигенами сыворотки крови больных вызывает склеивание и выпадение эритроцитов на дно пробирки или ячейки в виде фестончатого осадка. Компоненты. Для постановки РНГА могут быть использованы эритроциты барана, лошади, кролика, курицы, мыши, человека и другие, которые заготавливают впрок, обрабатывая формалином или глютаральдегидом. Адсорбционная емкость эритроцитов увеличивается при обработке их растворами танина или хлорида хрома. Антигенами в РНГА могут служить полисахаридные АГ микроорганизмов, экстракты бактериальных вакцин, АГ вирусов и риккетсий, а также другие вещества. Эритроциты, сенсибилизированные АГ, называются эритроцитарными диагностикумами. Для приготовления эритроцитарного диагностикума чаще всего используют эритроциты барана, обладающие высокой адсорбирующей активностью. Применение. РНГА применяют для диагностики инфекционных болезней, определения гонадотропного гормона в моче при установлении беременности, для выявления повышенной чувствительности к лекарственным препаратам, гормонам и в некоторых других случаях. Механизм. Реакция непрямой гемагглютинации (РНГА) отличается значительно более высокой чувствительностью и специфичностью, чем реакция агглютинации. Ее используют для идентификации возбудителя по его антигенной структуре или для индикации и идентификации бактериальных продуктов — токсинов в исследуемом патологическом материале. Соответственно используют стандартные (коммерческие) эритроцитарные антительные диагностикумы, полученные путем адсорбции специфических антител на поверхности танизированных (обработанных танином) эритроцитов. В лунках пластмассовых пластин готовят последовательные разведения исследуемого материала. Затем в каждую лунку вносят одинаковый объем 3 % суспензии нагруженных антителами эритроцитов. При необходимости реакцию ставят параллельно в нескольких рядах лунок с эритроцитами, нагруженными антителами разной групповой специфичности. Через 2 ч инкубации при 37 °С учитывают результаты, оценивая внешний вид осадка эритроцитов (без встряхивания): при отрицательной реакции появляется осадок в виде компактного.диска или кольца на дне лунки, при положительной реакции — характерный кружевной осадок эритроцитов, тонкая пленка с неровными краями.
|
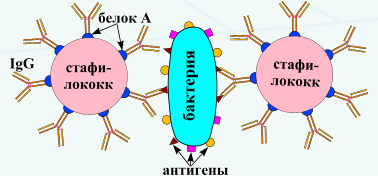
№ 77 Реакция коагглютинации. Механизм, компоненты. Применение.
Реакцию коагглютинации применяют для определения антигенов с помощью антител, адсорбированных на белке А клеток стафилококка (антительный диагностикум). Белок А имеет сродство к Fc-фрагменту иммуноглобулинов, поэтому такие бактерии, обработанные иммунной диагностической сывороткой неспецифически адсорбируют антитела сыворотки, которые затем взаимодействуют активными центрами с соответствующими микробами, выделенными от больных. В результате коагглютинации образуются хлопья, состоящие из стафилококков, антител диагностической сыворотки и определяемого микроба. Механизм. Основан на том, что находящийся на поверхности золотистого стафилококка белок А селективно реагирует с Fc-фрагментом IgGl, G2, G4, оставляя свободными антидетерминанты Ат, которые, взаимодействуя с гомологичным Аг, вызывают агглютинацию стафилококков. Для постановки КОА применяют коммерческие стафилококковые реагенты, содержащиеся в ампулах или высушенные в лунках полистироловых пластин или предметных стекол. К реагенту добавляют 0,01-0,1 мл исследуемой культуры или растворимого Аг, инкубируют при комнатной температуре 10-30 мин (в условиях постановки реакции на стекле) или 18 -20 ч (в условиях постановки реакции в капиллярах). Учет проводят так же, как при обычной РА. Агглютинацию учитывают по количеству осадка и степени просветления жидкости. Реакцию считают положительной, если агглютинация отмечается в разведении, близком к титру диагностической сыворотки. Одновременно учитывают контроли: сыворотка, разведенная изотоническим раствором натрия хлорида, должна быть прозрачной, взвесь микробов в том же растворе — равномерно мутной, без осадка.
|
|
|
||
|
|
|
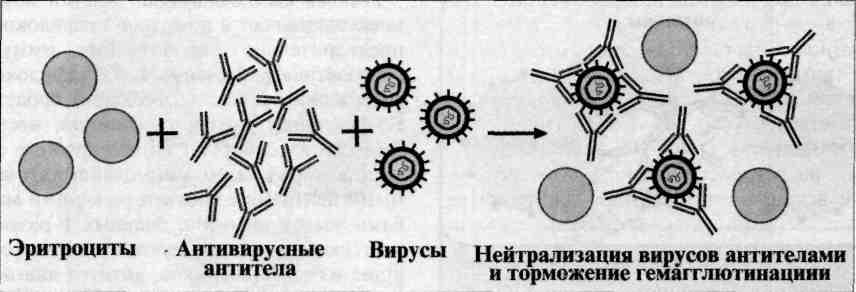
№ 78 Реакция торможения гемагглютинации. Механизм. Компоненты. Применение.
Реакция торможения гемагглютинации (РТГА) - метод идентификации вируса или выявления противовирусных антител в сыворотке крови больного, основанный на феномене отсутствия агглютинации эритроцитов препаратом, содержащим вирус, в присутствии иммунной к нему сыворотки крови. Реакция торможения гемагглютинации (РТГА) основана на блокаде, подавлении антигенов вирусов антителами иммунной сыворотки, в результате чего вирусы теряют свойство агглютинировать эритроциты. РТГА применяют для диагностики многих вирусных болезней, возбудители которых (вирусы гриппа, кори, краснухи, клещевого энцефалита и др.) могут агглютинировать эритроциты различных животных. Механизм. Типирование вируса проводят в реакции торможения гемаг-глютинации (РТГА) с набором типоспецифических сывороток. Результаты реакции учитывают по отсутствию гемагглютинации. Подтипы вируса А с антигенами H0N1, H1N1, Н2N2, H3N2 и др. могут быть дифференцированы в РТГА с набором гомологичных типоспецифических сывороток.
|
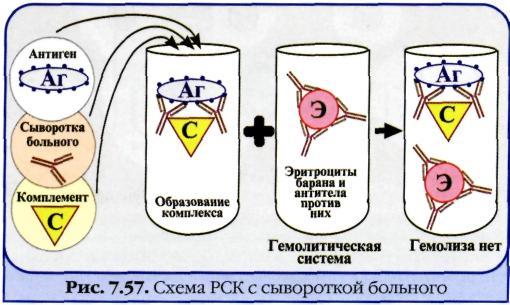
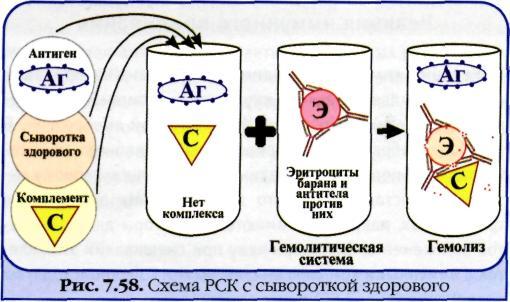
№ 80 Реакция связывания комплемента. Механизм. Компоненты. Применение.
Реакция связывания комплемента (РСК) заключается в том, что при соответствии друг другу антигены и антитела образуют иммунный комплекс, к которому через Fc-фрагмент антител присоединяется комплемент (С), т. е. происходит связывание комплемента комплексом антиген—антитело. Если же комплекс антиген—антитело не образуется, то комплемент остается свободным. Специфическое взаимодействие АГ и AT сопровождается адсорбцией (связыванием) комплемента. Поскольку процесс связывания комплемента не проявляется визуально, Ж. Борде и О.Жангу предложили использовать в качестве индикатора гемолитическую систему (эритроциты барана + гемолитическая сыворотка), которая показывает, фиксирован ли комплемент комплексом АГ-АТ. Если АГ и AT соответствуют друг другу, т. е. образовался иммунный комплекс, то комплемент связывается этим комплексом и гемолиза не происходит. Если AT не соответствует АГ, то комплекс не образуется и комплемент, оставаясь свободным, соединяется со второй системой и вызывает гемолиз. Компоненты. Реакция связывания комплемента (РСК) относится к сложным серологическим реакциям. Для ее проведения необходимы 5 ингредиентов, а именно: АГ, AT и комплемент (первая система), эритроциты барана и гемолитическая сыворотка (вторая система). Антигеном для РСК могут быть культуры различных убитых микроорганизмов, их лизаты, компоненты бактерий, патологически измененных и нормальных органов, тканевых липидов, вирусы и вирусосодержащие материалы. В качестве комплемента используют свежую или сухую сыворотку морской свинки. Механизм. РСК проводят в две фазы: 1-я фаза — инкубация смеси, содержащей три компонента антиген + антитело + комплемент; 2-я фаза (индикаторная) — выявление в смеси свободного комплемента путем добавления к ней гемолитической системы, состоящей из эритроцитов барана, и гемолитической сыворотки, содержащей антитела к ним. В 1-й фазе реакции при образовании комплекса антиген—антитело происходит связывание им комплемента, и тогда во 2-й фазе гемолиз сенсибилизированных антителами эритроцитов не произойдет; реакция положительная. Если антиген и антитело не соответствуют друг другу (в исследуемом образце нет антигена или антитела), комплемент остается свободным и во 2-й фазе присоединится к комплексу эритроцит — ан-тиэритроцитарное антитело, вызывая гемолиз; реакция отрицательная. Применение. РСК применяют для диагностики многих инфекционных болезней, в частности сифилиса (реакция Вассермана).
|
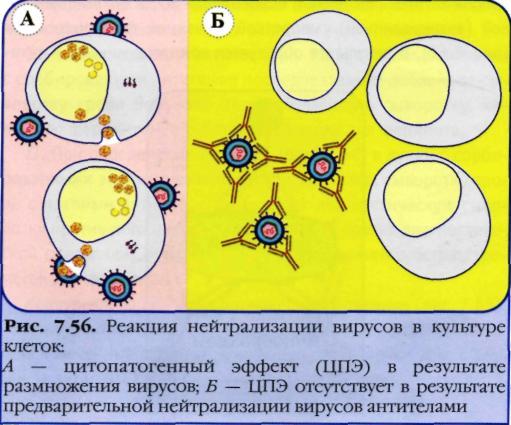
№ 81 Реакция нейтрализации токсина антитоксином. Механизм. Способы постановки, применение.
В основе этой реакции лежит способность специфической антитоксической сыворотки нейтрализовать экзотоксин. Антитела иммунной сыворотки способны нейтрализовать повреждающее действие микробов или их токсинов на чувствительные клетки и ткани, что связано с блокадой микробных антигенов антителами, т. е. их нейтрализацией. Реакцию нейтрализации (РН) проводят путем введения смеси антиген—антитело животным или в чувствительные тест-объекты (культуру клеток, эмбрионы). При отсутствии у животных и тест-объектов повреждающего действия микроорганизмов или их антигенов, токсинов говорят о нейтрализующем действии иммунной сыворотки и, следовательно, о специфичности взаимодействия комплекса антиген—антитело. Для проведения реакции исследуемый материал, в котором предполагается наличие экзотоксина, смешивают с антитоксической сывороткой, выдерживают в термостате и вводят животным (морским свинкам, мышам). Контрольным животным вводят фильтрат исследуемого материала, не обработанный сывороткой. В том случае, если произойдет нейтрализация экзотоксина антитоксической сывороткой, животные опытной группы останутся живыми. Контрольные животные погибнут в результате действия экзотоксина.
|
|
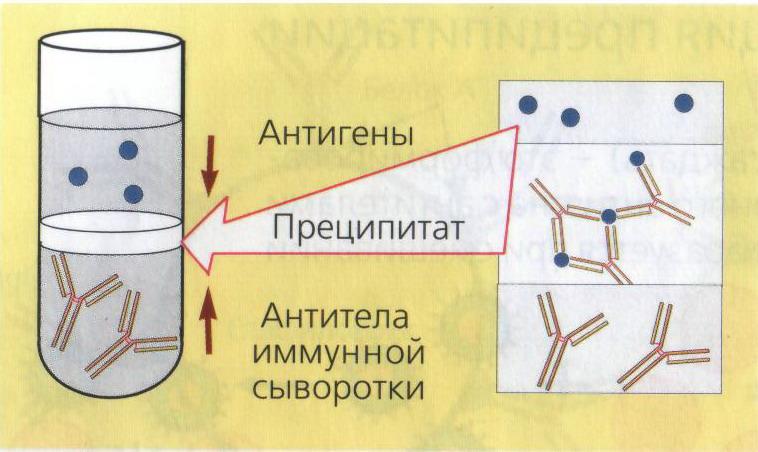
№ 79 Реакция преципитации. Механизм. Компоненты. Способы постановки. Применение.
Реакция преципитации (РП) - это формирование и осаждение комплекса растворимого молекулярного антигена с антителами в виде помутнения, называемого преципитатом. Он образуется при смешивании антигенов и антител в эквивалентных количествах; избыток одного из них снижает уровень образования иммунного комплекса. РП ставят в пробирках (реакция кольцепреципитации), в гелях, питательных средах и др. Широкое распространение получили разновидности РП в полужидком геле агара или агарозы: двойная иммунодиффузия по Оухтерлони, радиальная иммунодиффузия, иммуноэлектрофорез и др. Механизм. Проводится с прозрачными коллоидными растворимыми антигенами, экстрагированными из патологического материала, объектов внешней среды или чистых культур бактерий. В реакции используют прозрачные диагностические преципитирующие сыворотки с высокими титрами антител. За титр преципитирующей сыворотки принимают то наибольшее разведение антигена, которое при взаимодействии с иммунной сывороткой вызывает образование видимого преципитата — помутнение. Реакция кольцепреципитации ставится в узких пробирках (диаметр 0,5 см), в которые вносят по 0,2—0,3 мл преципити-рующей сыворотки. Затем пастеровской пипеткой медленно наслаивают 0,1—0,2 мл раствора антигена. Пробирки осторожно переводят в'вертикальное положение. Учет реакции производят через 1—2 мин. В случае положительной реакции на границе между сывороткой и исследуемым антигеном появляется преципитат в виде белого кольца. В контрольных пробирках преципитат не образуется.
|
||
|
|
||
|
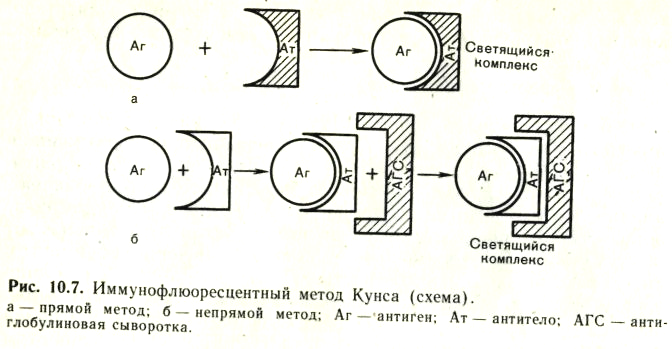
№ 82 Реакция иммунофлюоресценции. Механизм, компоненты, применение.
Иммунофлюоресцентный метод (РИФ, реакция иммунофлюоресценции, реакция Кунса) - метод выявления специфических Аг с помощью Ат, конъюгированных с флюорохромом. Обладает высокой чувствительностью и специфичностью. Применяется для экспресс-диагностики инфекционных заболеваний (идентификация возбудителя в исследуемом материале), а также для определения Ат и поверхностных рецепторов и маркеров лейкоцитов (иммунофенотипирование) и др. клеток. Обнаружение бактериальных и вирусных антигенов в инфекционных материалах, тканях животных и культурах клеток при помощи флюоресцирующих антител (сывороток) получило широкое применение в диагностической практике. Приготовление флюоресцирующих сывороток основано на способности некоторых флюорохромов (например, изотиоцианата флюоресцеина) вступать в химическую связь с сывороточными белками, не нарушая их иммунологической специфичности. Различают три разновидности метода: прямой, непрямой, с комплементом. Прямой метод РИФ основан на том, что антигены тканей или микробы, обработанные иммунными сыворотками с антителами, меченными флюорохромами, способны светиться в УФ-лучах люминесцентного микроскопа. Бактерии в мазке, обработанные такой люминесцирующей сывороткой, светятся по периферии клетки в виде каймы зеленого цвета. Непрямой метод РИФ заключается в выявлении комплекса антиген - антитело с помощью антиглобулиновой (против антитела) сыворотки, меченной флюорохромом. Для этого мазки из взвеси микробов обрабатывают антителами антимикробной кроличьей диагностической сыворотки. Затем антитела, не связавшиеся антигенами микробов, отмывают, а оставшиеся на микробах антитела выявляют, обрабатывая мазок антиглобулиновой (антикроличьей) сывороткой, меченной флюорохромами. В результате образуется комплекс микроб + антимикробные кроличьи антитела + антикроличьи антитела, меченные флюорохромом. Этот комплекс наблюдают в люминесцентном микроскопе, как и при прямом методе. Механизм. На предметном стекле готовят мазок из исследуемого материала, фиксируют на пламени и обрабатывают иммунной кроличьей сывороткой, содержащей антитела против антигенов возбудителя. Для образования комплекса антиген — антитело препарат помещают во влажную камеру и инкубируют при 37 °С в течение 15 мин, после чего тщательно промывают изотоническим раствором хлорида натрия для удаления не связавшихся с антигеном антител. Затем на препарат наносят флюоресцирующую антиглобулиновую сыворотку против глобулинов кролика, выдерживают в течение 15 мин при 37 °С, а затем препарат тщательно промывают изотоническим раствором хлорида натрия. В результате связывания флюоресцирующей антиглобулиновой сыворотки с фиксированными на антигене специфическими анти телами образуются светящиеся комплексы антиген — антитело, которые обнаруживаются при люминесцентной микроскопии.
|
№ 83 Иммуноферментный анализ, иммуноблоттинг. Механизм, компоненты, применение.
Иммуноферментный анализ или метод — выявление антигенов с помощью соответствующих им антител, конъюгированных с ферментом-меткой (пероксидазой хрена, бета-галактозидазой или щелочной фосфатазой). После соединения антигена с меченной ферментом иммунной сывороткой в смесь добавляют субстрат/хромоген. Субстрат расщепляется ферментом и изменяется цвет продукта реакции — интенсивность окраски прямо пропорциональна количеству связавшихся молекул антигена и антител. ИФА применяют для диагностики вирусных, бактериальных и паразитарных болезней, в частности для диагностики ВИЧ-инфекций, гепатита В и др., а также определения гормонов, ферментов, лекарственных препаратов и других биологически активных веществ, содержащихся в исследуемом материале в минорных концентрациях (1010-1012 г/л). Твердофазный ИФА — вариант теста, когда один из компонентов иммунной реакции (антиген или антитело) сорбирован на твердом носителе, напр., в лунках планшеток из полистирола. Компоненты выявляют добавлением меченых антител или антигенов. При положительном результате изменяется цвет хромогена. Каждый раз после добавления очередного компонента из лунок удаляют несвязавшиеся реагенты путем промывания, I. При определении антител (левый рисунок) в лунки планшеток с сорбированным антигеном последовательно добавляют сыворотку крови больного, антиглобулиновую сыворотку, меченную ферментом, и субстрат/хромоген для фермента.
I Конкурентный ИФА для определения антигенов: искомый антиген и меченный ферментом антиген конкурируют друг с другом за связывание ограниченного количества антител иммунной сыворотки. Другой тест - Конкурентный ИФА для определения антител: искомые антитела и меченные ферментом антитела конкурируют друг с другом за антигены, сорбированные на твердой фазе. Иммуноблоттинг — высокочувствительный метод выявления белков, основанный на сочетании электрофореза и ИФА или РИА. Иммуноблоттинг используют как диагностический метод при ВИЧ-инфекции и др. Антигены возбудителя разделяют с помощью электрофореза в полиакриламидном геле, затем переносят их из геля на активированную бумагу или нитроцеллюлозную мембрану и проявляют с помощью ИФА. Фирмы выпускают такие полоски с «блотами» антигенов. На эти полоски наносят сыворотку больного. Затем, после инкубации, отмывают от несвязавшихся антител больного и наносят сыворотку против иммуноглобулинов человека, меченную ферментом. Образовавшийся на полоске комплекс [антиген + антитело больного + антитело против Ig человека] выявляют добавлением хромогенного субстрата, изменяющего окраску под действием фермента. |
№ 84 Серологические реакции, используемые для диагностики вирусных инфекций.
Иммунные реакции используют при диагностических и иммунологических исследованиях у больных и здоровых людей. С этой целью применяют серологические методы, т. е. методы изучения антител и антигенов с помощью реакций антиген—антитело, определяемых в сыворотке крови и других жидкостях, а также тканях организма. Обнаружение в сыворотке крови больного антител против антигенов возбудителя позволяет поставить диагноз болезни. Серологические исследования применяют также для идентификации антигенов микробов, различных биологически активных веществ, групп крови, тканевых и опухолевых антигенов, иммунных комплексов, рецепторов клеток и др. При выделении микроба от больного проводят идентификацию возбудителя путем изучения его антигенных свойств с помощью иммунных диагностических сывороток, т. е. сывороток крови гипериммунизированных животных, содержащих специфические антитела. Это так называемая серологическая идентификация микроорганизмов. В микробиологии и иммунологии широко применяются реакции агглютинации, преципитации, нейтрализации, реакции с участием комплемента, с использованием меченых антител и антигенов (радиоиммунологический, иммуноферментный, иммунофлюоресцентный методы). Перечисленные реакции различаются по регистрируемому эффекту и технике постановки, однако, все они основаны на реакции взаимодействия антигена с антителом и применяются для выявления как антител, так и антигенов. Реакции иммунитета характеризуются высокой чувствительностью и специфичностью. Особенности взаимодействия антитела с антигеном являются основой диагностических реакций в лабораториях. Реакция in vitro между антигеном и антителом состоит из специфической и неспецифической фазы. В специфическую фазу происходит быстрое специфическое связывание активного центра антитела с детерминантой антигена. Затем наступает неспецифическая фаза — более медленная, которая проявляется видимыми физическими явлениями, например образованием хлопьев (феномен агглютинации) или преципитата в виде помутнения. Эта фаза требует наличия определенных условий (электролитов, оптимального рН среды). Связывание детерминанты антигена (эпитопа) с активным центром Fab-фрагмента антител обусловлено ван-дер-ваальсовыми силами, водородными связями и гидрофобным взаимодействием. Прочность и количество связавшегося антигена антителами зависят от аффинности, авидности антител и их валентности. |
|
|
|
№ 85 Диагностикумы. Получение, применение.
В диагностических целях при обнаружении антител в сыворотке крови больных, реконвалесцентов и бактерионосителей используются серологические реакции. Для постановки таких реакций применяются диагностикумы - препараты, содержащие взвесь обезвреженных микроорганизмов или определенные антигены. Необходимость использования диагностикумов для серологических реакций связана не только с явным их преимуществом перед живыми культурами микробов (безопасность в работе), но еще и потому, что для приготовления диагностикумов подбираются штаммы микроорганизмов с высокой чувствительностью к антителам и способностью длительно сохранять антигенные свойства. Для инактивации микроорганизмов при приготовлении диагностикумов чаще всего используются химические вещества, особенно формалин, являющийся лучшим консервантом. Убитые нагреванием микробы хуже сохраняют антигенные свойства и применяются редко. В серологических реакциях (реакции агглютинации, реакции пассивной гемагглютинации, реакции связывания комплемента, реакции торможения гемагглютинации) для выявления специфических антител применяются: бактериальные, эритроцитарные и вирусные диагностикумы. Бактериальные диагностикумы могут содержать инактивированную микробную взвесь или отдельные антигенные компоненты бактерий: О, Н или Vi-антигены и используются в реакциях агглютинации. Эритроцитарные диагностикумы представляют собой эритроциты (обработанные танином или формалином) с адсорбированными на них антигенами, извлеченными из бактерий, и применяются в РПГА (реакции пассивной гемагглютинации). В том случае, когда РПГА используется для выявления антигена в выделениях больных, в тканях и др., применяют «антительные диагностикумы», т. е. эритроциты, сенсибилизированные антителами. Вирусные диагностикумы — препараты, содержащие инактированные вируссодержащие жидкости (культуральные, из куриных эмбрионов или организма животных, зараженных соответствующим вирусом), применяются в РСК (реакции связывания комплемента), реакции торможения гемагглютинации (РТГА) и реакции нейтрализации. В настоящее время в лабораториях используются следующие диагноста кумы. 1. Бактериальный диагностикум сальмонелл тифа. Применяется в реакции агглютинации для обнаружения антител в сыворотке больных. 2. Сальмонеллезные О-диагностикумы содержат О-антигены различных групп сальмонелл (инактивированных 15%-ным раствором глицерина). Применяются для выявления О-аптител при сальмонеллезных инфекциях в реакции агглютинации с сывороткой больных. 3. Сальмонеллезные Н-монодиагностикумы. Используются в реакции агглютинации для определения заболевания в прошлом (анамнестическая реакция агглютинации) и реже с диагностической целью. 4. Vi — брюшнотифозный диагностикум. Применяется в реакции агглютинации при выявлении брюшнотифозного бактерионосительства. 5. Единый бруцеллезный диагностикум — взвесь бруцелл (инактивированных фенолом), подкрашенная метиленовым синим. Применяется для определения антител в сыворотках крови больных бруцеллезом людей и животных в реакциях агглютинации Райта и Хеддльсона. 6. Эритроцитарный сальмонеллезный О-диагностикум — взвесь эритроцитов с адсорбированными на них О-антигенами различных групп сальмонелл. Используется для постановки РПГА с сывороткой больного при уточнении клинического диагноза сальмонеллеэной инфекции. 7. Эритроцитарный Vi-диагностикум — эритроциты, сенсибилизированные очищенным Vi-антигеиом S. typhi, применяется в РПГА при выявлении брюшнотифозного бактерионосительства. 8. Гриппозный диагностикум представляет собой аллантоисную жидкость инфицированных вирусом гриппа (типов А, В) куриных эмбрионов и инактивированную мертиолатом или формалином. Диагностикумы необходимы при постановке РТГА с парными сыворотками больных для уточнения клинического диагноза и циркулирующего типа вируса гриппа. 9. Диагностикум вируса клещевого энцефалита получают из суспензии мозга белых мышей, зараженных вирусом клещевого энцефалита. Суспензию подвергают центрифугированию (для осветлення) и инактивируют химическими веществами. Диагностикум используется в РТГА и РСК с сывороткой больных при диагностике заболевания. |
№ 86 Моноклональные антитела. Получение, применение.
Моноклональные антитела. Каждый В-лимфоцит и его потомки, образовавшиеся в результате пролиферации (т.е. клон), способны синтезировать антитела с паратопом строго определенной специфичности. Такие антитела получили название моноклональных. В природных условиях макроорганизма получить моноклональные антитела практически невозможно. Дело в том, что на одну и ту же антигенную детерминанту одновременно реагируют до 100 различных клонов В-лимфоцитов, незначительно различающихся антигенной специфичностью рецепторов и, естественно, аффинностью. Поэтому в результате иммунизации даже монодетерминантным антигеном мы всегда получаем политональные антитела. Принципиально получение моноклональных антител выполнимо, если провести предварительную селекцию антителопродуцирующих клеток и их клонирование (т.е. выделение отдельных клонов в чистые культуры). Однако задача осложняется тем, что В-лимфоциты, как и другие эукариотические клетки, имеют ограниченную продолжительность жизни и число возможных митотических делений. Проблема получения моноклональных антител была успешно решена Д. Келлером и Ц. Милыптейном. Авторы получили гибридные клетки путем слияния иммунных В-лимфоцитов с миеломной (опухолевой) клеткой. Полученные гибриды обладали специфическими свойствами антителопро-дуцента и «бессмертием» раковотрансформированной клетки. Такой вид клеток получил название гибридом. Гибридома хорошо размножается в искусственных питательных средах и в организме животных и в неограниченном количестве вырабатывает антитела. В результате дальнейшей селекции были отобраны отдельные клоны гибридных клеток, обладавшие наивысшей продуктивностью и наибольшей аффинностью специфических антител. Гибридомы, продуцирующие моноклональые антитела, размножают или в аппаратах, приспособленных для выращивания культур клеток или же вводя их внутрибрюшинно особой линии (асцитным) мышам. В последнем случае моноклональные антитела накапливаются в асцитной жидкости, в которой размножаются губридомы. Полученные как тем, так и другим способом моноклональные антитела подвергают очистке, стандартизации и используют для создания на их основе диагностических препаратов. Гибридомные моноклональные антитела нашли широкое применение при создании диагностических и лечебных иммунобиологических препаратов. |
№ 87 Методы приготовления и применения агглютинирующих, адсорбированных сывороток.
В диагностике инфекционных болезней широко применяются иммунные реакции при идентификации возбудителя: при установлении родовой, видовой и типовой принадлежности микроба (вируса). Для постановки таких реакций необходимы специфические диагностические сыворотки, которые в зависимости от содержания соответствующих антител называются агглютинирующие, преципитирующие, гемолитические, противовирусные. Агглютинирующие сыворотки. Агглютинирующую сыворотку получают иммунизацией Кроликов (внутривенно, подкожно или внутрибрюшинно) взвесью убитых бактерий, начиная с дозы 200 млн., затем 500 млн., 1 млрд., 2 млрд., микробных тел в 1 мл, с интервалами 5 дней. Через 7—8 дней после последней иммунизации берут кровь и определяют титр антител. Титром агглютинирующей сыворотки называется то максимальное разведение сыворотки, при котором происходит агглютинация с соответствующим микроорганизмом. Агглютинирующие сыворотки применяются при идентификации микроба в развернутой реакции агглютинации. Если изучаемый микроорганизм агглютинируется сывороткой до титра или до половины значения титра, его можно считать принадлежащим к тому виду, название которого указано на этикетке ампулы. Неадсорбированные агглютинирующие сыворотки обладают высоким титром — до 1 : 12 800 — 1 : 25 600. Недостатком таких сывороток является то, что они способны давать групповые реакции агглютинации, так как они содержат антитела к бактериям, имеющим общие антигены в пределах семейства, группы и рода. Поэтому в настоящее время большинство агглютинирующих сывороток выпускаются адсорбированиими, монорецепторными и адсорбированными поливалентными, содержащими только типовые или видовые антитела и соответствующими или определенному типу или виду микроорганизма. Эти сыворотки не подлежат разведению. Для получения таких сывороток нрименяют метод Кастелляни — метод адсорбции, который состоит в том, что при насыщении агглютинирующей сыворотки родственными гетерогенными бактериями происходит адсорбция группоных антител, а специфические антитела остаются в сыворотке. В зависимости от полноты истощения групповых агглютининов можно получить монорецепторные сыворотки — сыворотки, имеющие антитела только к одному рецептору-антигену или адсорбированные, поливалентные, дающие реакции агглютинации с двумя — тремя родственными бактериями, имеющими общий антиген, в отношении которого проводилась адсорбция. Адсорбированные сыворотки применяют при идентификации выделенных возбудителей в реакции агглютинации на стекле (пластинчатый метод). Агглютинирующие сыворотки наиболее широко применяются при диагностике заболеваний, вызываемых бактериями семейства Enferobacferiaceae. Так, при идентификации эшерихий используются поливалентные и типовые ОК-сыворотки; при дифференциации сальмонелл — набор сывороток: агглютинирующая адсорбированная поливалентная сальмонеллезная О-сыворотка (групп А, В, С, Д, Е) — для определения принадлежности к роду Salmonella, при положительном результате — определяют отдельно с каждой сывороткой (входящей в смесь) серологическую группу и в заключение определяется серологический тип выделенного возбудителя с моно-рецепторными Н-сыворотками сальмонелл, входящих в данную группу. |
|
|
||
|
|
||
|
№ 88 Вакцины. Определение. Современная классификация вакцин. Требования, предъявляемые к современным вакцинным препаратам.
Вакцина — медицинский препарат, предназначенный для создания иммунитета к инфекционным болезням. Классификации вакцин: 1.Живые вакцины - препараты, действующим началом в которых являются ослабленные тем или иным способом, потерявшие свою вирулентность, но сохранившие специфическую антигенность штаммы патогенных бактерий. Примером таких вакцин являются БЦЖ и вакцина против натуральной оспы человека, в качестве которой используется непатогенный для человека вирус оспы коров. 2.Инактивированные (убитые) вакцины – препараты, в качестве действующего начала включающие убитые химическим или физическим способом культуры патогенных вирусов или бактерий, (клеточные, вирионные) или же извлечённые из патогенных микробов комплексы антигенов, содержащие в своём составе проективные антигены (субклеточные, субвирионные вакцины). В препараты иногда добавляют консерванты и адьюванты. Молекулярные вакцины – в них антиген находится в молекулярной форме или даже в виде фрагментов его молекул, определяющих специфичность т. е. в виде эпитопов, детерминант. Корпускулярные вакцины – содержащие в своем составе протективный антиген 3.Анатоксины относятся к числу наиболее эффективных препаратов. Принцип получения – токсин соответствующей бактерии в молекулярном виде превращают в нетоксичную, но сохранившую свою антигенную специфичность форму путем воздействия 0.4% формальдегида при 37t в течение 3-4 недель, далее анатоксин концентрируют, очищают, добавляют адьюванты. 4.Синтетические вакцины. Молекулы эпитопов сами по себе не обладают высокой иммуногенностью для повышения их антигенных свойств эти молекулы сшиваются с полимерным крупномолекулярным безвредным веществом, иногда добавляют адьюванты. 5.Ассоциированные вакцины – препараты, включающие несколько разнородных антигенов. Требования, предъявляемые к современным вакцинам: Иммуногенность; Низкая реактогенность (аллергенность); Не должны обладать тератогенностью, онкогенностью; Штаммы, из которых приготовлена вакцина, должны быть генетически стабильны; Длительный срок хранения; Технологичность производства; Простота и доступность в применении. |
№ 89 Живые вакцины. получение, применение. Достоинства и недостатки.
Живые вакцины - препараты, действующим началом в которых являются ослабленные тем или иным способом, потерявшие свою вирулентность, но сохранившие специфическую антигенность штаммы патогенных бактерий. Аттенуация (ослабление) возможна путём воздействия на штамм химических (мутагены) и физических (температура) факторов или посредством длительных пассажей через невосприимчивый организм. Так же в качестве живых вакцин используются дивергентные штаммы (непатогенные для человека), имеющие общие протективные антигены с патогенными для человека микробами. Примером такой вакцины является БЦЖ и вакцина против натуральной оспы. Возможно получение живых вакцин генно-инженерным способом. Принцип получения таких вакцин сводится к созданию непатогенных для человека рекмбинантных штаммов, несущих протективные антигены патогенных микробов и способных при введении в орг. человека размножаться и создавать иммунитет. Такие вакцины называют векторными. Вне зависимости от того, какие штаммы включены в вакцины, бактерии получают путём выращивания на искусственных питательных средах, культурах клеток или куриных эмбрионах. В живую вакцину, как правило, добавляют стабилизатор, после чего подвергают лиофильному высушиванию. В связи с тем, что живые вакцины способны вызывать вакцинную инфекцию (живые аттенуированные микробы размножаются в организме, вызывая воспалительный процесс проходящий без клинических проявлений), они всегда вызывают перестройку иммунобиологического статуса организма и образование специфических антител. Это так же может являться недостатком, т. к. живые вакцины чаще вызывают аллергические реакции. Вакцины данного типа, как правило, вводятся однократно. Примеры: сибиреязвенная вакцина, чумная вакцина, бруцеллёзная вакцина, БЦЖ вакцина, оспенная дермальная вакцина. |
№ 90 Инактивированные (корпускулярные) вакцины. Применение. Недостатки.
Инактивированные (убитые, корпускулярные или молекулярные) вакцины – препараты, в качестве действующего начала включающие убитые химическим или физическим способом культуры патогенных вирусов или бактерий, (клеточные, вирионные) или же извлечённые из патогенных микробов комплексы антигенов, содержащие в своём составе проективные антигены (субклеточные, субвирионные вакцины). Для выделения из бактерий и вирусов антигенных комплексов (гликопротеинов, ЛПС, белков) применяют трихлоруксусную кислоту, фенол, ферменты, изоэлектрическое осаждение. Их получают путем выращивания патогенных бактерий и вирусов на искусственных питательных средах, инактивируют, выделяют антигенные комплексы, очищают, конструируют в виде жидкого или лиофильного препарата. Преимуществом данного типа вакцин является относительная простота получения (не требуется длительного изучения и выделения штаммов). К недостаткам же относятся низкая иммуногенность, потребность в трехкратном применении и высокая реактогенность формализированных вакцин. Так же, по сравнению с живыми вакцинами, иммунитет, вызываемый ими, непродолжителен. В настоящее время применяются следующие убитые вакцины: брюшнотифозная, обогащенная Vi антигеном; холерная вакцина, коклюшная вакцина |
|
|
||
|
№ 91 Субклеточные и субъединичные вакцины. Получение. Преимущество. Применение. Роль адъювантов. Действующим началом этого типа препаратов являются протективные антигены бактерий, полученные путем воздействия ультразвука на бактериальные клетки. Главным преимуществом данного типа вакцин является их низкая реактогеннность. Адьюванты применяются для усиления иммуногенности вакцин. В качестве адъювантов используют минеральные сорбенты (гели гидрата окиси и фосфата аммония), полимеры, и др. хим. соединения, бактерии и компоненты бактерий, липиды, вещества, вызывающие воспалительную реакцию. Они действуют на антиген и организм в целом. Действие на антиген сводится к укрупнению молекул антигена, т. е. превращению растворимых антигенов в корпускулярные, в результате чего антиген лучше захватывается иммунокомпетентными клетками. При воздействии на организм в месте инъекции адьюванты вызывают воспалительный процесс образование фиброзной капсулы, что способствует более длительному сохранению антигена в «депо» и суммации антигенных раздражений. Адьюванты так же непосредственно активируют пролиферацию В, Т и А систем иммунитета. |
№ 92 Молекулярные вакцины. Анатоксины. Получение, очистка, титрование. Применение. Молекулярные вакцины – в них антиген находится в молекулярной форме или даже в виде фрагментов его молекул, определяющих специфичность т. е. в виде эпитопов, детерминант. В процессе культивирования природных патогенных микробов можно получить протективный антиген, синтезируемый этими бактериями токсин затем превращается в анатоксин, сохраняющий специфическую антигенность и иммуногенность. Анатоксины являются одним из видов молекулярных вакцин. Анатоксины – препараты, полученные из бактериальных экзотоксинов, полностью лишенные своих токсических свойств, но сохранившие антигенные и иммуногенные свойства. Получение: токсигенные бактерии выращивают на жидких средах, фильтруют с помощью бактериальных фильтров для удаления микробных тел, к фильтрату добавляют 0,4% формалина и выдерживают в термостате при 30-40t на 4 недели до полного исчезновения токсических свойств, проверяют на стерильность, токсигенность и иммуногенность. Эти препараты называются нативными анатоксинам, в настоящее время почти не используются, т. к. содержат большое количество балластных веществ, неблагоприятно влияющих на организм. Анатоксины подвергаю физической и химической очистке, адсорбируют на адъювантах. Такие препараты называются адсорбированными высокоочищенными концентрированными анатоксинами. Титрование анатоксинов в реакции фолликуляции производят по стандартной фолликулирующей атитоксической сыворотке, в которой известно количество антитоксических единиц. 1 антигенная единица анатоксина обозначается Lf, это то количество анатоксина, которое вступает в реакцию фолликуляции с 1 единицей дифтерийного анатоксина. Анатоксины применяются для профилактики и реже, для лечения токсинемических инфекций дифтерия, газовая гангрена, ботулизм, столбняк). Так же анатоксины применяются для получения антитоксических сывороток путем гипериммунизации животных. Примеры препаратов: АКДС, АДС, адсорбированный стафилококковый анатоксин, ботулинистический анатоксин, анатоксины из экзотоксинов возбудителей газовых инфекций. |
|
|
|
|
|
|
№ 93 Ассоциированные и комбинированные вакцинные препараты. Достоинства. Вакцинотерапия. Ассоциированные вакцины – препараты, включающие несколько разнородных антигенов и позволяющие проводить иммунизацию против нескольких инфекций одновременно. Если в препарат входят однородные антигены, то такую ассоциированную вакцину называют поливакциной. Если же ассоциированный препарат состоит из разнородных антигенов, то его целесообразно называть комбинированной вакциной. Возможна так же комбинированная иммунизация, когда одновременно вводят несколько вакцин в различные участки тела, например, против оспы(накожно) и чумы(подкожно) Примером поливакцины можно считать живую полиомиелитную поливакцину, содержащую аттенуированные штаммы вируса полиомиелита I, II, III типов. Примером комбинированной вакцины является АКДС, куда входят инактивированная корпускулярная коклюшная вакцина, дифтерийный и столбнячный анатоксин. Комбинированные вакцины применяются в сложной противоэпидемической обстановке. В основе их действия лежит способность иммунной системы отвечать на несколько антигенов одновременно |
№ 94 Генно-инженерные вакцины. Принципы получения, применение.
Генно-инженерные вакцины – это препараты, полученные с помощью биотехнологии, которая по сути сводиться к генетической рекомбинации . Для начала получают ген, который должен быть встроен в геном реципиента. Небольшие гены могут быть получены методом химического синтеза. Для этого расшифровывается число и последовательность аминокислот в белковой молекуле вещества, затем по этим данным узнают очерёдность нуклеотидов в гене, далее следует синтез гена химическим путем. Крупные структуры, которые довольно сложно синтезировать получаются путем выделения(клонирования), прицельного выщепления этих генетических образований с помощью рестриктаз. Полученный одним из способов целевой ген с помощью ферментов сшивается с другим геном, который используется в качестве вектора для встраивания гибридного гена в клетку. Вектором могут служить плазмиды, бактериофаги, вирусы человека и животных. Экспрессируемый ген встраивается в бактериальную или животную клетку, которая начинает синтезировать несвойственное ей ранее вещество, кодируемое эксперссируемым геном. В качестве реципиентов экспрессируемого гена чаще всего используется E. coli, B. subtilis, псевдомонады, дрожжи, вирусы. некоторые штаммы способны переключаться на синтез чужеродного вещества до 50% своих синтетических возможностей – эти штамм называются суперпродуцентами. Иногда к генно-инженерным вакцинам добавляется адъювант. Примерами таких вакцин служат вакцина против гепатита В (энджерикс), сифилиса, холеры, бруцеллёза, гриппа, бешенства. Есть определённые сложности в разработке и применении: - длительное время к генно-инженерным препаратам относились настороженно. - на разработку технологии для получения вакцины затрачиваются значительные средства - при получении препаратов данным способом возникает вопрос об идентичности полученного материала природному веществу. |
№ 95 Иммунные сыворотки. Классификация. Получение, очистка. Применение.
Иммунные сыворотки: иммунологические препараты на основе антител. 1.Антитоксические - сыворотки против дифтерии, столбняка, ботулизма, газовой гангрены, т.е. сыворотки, содержащие в качестве антител антитоксины, которые нейтрализуют специфические токсины. 2.Антибактериальные - сыворотки, содержащие агглютинины, преципитины, комплементсвязывающие антитела к возбудителям брюшного тифа, дизентерии, чумы, коклюша. 3.Противовирусные сыворотки (коревая, гриппозная, антирабическая) содержат вируснейтрализующие, комплементсвязывающие противовирусные антитела. Иммунные сыворотки получают путем гипериммунизации животных (лошади) специфическим антигеном (анатоксином, бактериальными или вирусными культурами и их антигенами) с последующим, в период максимального антителообразования, выделением из крови иммунной сыворотки. Иммунные сыворотки, полученные от животных, называют гетерогенными, так как они содержат чужеродные для человека сывороточные белки. Для получения гомологичных нечужеродных иммунных сывороток используют сыворотки переболевших людей (коревая, оспенная сыворотки) или специально иммунизированных людей-доноров (противостолбнячная, противоботулиническая), содержащие антитела к ряду возбудителей инфекционных болезней вследствие вакцинации или перенесенного заболевания. Нативные иммунные сыворотки содержат ненужные белки (альбумин), из этих сывороток выделяют и подвергают очистке специфические белки- иммуноглобулины. Методы очистки: осаждение спиртом, ацетоном на холоде, обработка ферментами. Иммунные сыворотки создают пассивный специфический иммунитет сразу после введения. Применяют с лечебной и профилактической целью. Для лечения токсинемических инфекций (столбняк, ботулизм, дифтерия, газовая гангрена), а также для лечения бактериальных и вирусных инфекций (корь, краснуха, чума, сибирская язва). С лечебной целью сывороточные препараты в/м. Профилактически: в/м лицам, имевшим контакт с больным, для создания пассивного иммунитета. |
|
|
||
|
№ 96 Антитоксические сыворотки. Получение, очистка, титрование. Применение. Осложнения при использовании и их предупреждение.
Антитоксические гетерогенные сыворотки получаются путем гипериммунизации различных животных. Они называются гетерогенными т.к. содержат чужеродные для человека сывороточные белки. Более предпочтительным является применение гомологичных антитоксических сывороток, для получения которых используется сыворотка переболевших людей (коревая, паротидная), или специально иммунизированных доноров(противостолбнячная, противоботулинистическая), сыворотка из плацентарной а так же абортивной крови, содержащие антитела к ряду возбудителей инфекционных болезней вследствие вакцинации или перенесенного заболевания. Для очистки и концентрирования антитоксических сывороток используют методы: осаждение спиртом или ацетоном на холоде, обработка ферментами, аффинная хроматография, ультрафильтрация. Активность иммунных антитоксических сывороток выражают в антитоксических единицах, т.е. тем наименьшим кол-вом антител, которое вызывает видимую или регистрируемую соответствующим способом реакцию с определённым кол-вом специфического антигена. активность антитоксической противостолбнячной сыворотки и соответствующего Ig выражается в антитоксических единицах. Антитоксические сыворотки применяются для лечения токсинемических инфекций (столбняк, ботулизм, дифтерия, газовая гангрена). После введения антитоксических сывороток возможны осложнения в виде анафилактического шока и сывороточной болезни, поэтому пред введением препаратов ставят аллергическую пробу на чувствительность к ним пациента, а вводят их дробно, по Безредке. |
№ 97 Препараты иммуноглобулинов. Получение, очистка, показания к применению.
Нативные иммунные сыворотки содержат ненужные белки (альбумин), из этих сывороток выделяют и подвергают очистке специфические белки- иммуноглобулины. Иммуноглобулины, иммунные сыворотки подразделяют на: 1.Антитоксические - сыворотки против дифтерии, столбняка, ботулизма, газовой гангрены, т.е. сыворотки, содержащие в качестве антител антитоксины, которые нейтрализуют специфические токсины. 2.Антибактериальные - сыворотки, содержащие агглютинины, преципитины, комплементсвязывающие антитела к возбудителям брюшного тифа, дизентерии, чумы, коклюша. 3.Противовирусные сыворотки (коревая, гриппозная, антирабическая) содержат вируснейтрализующие, комплементсвязывающие противовирусные антитела. Методы очистки: осаждение спиртом, ацетоном на холоде, обработка ферментами, аффинная хроматография, ультрафильтрация. Активность иммуноглобулинов выражают в антитоксических единицах, в титрах вируснейтрализующей, гемагглютинирующей, агглютинирующей активности, т.е. тем наименьшим количеством антител, которое вызывает видимую реакцию с определенным количеством специфического антигена. Иммуноглобулины создают пассивный специфический иммунитет сразу после введения. Применяют с лечебной и профилактической целью. Для лечения токсинемических инфекций (столбняк, ботулизм, дифтерия, газовая гангрена), а также для лечения бактериальных и вирусных инфекций (корь, краснуха, чума, сибирская язва). С лечебной целью сывороточные препараты в/м. Профилактически: в/м лицам, имевшим контакт с больным, для создания пассивного иммунитета. При необходимости экстренного создания иммунитета, для лечения развивающейся инфекции применяют иммуноглобулины, содержащие готовые антитела. |
№ 98 Понятие об иммуномодуляторах. Принцип действия. Применение.
Иммуномодуляторы – вещества, оказывающие влияние на функцию иммунной системы, изменяющие активность иммунной системы в сторону повешения (иммуностимуляторы) или понижения (иммунодепрессанты) её активности. К экзогенным иммуномодуляторам относится большая группа веществ различной химической природы и происхождения, оказывающих неспецифическое активирующее или супрессивное действие на иммунную систему, но являющихся чужеродными для организма. Антибиотики, левамизол, полисахариды, ЛПС, адъюванты. Эндогенные иммуномодуляторы представляют собой достаточно большую группу олигопептидов, синтезируемых самим организмом, его иммунокомпетентными клетками, и способных активировать иммунную систему путем усиления функции иммунокомпетентных клеток. К ним относятся регуляторные пептиды: интерлейкины, интерфероны, гормоны тимуса. Применение иммуномодуляторов: при первичных и вторичных имму-нодефицитах различного происхождения, при онкологических болезнях, при трансплантации органов и тканей, при лечении иммунопатологических и аллергических болезней, в иммунопрофилактике и лечении инфекционных болезней. Созданы препараты, обладающие иммуномодулирующим действием: интерферон, лейкоферон, виферон. |
|
|
||
|
|
||
|
№ 99 Интерфероны. Природа, способы получения. Применение.
Интерфероны — гликопротеины, вырабатываемые клетками в ответ на вирусную инфекцию и другие стимулы. Блокируют репродукцию вируса в других клетках и участвуют во взаимодействии клеток иммунной системы. Различают две серологические группы интерферонов: I тип — ИФН-α и ИФН -β; II тип — ИФН-.γ Интерфероны I типа оказывают противовирусные и противоопухолевые эффекты, в то время как интерферон II типа регулирует специфический иммунный ответ и неспецифическую резистентность. α- интерферон (лейкоцитарный) продуцируется лейкоцитами, обработанными вирусами и другими агентами. β-интерферон (фибробластный) продуцируется фибробластами, обработанными вирусами. ИФН I типа, связываясь со здоровыми клетками, защищает их от вирусов. Антивирусное действие ИФН I типа может обуславливаться и тем, что он способен угнетать клеточную пролиферацию, препятствуя синтезу аминокислот. ИФН-γ продуцируется Т-лимфоцитами и NK. Стимулирует активность Т- и В-лимфоцитов, моноцитов/макрофагов и нейтрофилов. Индуцирует апоптоз активированных макрофагов, кератиноцитов, гепатоцитов, клеток костного мозга, эндотелиоцитов и подавляет апоптоз периферических моноцитов и герпес-инфицированных нейронов. Генно-инженерный лейкоцитарный интерферон получают в прокариотических системах (кишечной палочке). Биотехнология получения лейкоцитарного интерферона включает следующие этапы: 1) обработка лейкоцитарной массы индукторами интерферона; 2) выделение из обработанных клеток смеси иРНК; 3) получение суммарных комплементарных ДНК с помощью обратной транскриптазы; 4) встраивание кДНК в плазмиду кишечной палочки и ее клонирование; 5) отбор клонов, содержащих гены интерферона; 6) включение в плазмиду сильного промотора для успешной транскрипции гена; 7) экспрессия гена интерферона, т.е. синтез соответствующего белка; 8) разрушение прокариотических клеток и очистка интерферона с помощью аффинной хроматографии. Интерфероны применяются для профилактики и лечения ряда вирусных инфекций. Их эффект определяется дозой препарата, однако высокие дозы интерферона оказывают токсическое действие. Интерфероны широко применяются при гриппе и других острых респираторных заболеваниях. Препарат эффективен на ранних стадиях заболевания, применяется местно. Интерфероны оказывают терапевтическое действие при гепатите В, герпесе, а также при злокачественных новообразованиях. |
№ 100 Иммунотерапия и иммунопрофилактика инфекционных болезней.
Иммунопрофилактика и иммунотерапия являются разделами иммунологии, которые изучают и разрабатывают способы и методы специфической профилактики, лечения и диагностики инфекционных и неинфекционных болезней с помощью иммунобиологических препаратов, оказывающих влияние на функцию иммунной системы, или действие которых основано на иммунологических принципах. Иммунопрофилактика направлена на создание активного или пассивного иммунитета к возбудителю инфекционной болезни, его антигену с целью предупреждения возможного заболевания путем формирования невосприимчивости к ним организма. Иммунотерапия направлена на лечение уже развившейся болезни, в основе которой лежит нарушение функции иммунной системы. Иммунопрофилактика и иммунотерапия применяются, когда необходимо: а)сформировать, создать специфический иммунитет, активизировать деятельность иммунной системы; б) подавить активность звеньев иммунной системы; в)нормализовать работу иммунной системы. Иммунопрофилактика и иммунотерапия применяются в профилактике и лечении инфекционных болезней, аллергий, иммунопатологических состояний, в онкологии, трансплантологии, при первичных и вторичных иммунодефицитах. В лечении токсинемических инфекций (ботулизм, столбняк) значение имеет серотерапия, т.е. применение антитоксических сывороток, и иммуноглобулин. В терапии онкологических болезней применяются иммуноцитокины. Для всего этого – иммунобиологические препараты. |
№ 101 Методы микробиологической диагностики инфекционных болезней
Микробиологические (бактериологические, микологические, вирусологические) методы основаны на выделении чистой культуры возбудителя и ее последующей идентификации на основании морфологических, культуральных, биохимических, антигенных (серологических) и других признаков. Располагая чистой культурой бактерий, можно определить их родовую и видовую принадлежность, факторы патогенности, а также чувствительность к антибиотикам и химиотерапевтическим препаратам. Микологические исследования осуществляются реже, чем бактериологические, поскольку микроскопическая диагностика микозов достаточно надежна. Микологические исследования проводят при диагностике кандидозов путем определения нарастания количества клеток дрожжеподобных грибов рода Candida, а также глубоких микозов. Вирусологический метод является наиболее достоверным в диагностике вирусных инфекций. Однако его трудоемкость, связанная с приготовлением культуры клеток, обработкой исследуемого материала, а также со сравнительно частым получением отрицательных результатов, ограничивают применение данного метода. Кроме того, он требует затраты сравнительно большого времени, особенно при проведении «слепых» пассажей. Во многих случаях вирусологический метод используют для ретроспективной диагностики вирусных инфекций. Все микробиологические методы имеют определяющее значение в лабораторной диагностике, являются наиболее информативными и достоверными, особенно если они подтверждены дополнительными серологическими данными. |
|
|
|

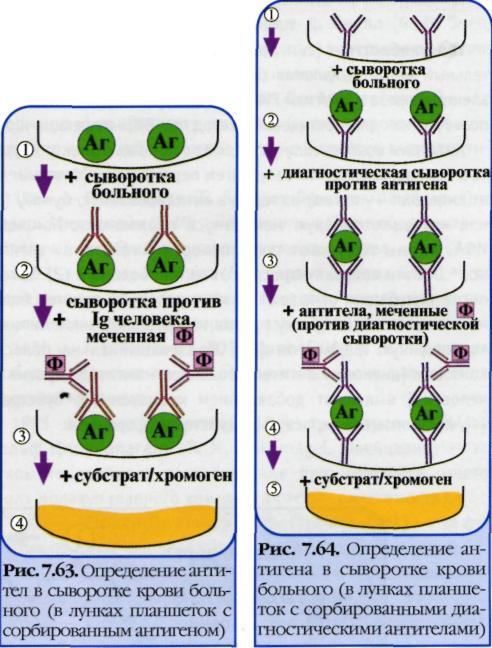 I.
При определении антигена (правый
рисунок) в лунки с сорбированными
антителами вносят антиген (напр.,
сыворотку крови с искомым антигеном),
добавляют диагностическую сыворотку
против него и вторичные антитела
(против диагностической сыворотки),
меченные ферментом, а затем
субстрат/хромоген для фермента.
I.
При определении антигена (правый
рисунок) в лунки с сорбированными
антителами вносят антиген (напр.,
сыворотку крови с искомым антигеном),
добавляют диагностическую сыворотку
против него и вторичные антитела
(против диагностической сыворотки),
меченные ферментом, а затем
субстрат/хромоген для фермента.