Файл: Курсоваяработ а по неорганической химии комплексные и двойные соли никеля студент Сухарева Ксения курс i группа 13101.doc
Добавлен: 22.11.2023
Просмотров: 258
Скачиваний: 9
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
, (гексаацетатоникель) [Ni3(CH3COO)6](OH)3, а также некоторые координационные соединения Me[Ni(CH2 = NO)6].
Четырехвалентное состояние не характерно для никеля. Известно очень немного соединений четырехвалентного никеля. Все они имеют окислительный характер и неустойчивы. Синтезированы комплексы никеля (IV) с полиселенидами, карборанами и диоксимом диацетилпиридина. В качестве примеров соединений никеля (IV) можно привести K2Ni2+[Ni4+O3]2, Na2Ni2+[Ni4+O3]2.
Химические свойства комплексных солей:
1. Разрушение комплексов за счёт образования малорастворимых соединений:
2[Cu(NH3)2]Cl + K2S = CuS ↓ + 2KCl + 4NH3
2. Обмен лигандами между внешней и внутренней сферами.
K2[CoCl4] + 6H2O = [Co(H2O)6]Cl2 + 2KCl
Например, соль K2[CuCl4] из-за высокого значения константы нестойкости комплексного иона [СuС14]2- часто представляют формулой СuС12•2КС1. Такая формула не означает смеси двух солей! К двойным солям относятся многочисленные минералы.
Самыми важными представителями двойных солей являются соли сульфатов калия, натрия, алюминия, железа, хрома и аммония, а также квасцы:
• квасцы алюмо-аммонийные — (NH4)2SO4 •Al2(SO4)3•24 H2O;
• квасцы алюмо-калиевые — K2SO4•Al2(SO4)3•24 H2O;
• квасцы железо-аммонийные — (NH4)2SO4•Fe2(SO4)3•24 H2O;
• квасцы алюмо-натриевые — Na2SO4•Al2(SO4)3•24 Н2O;
• квасцы хромо-калиевые — K2SO4•Cr2(SO4)3•24 H2O.
Формула квасцов может быть выражена другим способом, например, алюмо-калиевые квасцы:
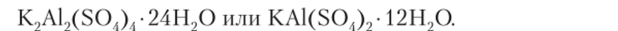
Шениты ( соли Туттона) — двойные соли сульфата калия с сульфатами двухвалентных железа, меди, цинка, один из которых — железо-калиевый, FeSO4•K2SO4•6Н2O, напоминает соль Мора.
Растворимые в воде двойные соли диссоциируют как сильные электролиты на составляющие их ионы:

Никель - один из металлов, которые могут образовывать соли Туттона . Однозарядный ион может быть любым из полного диапазона калия, рубидия, цезия, аммония или таллия. В качестве минерала аммонийно-никелевая соль (NH4)2Ni(SO4)2•6 H2O может быть названа никельбуссингалтитом. В случае натрия двойным сульфатом является никельблёдит Na2Ni(SO4)2•4 H2O из семейства блодитов. Никель может быть заменен другими двухвалентными металлами аналогичного размера для получения смесей, кристаллизующихся в такой же форме, такие как кадмий, кобальт, хром, медь, железо, магний, марганец, ванадий, цинк.
Безводные соли формулы M2Ni2(SO4)3, которые можно назвать трисульфатами металлического никеля, принадлежащими к семейству лангбейнитов. Известные соли включают (NH4)2Ni2(SO4)3, K2Ni2(SO4)3 и Rb2Ni2( предполагается, что (SO4)3, а также Tl и Cs.
Никель образует двойные нитраты с более легкими редкоземельными элементами. Твердые кристаллы имеют формулу Ni3Me2(NO3)12•24 H2O. Металлы включают La, Ce, Pr, Nd, Sm, Gd и не редкоземельный Bi. Никель также можно заменить аналогичными двухвалентными ионами Mg, Mn, Co, Zn. Для солей никеля температуры плавления варьируются от 110,5 ° для La, 108,5° для Ce, 108° для Pr, 105,6° для Nd, 92,2° для Sm и до 72,5° для Gd. Соль Bi плавится при 69°. Кристаллическая структура гексагональная с Z = 3. Ni3La2(NO3)12•24 H2O становится ферромагнитным ниже 0,393 К. Эти двойные нитраты никеля использовались для разделения редкоземельных элементов с помощью фракционной кристаллизации .
Нитрат тория никеля имеет формулу NiTh(NO3)6•8H2O. Атомы никеля могут быть замещены другими ионы с радиусом от 0,69 до 0,83 A. Нитраты координированы по атому тория, а вода - к никелю. Энтальпия растворения октагидрата составляет 7 кДж / моль. Энтальпия образования составляет -4360 кДж / моль. При 109° октагидрат становится NiTh(NO3)6•6 H2O, а при 190° NiTh(NO3)6•3 H2O и безводный при 215°. Гексагидрат имеет кубическую структуру.
Дигидрофосфид никеля (Ni(PH2)2) может образовывать оранжевые, зеленые или черные двойные соли KNi(PH2)3), которые кристаллизуются из жидкого аммиака. Они нестабильны при температуре выше -78°C, выделяя аммиак, фосфин и водород.
Химические свойства двойных солей:
1. Взаимодействие с растворами щелочей:
KCr(SO4)2 + 3KOH = Cr(OH)3 ↓ + 2K2SO4
NaAl(SO4)2 + 3NaOH → Al(OH)3↓ + 2Na2S
NaAl(SO4)2 + 4NaOH(изб.) → Na[Al(OH)4] + 2Na2SO4
Прибавьте насыщенный раствор 2,5 г гептагидрата сульфата никеля к насыщенному раствору стехиометрического количества сульфата аммония и нагрейте смесь до кипения. Если выпавший вначале осадок полностью не растворился, то добавьте по каплям концентрированный раствор аммиака до полной прозрачности раствора. Раствор кипятите 15-30 минут.
После кипячения дайте раствору постоять 1 ч и профильтруйте. К фильтрату добавьте 5 мл 50%-ной серной кислоты и упарьте до объема 5-7 мл. Выпадение кристаллов гексагидрата начинается еще в горячем растворе. Охладите раствор в бане со льдом. Кристаллическое вещество отделите на стеклянном пористом фильтре, промойте вначале водой, охлажденной в бане со льдом, а затем спиртом. Для удаления спирта высушите вещество на воздухе. Сухие кристаллы перенесите в бюкс и взвесьте. Рассчитайте выход в процентах.
NiSO4•7 H2O + (NH4)2SO4 = (NH4)2Ni(SO4)2•H2O + 6H2O
mтеор = 2,47 г
mпр= 1,85 г
Выход = 74%
Реакции идентификации:
(зел.осадок)
(зел.осадок)
( черн.осадок)
Растворяют 2,5 г нитрата никеля и добавляют такое количество 25%-ого раствора аммиака, чтобы выпавший осадок полностью растворился. Добавляют насыщенный при 25-30°С раствор иодида калия и 10%-ный раствор аммиака до полного осаждения иодида гексаамминникеля(II). Выпавший осадок тотчас же отфильтровывают на стеклянном пористом фильтре и промывают вначале два раза раствором осадителя, затем концентрированным раствором аммиака, смесью спирта и концентрированного раствора аммиака (1:1) и, наконец, этиловым спиртом. Высушивают полученный препарат при температуре не выше 100 С. Определяют массу продукта и рассчитывают выход в процентах.
Ni(NO3)2 + 6NH3•H2O = [Ni(NH3)6](NO3)2 + 6H2O
[Ni(NH3)6](NO3)2 + 2KI = [Ni(NH3)6]I2 ↓ + 2KNO3
(голубой осадок)
mтеор = 5,81 г
mпр = 3,3 г
Выход = 56%
Реакции идентификации:
(св. желт. твор. осадок)
2) [Ni(NH3)6]I2 + 2NaOH = Ni(OH)2 ↓ + 6NH3 + 2NaI
+ 2NaI
(зел.осадок)
2-3 г хлорида никеля (II) растворяют в 50-60 мл воды, в случае надобности профильтровывают и к фильтрату прибавляют раствор аммиака до слабого запаха и спиртовой раствор диметилглиоксима до образования осадка розового цвета Ni[N2(OH)2C2(CH3)2]. Осадок отфильтровывают, промывают 2-3 раза водой и высушивают на воздухе.
NiCl2 + 2NH3 + C4H8N2O2 = Ni[N2(OH)2C2(CH3)2] ↓ + 2NH4Cl
(розовый осадок)
mтеор = 4,025 г
mпр = 1,58 г
Выход = 39%
Реакции:
(изб.)
Мной были изучены комплексные и двойные соли никеля. Так же я изучила химические свойства никеля.
Были проведены три синтеза и получены три вещества: гексагидрат сульфата аммония и никеля (NH4)2Ni(SO4)2 ( светло-зеленые кристаллы), иодид гексаамминникеля(II) [Ni(NH3)6]I2 (сине-фиолетовые кристаллы), бис(диметилглиоксимат) никеля(II) Ni[N2(OH)2C2(CH3)2] (красно-розовые кристаллы). Были проведены химические реакции, доказывающие качественный состав этих комплексов.
Список литературы
.
-
Соединения четырехвалентного никеля Ni (IV)
Четырехвалентное состояние не характерно для никеля. Известно очень немного соединений четырехвалентного никеля. Все они имеют окислительный характер и неустойчивы. Синтезированы комплексы никеля (IV) с полиселенидами, карборанами и диоксимом диацетилпиридина. В качестве примеров соединений никеля (IV) можно привести K2Ni2+[Ni4+O3]2, Na2Ni2+[Ni4+O3]2.
Химические свойства комплексных солей:
1. Разрушение комплексов за счёт образования малорастворимых соединений:
2[Cu(NH3)2]Cl + K2S = CuS ↓ + 2KCl + 4NH3
2. Обмен лигандами между внешней и внутренней сферами.
K2[CoCl4] + 6H2O = [Co(H2O)6]Cl2 + 2KCl
2.2 Двойные соли - это те же комплексные соединения, но с очень малостойкой внутренней координационной сферой и обозначают перечислением формул простых солей, разделяя их точкой.
Например, соль K2[CuCl4] из-за высокого значения константы нестойкости комплексного иона [СuС14]2- часто представляют формулой СuС12•2КС1. Такая формула не означает смеси двух солей! К двойным солям относятся многочисленные минералы.
Самыми важными представителями двойных солей являются соли сульфатов калия, натрия, алюминия, железа, хрома и аммония, а также квасцы:
• квасцы алюмо-аммонийные — (NH4)2SO4 •Al2(SO4)3•24 H2O;
• квасцы алюмо-калиевые — K2SO4•Al2(SO4)3•24 H2O;
• квасцы железо-аммонийные — (NH4)2SO4•Fe2(SO4)3•24 H2O;
• квасцы алюмо-натриевые — Na2SO4•Al2(SO4)3•24 Н2O;
• квасцы хромо-калиевые — K2SO4•Cr2(SO4)3•24 H2O.
Формула квасцов может быть выражена другим способом, например, алюмо-калиевые квасцы:
Шениты ( соли Туттона) — двойные соли сульфата калия с сульфатами двухвалентных железа, меди, цинка, один из которых — железо-калиевый, FeSO4•K2SO4•6Н2O, напоминает соль Мора.
Растворимые в воде двойные соли диссоциируют как сильные электролиты на составляющие их ионы:
Никель - один из металлов, которые могут образовывать соли Туттона . Однозарядный ион может быть любым из полного диапазона калия, рубидия, цезия, аммония или таллия. В качестве минерала аммонийно-никелевая соль (NH4)2Ni(SO4)2•6 H2O может быть названа никельбуссингалтитом. В случае натрия двойным сульфатом является никельблёдит Na2Ni(SO4)2•4 H2O из семейства блодитов. Никель может быть заменен другими двухвалентными металлами аналогичного размера для получения смесей, кристаллизующихся в такой же форме, такие как кадмий, кобальт, хром, медь, железо, магний, марганец, ванадий, цинк.
Безводные соли формулы M2Ni2(SO4)3, которые можно назвать трисульфатами металлического никеля, принадлежащими к семейству лангбейнитов. Известные соли включают (NH4)2Ni2(SO4)3, K2Ni2(SO4)3 и Rb2Ni2( предполагается, что (SO4)3, а также Tl и Cs.
Никель образует двойные нитраты с более легкими редкоземельными элементами. Твердые кристаллы имеют формулу Ni3Me2(NO3)12•24 H2O. Металлы включают La, Ce, Pr, Nd, Sm, Gd и не редкоземельный Bi. Никель также можно заменить аналогичными двухвалентными ионами Mg, Mn, Co, Zn. Для солей никеля температуры плавления варьируются от 110,5 ° для La, 108,5° для Ce, 108° для Pr, 105,6° для Nd, 92,2° для Sm и до 72,5° для Gd. Соль Bi плавится при 69°. Кристаллическая структура гексагональная с Z = 3. Ni3La2(NO3)12•24 H2O становится ферромагнитным ниже 0,393 К. Эти двойные нитраты никеля использовались для разделения редкоземельных элементов с помощью фракционной кристаллизации .
Нитрат тория никеля имеет формулу NiTh(NO3)6•8H2O. Атомы никеля могут быть замещены другими ионы с радиусом от 0,69 до 0,83 A. Нитраты координированы по атому тория, а вода - к никелю. Энтальпия растворения октагидрата составляет 7 кДж / моль. Энтальпия образования составляет -4360 кДж / моль. При 109° октагидрат становится NiTh(NO3)6•6 H2O, а при 190° NiTh(NO3)6•3 H2O и безводный при 215°. Гексагидрат имеет кубическую структуру.
Дигидрофосфид никеля (Ni(PH2)2) может образовывать оранжевые, зеленые или черные двойные соли KNi(PH2)3), которые кристаллизуются из жидкого аммиака. Они нестабильны при температуре выше -78°C, выделяя аммиак, фосфин и водород.
Химические свойства двойных солей:
1. Взаимодействие с растворами щелочей:
KCr(SO4)2 + 3KOH = Cr(OH)3 ↓ + 2K2SO4
NaAl(SO4)2 + 3NaOH → Al(OH)3↓ + 2Na2S
NaAl(SO4)2 + 4NaOH(изб.) → Na[Al(OH)4] + 2Na2SO4
Глава 3. Практическая часть
2 Синтез №1. Получение гексагидрата сульфата аммония и никеля (аналог соли Мора)
Прибавьте насыщенный раствор 2,5 г гептагидрата сульфата никеля к насыщенному раствору стехиометрического количества сульфата аммония и нагрейте смесь до кипения. Если выпавший вначале осадок полностью не растворился, то добавьте по каплям концентрированный раствор аммиака до полной прозрачности раствора. Раствор кипятите 15-30 минут.
После кипячения дайте раствору постоять 1 ч и профильтруйте. К фильтрату добавьте 5 мл 50%-ной серной кислоты и упарьте до объема 5-7 мл. Выпадение кристаллов гексагидрата начинается еще в горячем растворе. Охладите раствор в бане со льдом. Кристаллическое вещество отделите на стеклянном пористом фильтре, промойте вначале водой, охлажденной в бане со льдом, а затем спиртом. Для удаления спирта высушите вещество на воздухе. Сухие кристаллы перенесите в бюкс и взвесьте. Рассчитайте выход в процентах.
NiSO4•7 H2O + (NH4)2SO4 = (NH4)2Ni(SO4)2•H2O + 6H2O
mтеор = 2,47 г
mпр= 1,85 г
Выход = 74%
Реакции идентификации:
-
(NH4)2Ni(SO4)2 + 4NaOH = Ni(OH)2 ↓ + 2Na2SO4 + 2NH3 + 2H2O
+ 2H2O
(зел.осадок)
-
(NH4)2Ni(SO4)2 + Na2CO3 = Ni(OH)2 ↓ + Na2SO4 + (NH4)2SO4 + CO
(зел.осадок)
-
(NH4)2Ni(SO4)2 + Na2S = NiS ↓ + Na2SO4 + (NH4)2SO4
( черн.осадок)
3 Синтез №2. Получение иодид гексаамминникеля(II)
Растворяют 2,5 г нитрата никеля и добавляют такое количество 25%-ого раствора аммиака, чтобы выпавший осадок полностью растворился. Добавляют насыщенный при 25-30°С раствор иодида калия и 10%-ный раствор аммиака до полного осаждения иодида гексаамминникеля(II). Выпавший осадок тотчас же отфильтровывают на стеклянном пористом фильтре и промывают вначале два раза раствором осадителя, затем концентрированным раствором аммиака, смесью спирта и концентрированного раствора аммиака (1:1) и, наконец, этиловым спиртом. Высушивают полученный препарат при температуре не выше 100 С. Определяют массу продукта и рассчитывают выход в процентах.
Ni(NO3)2 + 6NH3•H2O = [Ni(NH3)6](NO3)2 + 6H2O
[Ni(NH3)6](NO3)2 + 2KI = [Ni(NH3)6]I2 ↓ + 2KNO3
(голубой осадок)
mтеор = 5,81 г
mпр = 3,3 г
Выход = 56%
Реакции идентификации:
-
[Ni(NH3)6]I2 + AgNO3 = [Ni(NH3)6](NO3)2 + AgI2 ↓
(св. желт. твор. осадок)
2) [Ni(NH3)6]I2 + 2NaOH = Ni(OH)2 ↓ + 6NH3
(зел.осадок)
4Синтез №3. Получение бис(диметилглиоксимат) никеля(II)
2-3 г хлорида никеля (II) растворяют в 50-60 мл воды, в случае надобности профильтровывают и к фильтрату прибавляют раствор аммиака до слабого запаха и спиртовой раствор диметилглиоксима до образования осадка розового цвета Ni[N2(OH)2C2(CH3)2]. Осадок отфильтровывают, промывают 2-3 раза водой и высушивают на воздухе.
NiCl2 + 2NH3 + C4H8N2O2 = Ni[N2(OH)2C2(CH3)2] ↓ + 2NH4Cl
(розовый осадок)
mтеор = 4,025 г
mпр = 1,58 г
Выход = 39%
Реакции:
-
Ni[N2(OH)2C2(CH3)2] + NaOH = … -
N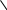 i[N2(OH)2C2(CH3)2] + NH3(конц) = …
i[N2(OH)2C2(CH3)2] + NH3(конц) = …
(изб.)
Заключение.
Мной были изучены комплексные и двойные соли никеля. Так же я изучила химические свойства никеля.
Были проведены три синтеза и получены три вещества: гексагидрат сульфата аммония и никеля (NH4)2Ni(SO4)2 ( светло-зеленые кристаллы), иодид гексаамминникеля(II) [Ni(NH3)6]I2 (сине-фиолетовые кристаллы), бис(диметилглиоксимат) никеля(II) Ni[N2(OH)2C2(CH3)2] (красно-розовые кристаллы). Были проведены химические реакции, доказывающие качественный состав этих комплексов.
Список литературы
.
-
Спицын В. И., Мартыненко Л. И. Неорганическая химия. Ч. 1: Учебник.-М.: Изд-во МГУ, 1991. – 480с. -
Спицын В. И., Мартыненко Л. И. Неорганическая химия. Ч. 2: Учебник.-М.: Изд-во МГУ, 1994. – 624с -
Третьяков Ю.Д., Мартыненко Л.И., Григорьев А.Н., Цивадзе А.Ю. Неорганическая химия. Книга 1: Учебник-М.: Изд-во Химия, 2001.-471с. -
Кожина Л.Ф., Косырева И.В., Ли Е.П. Никель и его соединения: свойства и методы определения. Учебно-методическое пособие. Электронный ресурс. 2017 – с. 62 -
Кожина Л.Ф., Захарова Т.В., Пожаров М.В. Соли и их свойства. Учебно-методическое пособие. Электронный ресурс, 2017 - 49с. -
Третьяков Ю.Д. Практикум по неорганической химии. М.: Издательский центр «Академия», 2004-383 с. -
Ключников Н. Г., Практикум по неорганическому синтезу. – М.: Изд-во «Просвещение», 1979. – 270 с.