Файл: Методы получения аминокислот и их специфические особенности и различия.docx
Добавлен: 10.01.2024
Просмотров: 223
Скачиваний: 12
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
, либо методами генной инженерии.
В клетках микроорганизмов лизин синтезируется из аспарагиновой кислоты и служит конечным продуктом разветвленного метаболического пути биосинтеза, общего для трех аминокислот — лизина, метионина и треонина.
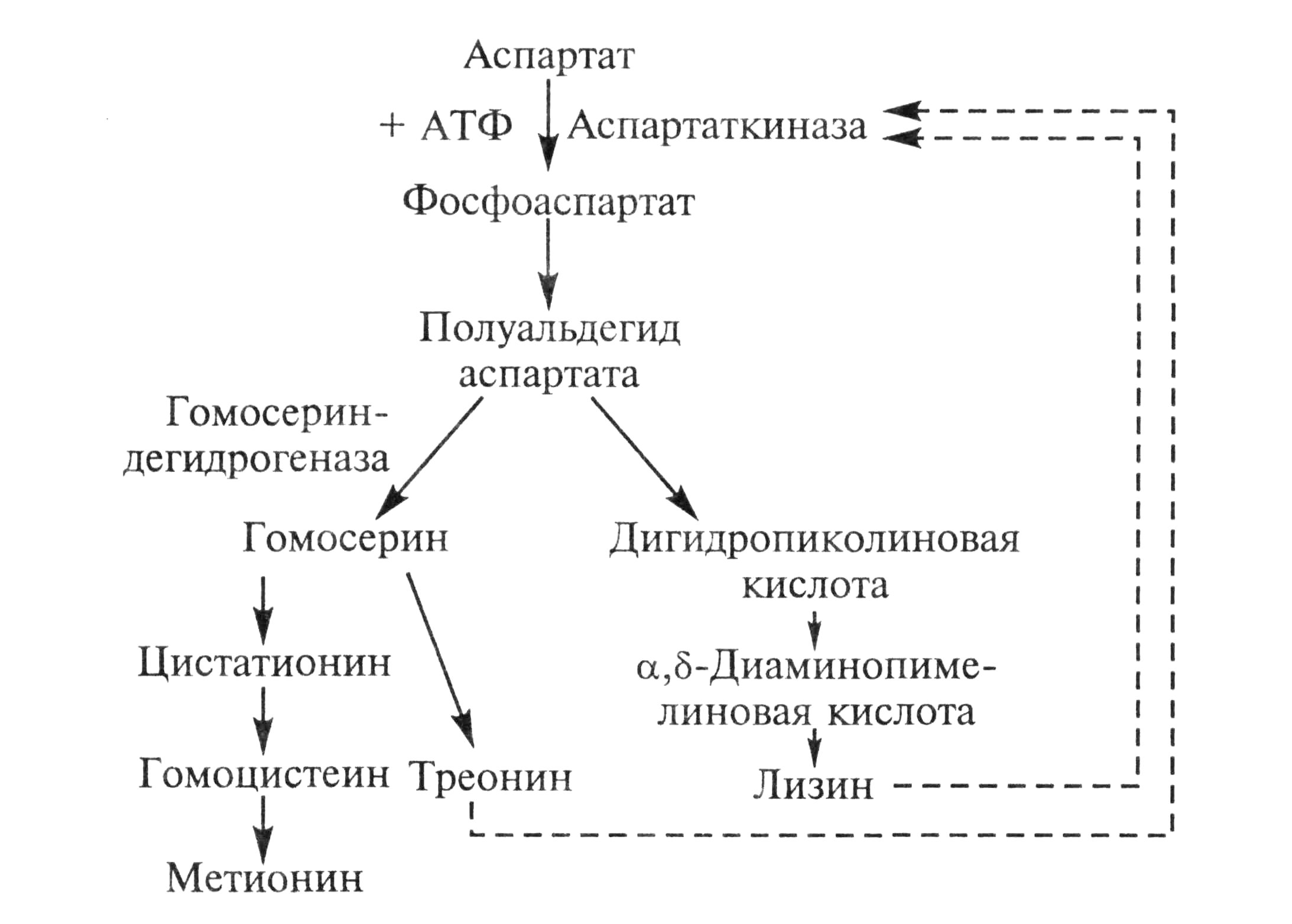
Рисунок 2 – Схема биосинтеза лизина, метионина и треонина
Таким образом, в процессе новообразования аминокислот из общего предшественника одновременно с лизином возникают две другие аминокислоты — метионин и треонин. В этом случае эффекта накопления в среде всего одной целевой аминокислоты добиваются путем блокирования процессов, ведущих к синтезу побочных аминокислот, возникающих в связи с разветвлением метаболического пути.
Чтобы добиться образования лизина в больших количествах, получают мутанты двух типов. У мутантов первого типа (ауксотрофов) не синтезируется или не функционирует гомосериндегидрогеназа, соответственно, блокируется синтез метионина и треонина и, как результат, образуются избыточные количества лизина. Мутанты второго типа дефектны по структурному гену, детерминирующему образование аспартаткиназы. В итоге фермент теряет чувствительность к высоким концентрациям лизина.
Важный фактор, обеспечивающий в культуральной среде высокие концентрации аминокислоты — проницаемость клеточных мембран. Проницаемость клеточной мембраны увеличивают либо с помощью мутаций, либо путем изменения состава питательной среды. В последнем случае в культуральной среде создают дефицит биотина (контролирует содержание в клеточной мембране фосфолипидов) и добавляют пенициллин (нарушает биосинтез клеточных стенок бактерий, что повышает выделение аминокислот в среду).
Как источники углерода наиболее доступны углеводы — глюкоза, сахароза и реже фруктоза и мальтоза. Для снижения стоимости питательной среды в качестве источников углерода используют вторичное сырье: свекловичную мелассу, молочную сыворотку, гидролизаты крахмала, сульфитные щелока. В качестве источников азота применяют мочевину и соли аммония (сульфаты и фосфаты). Стимуляторами роста выступают экстракты кукурузы, дрожжей и солодовых ростков, гидролизаты отрубей и дрожжей, витамины группы В. Кроме того, в питательную среду добавляют необходимые для жизнедеятельности макро- и микроэлементы (Р, Са, Mg, Mn, Fe и др.).
Высокоочищенные препараты лизина получают после фракционирования фильтрата культуральной жидкости методом ионообменной хроматографии на катионите. Их используют для повышения питательной ценности пищевых продуктов и в медицинской промышленности. Кроме высокоочищенных препаратов лизина получают иные виды его товарной формы: жидкий концентрат лизина (ЖКЛ), сухой кормовой концентрат лизина (ККЛ) и высококонцентрированные кормовые препараты, характеризующиеся относительно меньшей степенью очистки в сравнении с первым препаратом.
Подобно лизину триптофан образуется в ходе разветвленного метаболического пути, поэтому для его производства используют ауксотрофных мутантов, у которых блокированы реакции, ведущие к синтезу фенилаланина и тирозина. Однако при выращивании мутантных штаммов в среде с минимальной концентрацией этих аминокислот, не вызывающей регуляторных эффектов, избыточное накопление триптофана в среде не наблюдается, что объясняется особенностью процессов регуляции биосинтеза триптофана у микроорганизмов.
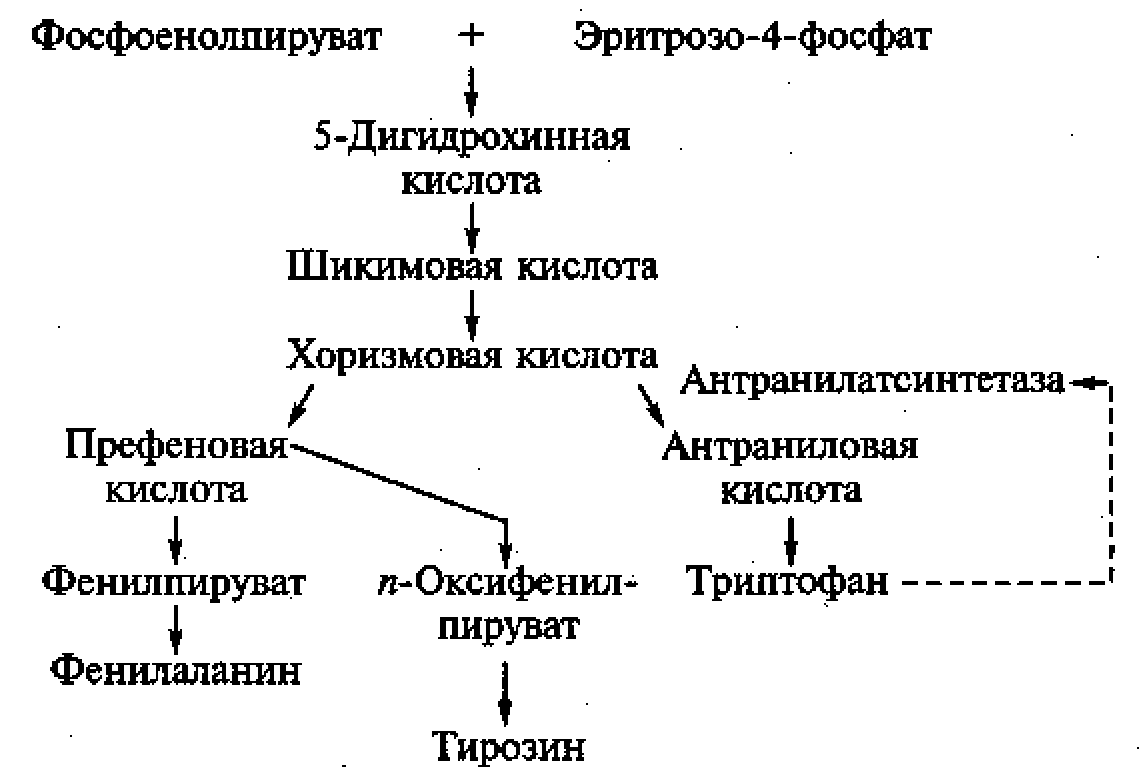
Рисунок 3 – Разветвленный метаболический путь синтеза АК
Метаболическим предшественником триптофана служит антраниловая кислота, которая возникает из хоризмовой кислоты под действием антранилат-синтетазы. Триптофан оказывает ингибирующее действие на антранилатсинтетазу, поэтому для обхода метаболического контроля синтез фермента индуцируют ступенчатым введением предшественника — антраниловой кислоты. В связи с этой особенностью промышленное производство триптофана организовано преимущественно по двухступенчатой схеме. На первом этапе химическим способом синтезируют антраниловую кислоту, которую с помощью энзиматической системы мутантных штаммов дрожжей Candida utilis переводят в триптофан.
Биомассу дрожжей выращивают при температуре 30 °С в среде, содержащей свекловичную мелассу, мочевину и минеральные компоненты. Через сутки в ферментер вводят 5 %-й спиртовой раствор антраниловой кислоты и 50 %-й раствор мочевины, а через 3-4 ч после введения предшественника дополнительно добавляют источник углерода (25 %-й раствор мелассы). Антраниловую кислоту и мочевину подают через каждые 6 ч, а мелассу — через каждые 12 ч. Процесс двухступенчатой ферментации завершается через 144 ч и обеспечивает содержание триптофана в культуральной среде до 6 г/л. Кроме триптофана микробиологическим способом с использованием предшественников получают гистидин, изолейцин, метионин, серии и треонин.
После сушки культуральной жидкости получают кормовой концентрат триптофана (ККТ), который включает белки, свободный триптофан, витамины Вь В2 и PP. Высокоочищенные кристаллические препараты триптофана образуются после дополнительной очистки культуральной жидкости методом ионообменной хроматографии на колонке, заполненной катионитом.
Для получения аминокислот — конечных продуктов неразветвленных метаболических путей, например аргинина, ауксотрофные мутанты не используют. В этом случае применяют мутанты с дефектами регуляции биосинтеза аминокислоты, т.е. регуляторные мутанты. Помимо аргинина регуляторные мутанты используют для получения серина и цитруллина.
Рисунок 4 – Цикл трикарбоновых кислот
Успешное производство с участием микроорганизмов таких аминокислот, как глутаминовая аминокислота, глутамин и пролин, обеспечивает стимуляция образования аминокислот в ответ на изменение условий внешней среды. Метаболическим предшественником при биосинтезе глутаминовой кислоты служит а-кетоглутаровая кислота, возникающая в цикле Кребса из изолимонной кислоты под действием изоцитратдегидрогеназы.
При выращивании бактерий родов Corynebacterium или Brevibacterium на углеводном сырье (гидролизат крахмала, тростниковая или свекловичная меласса), на этаноле или ацетате и при дефиците биотина в культуральной среде накапливается глутаминовая кислота с концентрацией 30 г/л. Важнейшее условие для образования этой аминокислоты — подавление активности глутаматдегидрогеназы. При высоком содержании в среде биотина и солей аммония обеспечиваются условия для образования пролина, а при значительных концентрациях ионов аммония и ионов цинка в слабокислой среде — для синтеза глутамина.
Яркий пример больших возможностей генетической инженерии — создание во ВНИИ генетики и селекции промышленных микроорганизмов штамма Е. coli для получения треонина. В результате были изменены не только регуляторные свойства фермента аспартаткиназы, но и питательные потребности штамма. Введение в геном бактерии нового гена обеспечило бактерии возможность использования в качестве источника углерода сахарозу, основного дисахарида традиционного промышленного сырья — свекловичной мелассы. Перечисленные манипуляции наряду с амплификацией плазмид, содержащих оперон треонина, позволили значительно увеличить производительность штамма бактерии и получить за 40 ч ферментации 100 г L-треонина на 1 л культуральной жидкости. Учитывая исключительные способности штамма Е. coli к сверхсинтезу L-треонина, японская фирма «Адзиномото» приобрела в 1982 г. лицензию на использование российского штамма - продуцента треонина для организации собственного производства.
Характерная особенность процессов получения аминокислот микробиологическим способом, равно как и других биотехнологических производств, — полное использование побочных продуктов, что превращает большинство из них в безотходные и экологически чистые технологии.
Высокая потребность в аминокислотах непрерывно стимулирует разработку принципиально новых и более эффективных биотехнологических способов их получения при наращивании темпов и объемов промышленного производства. В настоящее время в животноводстве стоит проблема балансирования кормовых рационов по полноценному протеину. Натуральные корма, используемые в животноводстве, имеют не оптимальный аминокислотный состав. Для доведения концентрации аминокислот в кормовом рационе до оптимума требуется добавление препаратов чистых аминокислот, особенно незаменимых, полученных промышленным способом. В мире ежегодно производится не менее 300 тыс.т. кормовых препаратов незаменимых аминокислот. В пищевой промышленности также используются аминокислоты, полученные путем микробиологического синтеза, например, глутаминовая кислота. Некоторые аминокислоты, например метионин, используются в фармацевтической промышленности для производства диетических пищевых добавок.
Микробиологический метод получения лизина
В клетках микроорганизмов лизин синтезируется из аспарагиновой кислоты и служит конечным продуктом разветвленного метаболического пути биосинтеза, общего для трех аминокислот — лизина, метионина и треонина.

Рисунок 2 – Схема биосинтеза лизина, метионина и треонина
Таким образом, в процессе новообразования аминокислот из общего предшественника одновременно с лизином возникают две другие аминокислоты — метионин и треонин. В этом случае эффекта накопления в среде всего одной целевой аминокислоты добиваются путем блокирования процессов, ведущих к синтезу побочных аминокислот, возникающих в связи с разветвлением метаболического пути.
Чтобы добиться образования лизина в больших количествах, получают мутанты двух типов. У мутантов первого типа (ауксотрофов) не синтезируется или не функционирует гомосериндегидрогеназа, соответственно, блокируется синтез метионина и треонина и, как результат, образуются избыточные количества лизина. Мутанты второго типа дефектны по структурному гену, детерминирующему образование аспартаткиназы. В итоге фермент теряет чувствительность к высоким концентрациям лизина.
Важный фактор, обеспечивающий в культуральной среде высокие концентрации аминокислоты — проницаемость клеточных мембран. Проницаемость клеточной мембраны увеличивают либо с помощью мутаций, либо путем изменения состава питательной среды. В последнем случае в культуральной среде создают дефицит биотина (контролирует содержание в клеточной мембране фосфолипидов) и добавляют пенициллин (нарушает биосинтез клеточных стенок бактерий, что повышает выделение аминокислот в среду).
Как источники углерода наиболее доступны углеводы — глюкоза, сахароза и реже фруктоза и мальтоза. Для снижения стоимости питательной среды в качестве источников углерода используют вторичное сырье: свекловичную мелассу, молочную сыворотку, гидролизаты крахмала, сульфитные щелока. В качестве источников азота применяют мочевину и соли аммония (сульфаты и фосфаты). Стимуляторами роста выступают экстракты кукурузы, дрожжей и солодовых ростков, гидролизаты отрубей и дрожжей, витамины группы В. Кроме того, в питательную среду добавляют необходимые для жизнедеятельности макро- и микроэлементы (Р, Са, Mg, Mn, Fe и др.).
Высокоочищенные препараты лизина получают после фракционирования фильтрата культуральной жидкости методом ионообменной хроматографии на катионите. Их используют для повышения питательной ценности пищевых продуктов и в медицинской промышленности. Кроме высокоочищенных препаратов лизина получают иные виды его товарной формы: жидкий концентрат лизина (ЖКЛ), сухой кормовой концентрат лизина (ККЛ) и высококонцентрированные кормовые препараты, характеризующиеся относительно меньшей степенью очистки в сравнении с первым препаратом.
Биотехнологический процесс производства триптофана
Подобно лизину триптофан образуется в ходе разветвленного метаболического пути, поэтому для его производства используют ауксотрофных мутантов, у которых блокированы реакции, ведущие к синтезу фенилаланина и тирозина. Однако при выращивании мутантных штаммов в среде с минимальной концентрацией этих аминокислот, не вызывающей регуляторных эффектов, избыточное накопление триптофана в среде не наблюдается, что объясняется особенностью процессов регуляции биосинтеза триптофана у микроорганизмов.

Рисунок 3 – Разветвленный метаболический путь синтеза АК
Метаболическим предшественником триптофана служит антраниловая кислота, которая возникает из хоризмовой кислоты под действием антранилат-синтетазы. Триптофан оказывает ингибирующее действие на антранилатсинтетазу, поэтому для обхода метаболического контроля синтез фермента индуцируют ступенчатым введением предшественника — антраниловой кислоты. В связи с этой особенностью промышленное производство триптофана организовано преимущественно по двухступенчатой схеме. На первом этапе химическим способом синтезируют антраниловую кислоту, которую с помощью энзиматической системы мутантных штаммов дрожжей Candida utilis переводят в триптофан.
Биомассу дрожжей выращивают при температуре 30 °С в среде, содержащей свекловичную мелассу, мочевину и минеральные компоненты. Через сутки в ферментер вводят 5 %-й спиртовой раствор антраниловой кислоты и 50 %-й раствор мочевины, а через 3-4 ч после введения предшественника дополнительно добавляют источник углерода (25 %-й раствор мелассы). Антраниловую кислоту и мочевину подают через каждые 6 ч, а мелассу — через каждые 12 ч. Процесс двухступенчатой ферментации завершается через 144 ч и обеспечивает содержание триптофана в культуральной среде до 6 г/л. Кроме триптофана микробиологическим способом с использованием предшественников получают гистидин, изолейцин, метионин, серии и треонин.
После сушки культуральной жидкости получают кормовой концентрат триптофана (ККТ), который включает белки, свободный триптофан, витамины Вь В2 и PP. Высокоочищенные кристаллические препараты триптофана образуются после дополнительной очистки культуральной жидкости методом ионообменной хроматографии на колонке, заполненной катионитом.
Биосинтез аргинина, глутамина, пролина и треонина
Для получения аминокислот — конечных продуктов неразветвленных метаболических путей, например аргинина, ауксотрофные мутанты не используют. В этом случае применяют мутанты с дефектами регуляции биосинтеза аминокислоты, т.е. регуляторные мутанты. Помимо аргинина регуляторные мутанты используют для получения серина и цитруллина.

Рисунок 4 – Цикл трикарбоновых кислот
Успешное производство с участием микроорганизмов таких аминокислот, как глутаминовая аминокислота, глутамин и пролин, обеспечивает стимуляция образования аминокислот в ответ на изменение условий внешней среды. Метаболическим предшественником при биосинтезе глутаминовой кислоты служит а-кетоглутаровая кислота, возникающая в цикле Кребса из изолимонной кислоты под действием изоцитратдегидрогеназы.
При выращивании бактерий родов Corynebacterium или Brevibacterium на углеводном сырье (гидролизат крахмала, тростниковая или свекловичная меласса), на этаноле или ацетате и при дефиците биотина в культуральной среде накапливается глутаминовая кислота с концентрацией 30 г/л. Важнейшее условие для образования этой аминокислоты — подавление активности глутаматдегидрогеназы. При высоком содержании в среде биотина и солей аммония обеспечиваются условия для образования пролина, а при значительных концентрациях ионов аммония и ионов цинка в слабокислой среде — для синтеза глутамина.
Яркий пример больших возможностей генетической инженерии — создание во ВНИИ генетики и селекции промышленных микроорганизмов штамма Е. coli для получения треонина. В результате были изменены не только регуляторные свойства фермента аспартаткиназы, но и питательные потребности штамма. Введение в геном бактерии нового гена обеспечило бактерии возможность использования в качестве источника углерода сахарозу, основного дисахарида традиционного промышленного сырья — свекловичной мелассы. Перечисленные манипуляции наряду с амплификацией плазмид, содержащих оперон треонина, позволили значительно увеличить производительность штамма бактерии и получить за 40 ч ферментации 100 г L-треонина на 1 л культуральной жидкости. Учитывая исключительные способности штамма Е. coli к сверхсинтезу L-треонина, японская фирма «Адзиномото» приобрела в 1982 г. лицензию на использование российского штамма - продуцента треонина для организации собственного производства.
Заключение
Характерная особенность процессов получения аминокислот микробиологическим способом, равно как и других биотехнологических производств, — полное использование побочных продуктов, что превращает большинство из них в безотходные и экологически чистые технологии.
Высокая потребность в аминокислотах непрерывно стимулирует разработку принципиально новых и более эффективных биотехнологических способов их получения при наращивании темпов и объемов промышленного производства. В настоящее время в животноводстве стоит проблема балансирования кормовых рационов по полноценному протеину. Натуральные корма, используемые в животноводстве, имеют не оптимальный аминокислотный состав. Для доведения концентрации аминокислот в кормовом рационе до оптимума требуется добавление препаратов чистых аминокислот, особенно незаменимых, полученных промышленным способом. В мире ежегодно производится не менее 300 тыс.т. кормовых препаратов незаменимых аминокислот. В пищевой промышленности также используются аминокислоты, полученные путем микробиологического синтеза, например, глутаминовая кислота. Некоторые аминокислоты, например метионин, используются в фармацевтической промышленности для производства диетических пищевых добавок.
Список источников
-
Биотехнология / Т. Г. Волова. – Новосибирск: Изд-во Сибирского отделения Российской Академии наук, 1999. -
Биотехнология: учеб. пособие для студ. высш. учеб. заведений / Сазыкин Ю.О., Орехов С.Н., Чакалева И.И.; под ред. А.В. Катлинского. – 3-е изд., стер. – М.: Издательский центр «Академия», 2008. -
Зимина М.Н., Носкова С.Ю., Кригер О.В. Особенности получения кормовых аминокислот при культивировании коринебактерий на соевой мелассе // Вестник Балтийского федерального университета им. И. Канта. Серия: Естественные и медицинские науки. 2022. №3. -
Попов В. Н., Корнеева О. С., Искусных О. Ю. Инновационные способы переработки биоотходов // Вестник ВГУИТ. 2020. №1 (83). -
Промышленный биосинтез аминокислот, 2020. Электронный ресурс «Propionix: пищевые технологии и биопродукты» / Режим доступа: https://propionix.ru/biosintez-aminokislot (Дата обращения: 08.04.2023). -
Салова Е.В. Объекты современных биотехнологий в пищевой промышленности и сельском хозяйстве // Научно-образовательный журнал для студентов и преподавателей «StudNet». 2022. №4. -
Шульга С.М., Тигунова О.А., Ткаченко А.Ф., Бейко Н.Е. Интенсификация биосинтеза треонина штаммом Brevibacterium flavum // Biotechnol. acta. 2011. №5.