Файл: В перманганатометрии стандартным раствором является кмnО.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 25.10.2023
Просмотров: 40
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
1. Пермангонатометрия. Сущность метода. Условия титрования. Особенности приготовления растворов окислителей и восстановителей, их хранение, установка точной концентрации.
В перманганатометрии стандартным раствором является КМnО4. Сущность метода заключается в окислении восстановителей раствором перманганата калия. Окисление перманганатом калия можно проводить в кислой, нейтральной и щелочной среде. Но практически окисление проводят в сильнокислой среде, в которой перманганат-ион проявляет наиболее сильные окислительные свойства. Продуктом восстановления КМnО4 в кислой среде является почти бесцветный ион Мn2+:
МnО4 + 8Н+ + 5ē → Мn2+ + 4Н2О
Согласно закону эквивалентов молярная масса эквивалентов КМnО4 в кислой среде равна М/5.
В нейтральной среде:
MnO4- + 4H+ + 3 ē = MnO2 + 2 Н2О, тогда молярная масса эквивалентов КМnО4 равна М/3.
В щелочной среде: MnO4- + ē = MnO42-
Специального индикатора для титрования не требуется, так как ион МnО4 имеет хорошо заметную розовую окраску.
Для создания сильнокислой среды пользуются растворами H2SO4
Приготовить стандартный раствор по точной навеске нельзя по ряду причин:
1. Перманганат калия КМnО4 содержит примеси.
2. При растворении в воде перманганат калия окисляет органические вещества, которые содержатся в дистиллированной воде.
3. На устойчивость раствора КМnО4 влияет даже свет.
Все эти факторы изменяют концентрацию раствора КМnО4 и вследствие этого нельзя приготовить его первичный стандартный раствор. В этом случае сначала готовят раствор КМnО4 с концентрацией, приблизительно равной требуемой (обычно 0,02 или 0,05 моль/л). Раствор оставляют на несколько дней до полного осаждения МnО2, хранят в темном месте в бутыли из темного стекла. После этого раствор КмnО4 берут для работы с помощью сифона так, чтобы осадок МnО2 остался на дне бутылки.
В качестве исходных веществ для установки точной концентрации рабочего раствора КМnО4 обычно применяют оксалат аммония (NH4)2C2O4 • Н2О, оксалат натрия Na2C2O4 и щавелевую кислоту Н2С2О4 • 2Н2
О. Наиболее удобным из этих веществ является оксалат натрия, так как он кристаллизуется без воды и не гигроскопичен.
Для определения восстановителей, как правило, используют методы прямого титрования, для определения окислителей — методы обратного титрования(окислители восстанавливают титрованным р-ром щавелевой кислоты и избыток восстановителя оттитровывают перманганатом калия), а для определения индифферентных веществ — методы как обратного, так и косвенного (заместительного) титрования.



2 Кулонометрия как «абсолютный» метод анализа. Прямая кулонометрия. Примеры применения.
Кулонометрический метод анализа основан на применении известного закона Фарадея, связывающего количество прореагировавшего на электроде вещества с величиной прошедшего через электрод заряда. Прохождение электрического тока через металлы и графит связано с движением электронов, а через растворы и расплавы – с движением ионов. Поэтому единственным способом протекания стационарного тока через электрод оказывается электрохимическая реакция. Уравнение Фарадея записывается следующим образом.
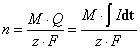 ,
,где n – количество прореагировавшего вещества;
М – эквивалентная масса определяемого вещества, мг/моль;
I – сила тока, А;
t – время электролиза, с;
z – количество электронов, переходящих в ходе реакции на одну молекулу определяемого вещества;
F – константа Фарадея (96485,3415 ± 0,0039), Кл/моль.
Время электролиза, необходимое для превращения определяемого вещества, определяется различными инструментальными методами, как электрохимическими, так и оптическими.
Наиболее распространенным в настоящее время является гальваностатический режим проведения кулонометрических определений, так как инструментально удобнее определять время, чем какие-либо другие параметры.
Кулонометрическое определение может проводиться с прямой реакцией определяемого вещества на электроде, однако чаще на электроде вырабатывается титрант, реагирующий с определяемым веществом. Этот метод гораздо более универсальный, так как один и тот же титрант может применяться для определения разнообразных веществ, а также и для определения групповых параметров.
Прямая кулонометрия при постоянной силе тока используется в тех случаях, когда определяемое вещество находится на поверхности электрода или предварительно выделено на этой поверхности.
Прямые кулонометрические определения обычно проводят при постоянном потенциале
Для того чтобы электрохимическая реакция прошла до конца, теоретически требуется бесконечно большое время. Практически при проведении электролиза всегда остаётся некоторый фоновый ток (Iф), обусловленный превращением примесей, поэтому обычно электролиз считают законченным, когда сила тока станет равной 0,01 – 0,001 от первоначального значения. Для ускорения процесса электролиза необходимо создать такие условия, чтобы величина k в зависимости I от t была как можно большей. Для этого используют рабочий электрод с большой площадью поверхности, берут малый объём раствора и, кроме того, раствор в ячейке постоянно перемешивают (это приводит к уменьшению ).
Количество электричества, затраченное на электрохимическое превращение вещества, в потенциостатической кулонометрии равно:
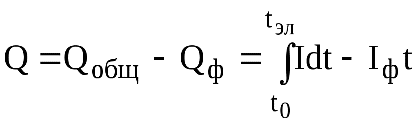
Кулонометрию применяют для определения как следовых, так и весьма больших количеств веществ с высокой точностью. Погрешность прямой кулонометрии в потенциостатическом режиме обычно 0,5-1%, а кулонометрического титрования в гальваностатическом режиме - 0,1-0,3%. Кулонометрию применяют для анализа многих неорганических (практически все металлы, галогены, S и др.) и органических веществ(ароматические амины, нитро- и нитрозоcоединения, фенолы, азокрасители, алифатич. амиды и др.); определения воды в органических веществах; установления толщины и анализа металлических покрытий
; изучения процессов коррозии; исследования кинетики и механизма химических реакций (в т.ч. каталитических); определения констант равновесия реакций; установления числа электронов, участвующих в электрохимических и химических взаимодействиях. Кулонометрические детекторы широко используются в проточно-инжeкционном анализе и хроматографии.