Файл: Лабораторная работа 3 Теплоемкость идеального газа Цель работы.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 26.10.2023
Просмотров: 430
Скачиваний: 34
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Лабораторная работа № 3
«Теплоемкость идеального газа»
Цель работы:
-
Знакомство с теплоемкостью идеального газа в изохорическом и изобарическом процессах. -
Экспериментальное подтверждение закономерностей изопроцессов. -
Экспериментальное определение количества степеней свободы и структуры молекул газа в данной модели.
КРАТКАЯ ТЕОРИЯ:
Идеальным называется такой газ, в котором считается, что собственный объем молекул газа пренебрежимо мал по сравнению с объемом сосуда, в котором он находится, силы взаимодействия между молекулами газа отсутствуют, а столкновения между молекулами газа абсолютно упругие.
Внутренней энергией газа U называется сумма кинетической энергии хаотического (теплового) движения всех молекул газа и энергии взаимодействия молекул газа между собой. Для идеального газа внутренняя энергия – это только кинетическая энергия всех молекул газа.
Внутренняя энергия идеального газа определяется числом степеней свободы его молекул и температурой газа.
Числом степеней свободы i механической системы называется количество независимых величин, с помощью которых может быть однозначно задано положение системы в пространстве.
средняя кинетическая энергия молекулы:
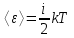
где i – сумма числа поступательных, числа вращательных и удвоенного числа колебательных степеней свободы молекулы:
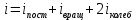
Теплоемкостью тела называется величина, равная количеству теплоты, которое нужно сообщить телу, чтобы повысить его температуру на 1 К.
Удельная теплоемкость вещества – величина, равная количеству теплоты, необходимому для нагревания 1 кг вещества на 1 К:
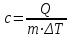 .
.Молярная теплоемкость вещества – величина, равная количеству теплоты, необходимому для нагревания 1 моля вещества на 1 К:
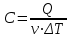 , откуда
, откуда 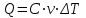 .
.Различают теплоемкости газа при изохорном и изобарном процессах.
1. Молярная теплоемкость газа при изохорном процессе
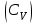 .
. Для изохорного процесса первое начало термодинамики:
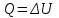 .
.Следовательно
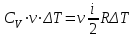 , откуда
, откуда 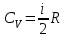 .
.2. Молярная теплоемкость газа при изобарном процессе
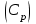 .
.Для изобарного процесса первое начало термодинамики:
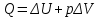 .
.Так как для изобарного процесса
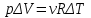 ,
, то
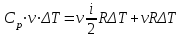 ,
,откуда
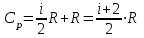 .
.Рассмотрим теплоемкость идеального газа в изопроцессах.
-
Адиабатический.
В адиабатическом процессе теплообмена с окружающей средой не происходит, т.е.
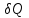 =0. Следовательно, теплоемкость идеального газа в адиабатическом процессе также равна нулю: С
=0. Следовательно, теплоемкость идеального газа в адиабатическом процессе также равна нулю: С =0.
=0.-
Изотермический.
В изотермическом процессе постоянна температура, т.е. dT = 0. Следовательно, теплоемкость идеального газа стремится к бесконечности:
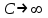 .
.-
Изохорный.
В изохорическом процессе постоянен объем, т.е. δV = 0. Элементарная работа газа равна произведению изменения объема на давление, при котором происходит изменение (δA = δVP). Первое начало термодинамики для изохорического процесса имеет вид:
dU = δQ = C
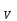 ΔT.
ΔT. А для идеального газа
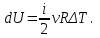
Таким образом
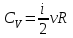 ,
, где i - число степеней свободы частиц газа.
-
Изобарный.
В изобарическом процессе (P = const):
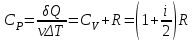
ВЫПОЛНЕНИЕ РАБОТЫ
Результаты измерений и расчетов:
1. Одноатомный газ: V0= 40 · 10-3 м3, p0= 140 · 103 Па, ν =1,8 · 10-3 кмоль
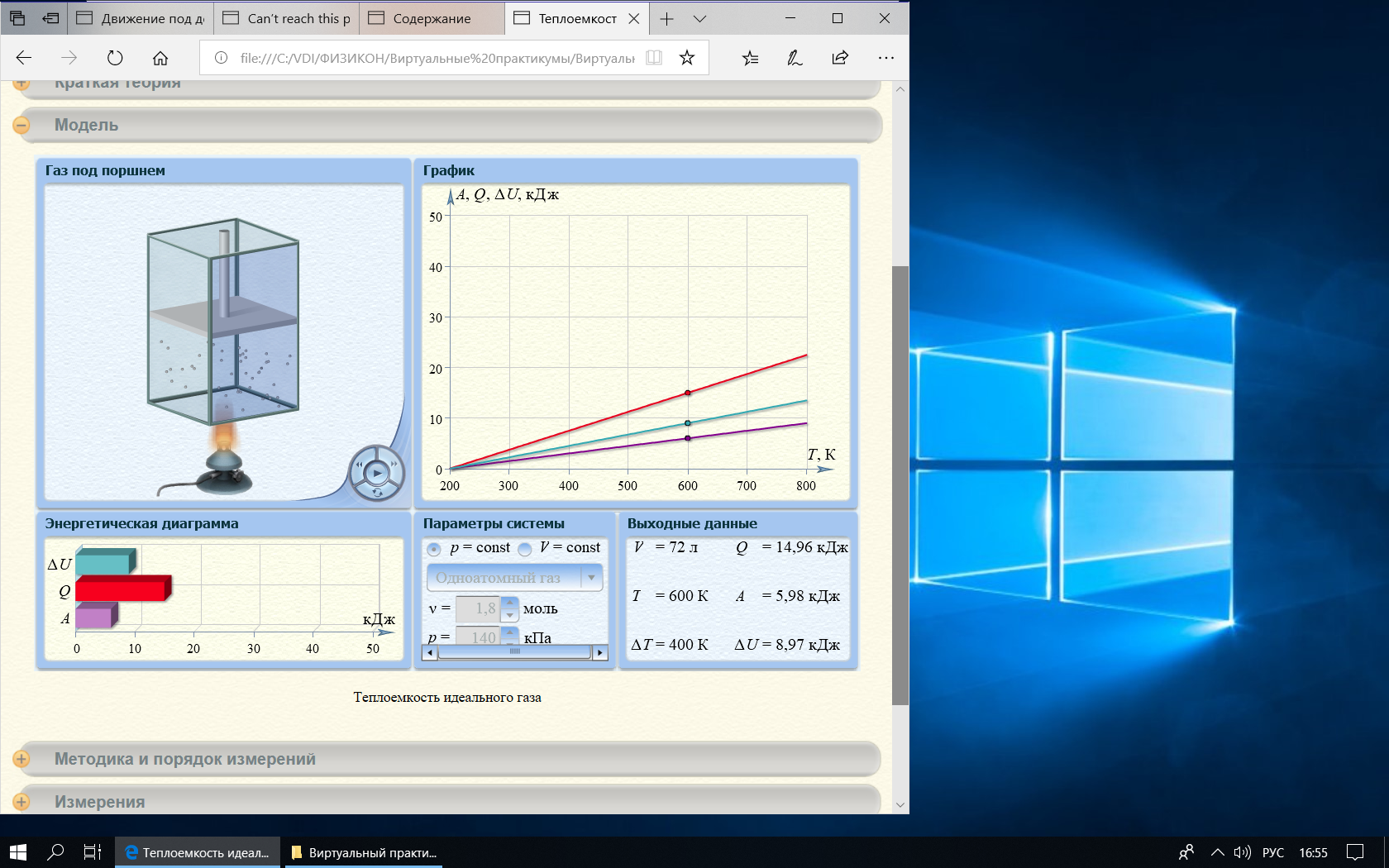
Таблица 2
| Т, К | 300 | 400 | 500 | 600 | 700 | 800 |
| QV,кДж | 2,24 | 4,49 | 6,73 | 8,97 | 11,22 | 13,46 |
| Т, К | 295 | 404 | 495 | 600 | 704 | 800 |
| Qр,кДж | 3,55 | 7,63 | 11,03 | 14,96 | 18,85 | 22,44 |
Графики зависимостей QV=f(T) и Qp=f(T) для одноатомного газа.
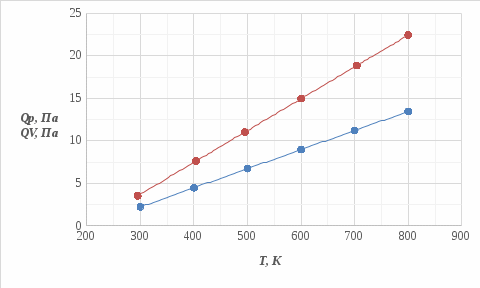
Определение Cp теплоемкости и cp молярной теплоемкости газа при постоянном давлении:
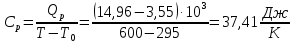
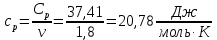
Определение CV теплоемкости и cV молярной теплоемкости газа при постоянном объеме:
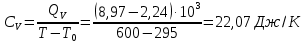
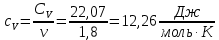
Определение γ постоянной адиабаты:
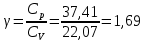
Определение iчисла степеней свободы молекул газов:
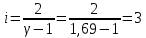
2. Двухатомный газ: V0= 40 · 10-3 м3, p0= 140 · 103 Па, ν =1,8 · 10-3 кмоль
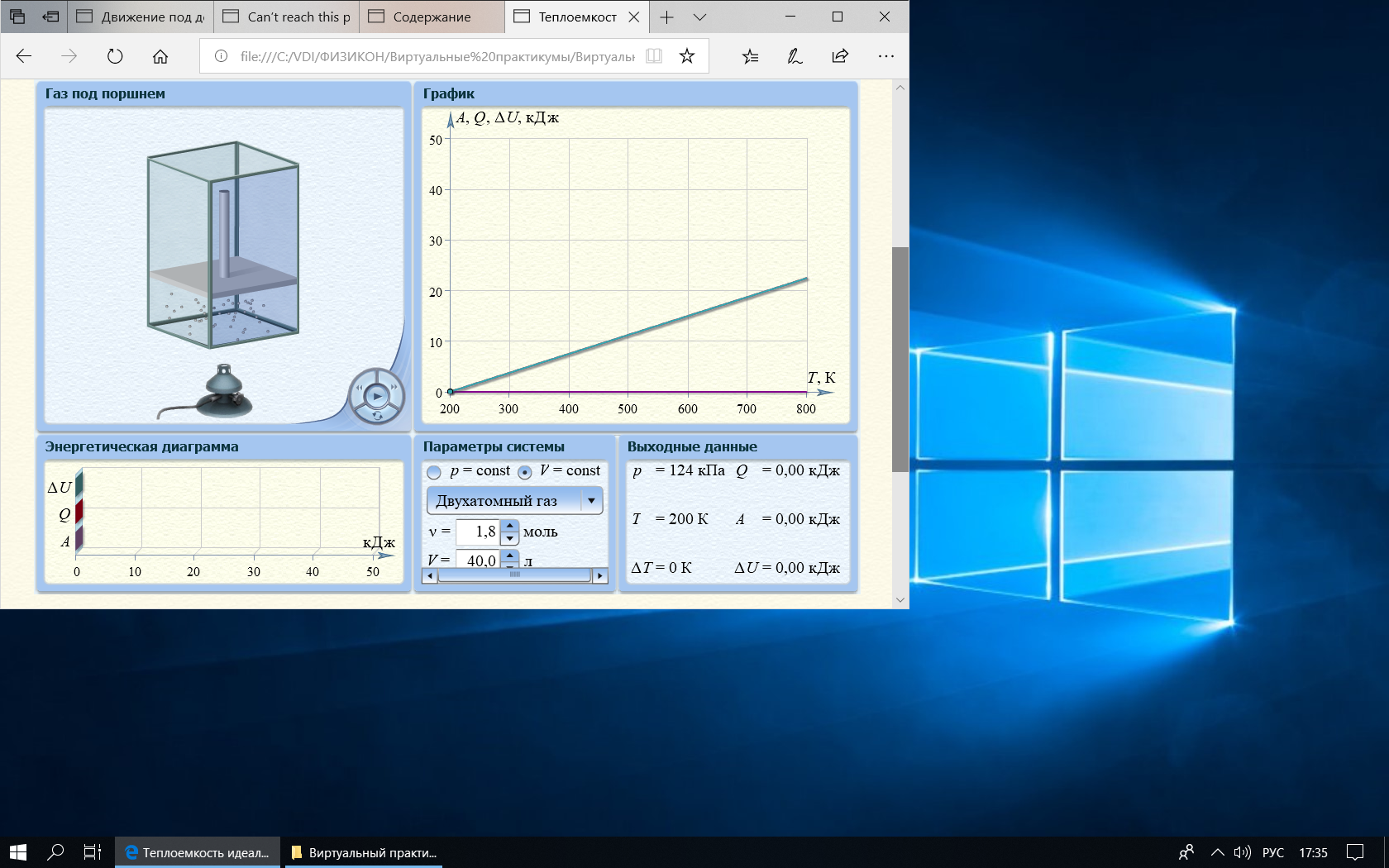
Таблица 3
| Т, К | 300 | 395 | 500 | 605 | 700 | 795 |
| QV,кДж | 3,74 | 7,29 | 11,22 | 15,14 | 18,70 | 22,25 |
| Т, К | 300 | 405 | 505 | 605 | 700 | 800 |
| Qр,кДж | 5,24 | 10,73 | 15,97 | 21,20 | 26,18 | 31,41 |
Графики зависимостей QV=f(T) и Qp=f(T) для двухатомного газа:
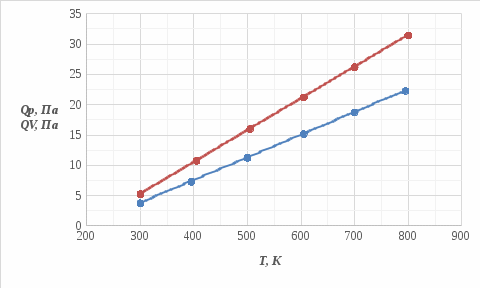
Определение Cp теплоемкости и cp молярной теплоемкости двухатомного газа при постоянном давлении:
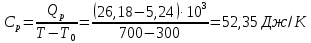
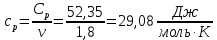
Определение CV теплоемкости и cV молярной теплоемкости двухатомного газа при постоянном объеме:
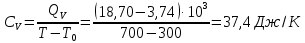
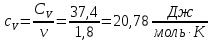
Определение γ постоянной адиабаты:
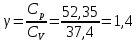
Определение iчисла степеней свободы молекул газов:
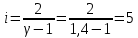
3. Трехатомный газ: V0= 40 · 10-3 м3, p0= 140 · 103 Па, ν =1,8 · 10-3 кмоль
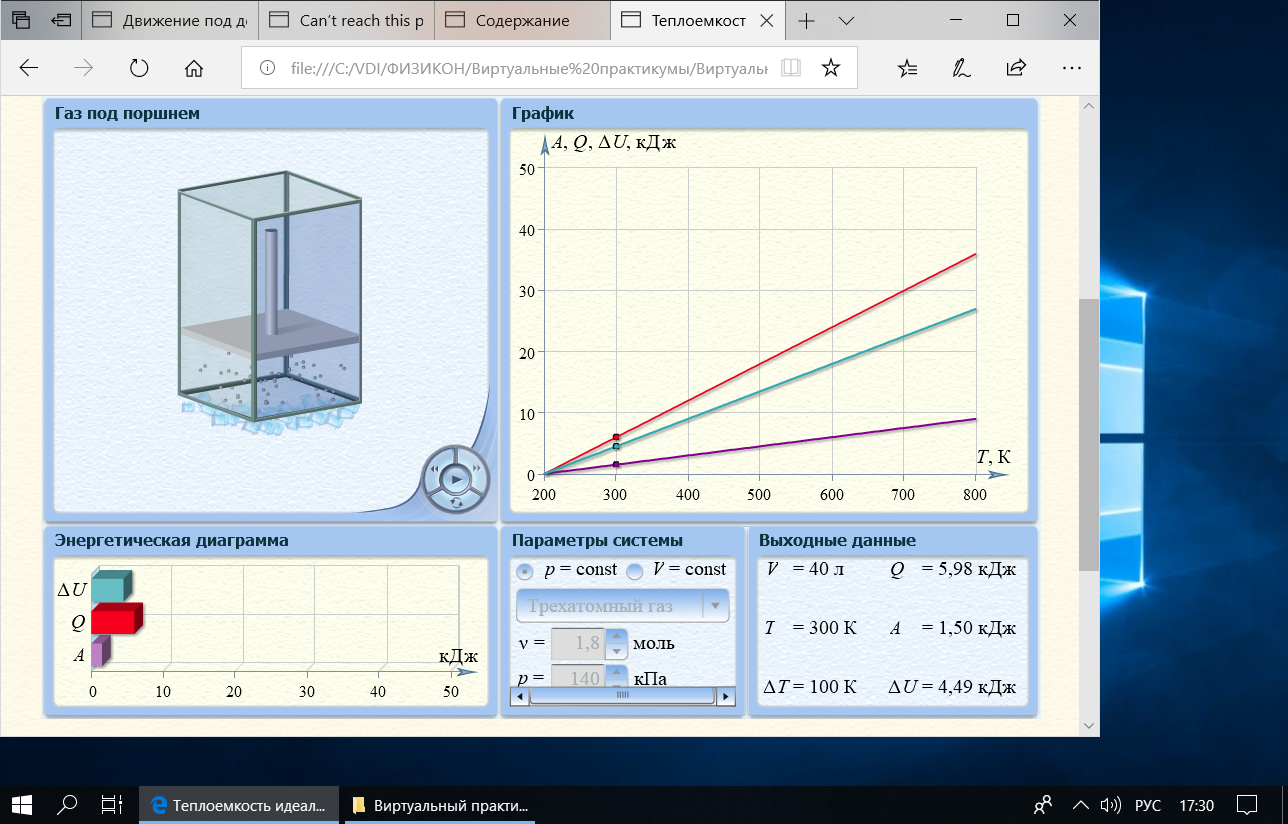
Таблица 4
| Т, К | 300 | 395 | 495 | 605 | 695 | 800 |
| QV,кДж | 4,49 | 8,75 | 13,24 | 18,17 | 22,21 | 26,92 |
| Т, К | 300 | 395 | 495 | 600 | 700 | 800 |
| Qр,кДж | 5,98 | 11,67 | 17,65 | 23,93 | 29,92 | 35,90 |
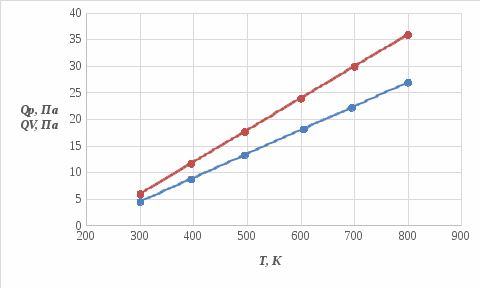
Графики зависимостей QV=f(T) и Qp=f(T) для трехатомного газа:
Определение Cp теплоемкости и cp молярной теплоемкости трехатомного газа при постоянном давлении:
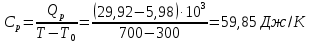
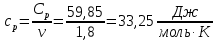
Определение CV теплоемкости и cV молярной теплоемкости трехатомного газа при постоянном объеме:
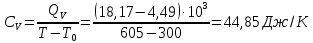
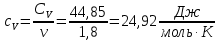
Определение γ постоянной адиабаты:
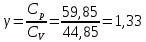
Определение iчисла степеней свободы молекул газов:
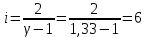
Вывод: в работе определены теплоемкости для идеального газа в изохорном и изобарном процессах. Построены графики зависимостей теплоты переданной одноатомному, двухатомному и трехатомному газу. Полученные графики имеют вид прямой, проходящей через начало координат и качественно совпадают с соответствующей формулой
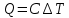 . По результатам измерений и расчетов были определено число степеней свободы газа и постоянная адиабаты.
. По результатам измерений и расчетов были определено число степеней свободы газа и постоянная адиабаты. Для одноатомного газа теплоемкости
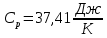 и
и 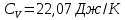 ,
, Молярные теплоемкости
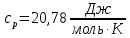 и
и 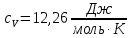 .
. Число степеней свободы газа и постоянная адиабаты
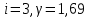
Для двухатомного газа теплоемкости
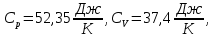
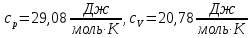
Число степеней свободы газа и постоянная адиабаты
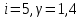
Для трехатомного газа теплоемкости
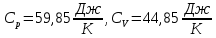
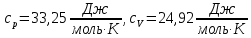
Число степеней свободы газа и постоянная адиабаты
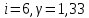
Теплоёмкость термодинамической системы зависит от того, как изменяется состояние системы при нагревании.