ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 26.10.2023
Просмотров: 26
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
| | Управление рисками (ICH Q 9) | |
ЦЕЛЬ: сформировать знания о ICH Q 9
ЗАДАЧИ ОБУЧЕНИЯ ознакомить студентов с:
· Надлежащей практикой для национальных лабораторий качества лекарственных средств
· Структурой стандарта
· Основными задачами лабораторного центра
ОСНОВНЫЕ ВОПРОСЫ ТЕМЫ:
1. Основных принципы управления рисками качества
2. Цели и задачи управления рисками
3. Области применения управления рисками качества
4. Процесс управления рисками
5. Изучение возможных рисков
6. Идентификация рисков в процессе производства лекарственных средств ·
7. Анализ и оценка критичности рисков
8. Определение мер по предотвращению или снижению риска
9. Методы контроля и их принципы
10. Использование результатов и документирование
11. Информирование о рисках и пересмотр
12. Проведение и документирование анализа рисков
РАЗДАТОЧНЫЙ МАТЕРИАЛ
В последние годы наблюдается тенденция изменения статуса подхода, основанного на анализе рисков, когда эти принципы постепенно переходят из области актуальных тенденций в разряд обязательных требований. Так, Агентство FDA США в 2004 году в своей новой концепции «Правила GMP в XXI веке» обозначило анализ рисков как основу для определения критических факторов в отношении качества при проведении инспектирования. В 2005 году было принято трехстороннее руководство ICH - документ Q9 «Управление рисками качества», а с марта 2008 года он включен в качестве приложения (№ 20) в Правила GMP Европейского Сообщества.
В упоминаемом выше руководстве ICH Q9 изложены два основных принципа управления рисками качества:
-
оценка риска качества должна базироваться на научных знаниях и в конечном итоге должна быть связана с защитой пациента; -
уровень затраченных усилий, использования формализованных подходов и документирования процесса управления рисками качества должен быть соразмерен уровню риска..
В Правилах GMP имеется лишь краткое указание на использование подхода, основанного на оценке рисков,:«Для определения состава и объема работ по валидации следует использовать подход, основанный на оценке рисков» (Приложение 15, п.1) . Н и в основном тексте, ни в приложениях Правил GMP нет описания подходов и методов проведения и документирования, и до выхода документа Q9 не было другого руководства или рекомендаций, в которых более подробно были описаны методы и инструменты оценки рисков для качества при разработке и производстве лекарств. Поэтому на практике использовались методы и инструменты анализа рисков, более детально разработанные в других стандартах и документах. Из них наиболее широко применяются методы, содержащиеся в стандартах по анализу видов, последствий и критичности отказов в технике ( FMECA, FMEA ) и в стандарте безопасности пищевых продуктов ( HACCP ). Поэтому документ Q9 не содержит описания конкретных инструментов, а опирается на уже хорошо разработанные и оправдавшие себя подходы.
Цели и задачи управления рисками
Управление рисками качества и подходы, основанные на оценке рисков, могут использоваться для выполнения разных задач. Поэтому в первую очередь должны быть определены цели проводения такого анализа. В области фармпроизводства можно сформулировать, например, следующие цели:
• Избежание или снижение потенциального ущерба для качества ЛС
• Управление системой качества
• Выбор критических параметров
• Принятие решения в случае отклонений
• Оптимальное использование ресурсов
• «Страхование» рисков
Избежание ущерба для качества представляет собой главную цель управления рисками качества; цель и задача анализа рисков при управлении системой качества может возникнуть для расстановки приоритетов в развитии этой системы или устранении недостатков, т.е. что необходимо делать в первую очередь, а что – потом. Другие частные цели, такие как принятие решения или выбор критических параметров могут ставиться при выполнении или проведении отдельных мероприятий, таких как валидация, выбор поставщика, принятие решения в случае отклонений от качества и т.д. Как правило, последние две цели, т.е. анализ рисков для определения оптимального использования ресурсов и страхование риска требует количественной или по крайней мере полуколичественной оценки.
В документе ICH Q9 подробно рассматриваются области применения управления рисками качества (см. таблицу 1). Разумеется, эти области связаны с вышеупомянутыми целями, и можно установить, какие из названных целей преследуются в той или иной области применения управления рисками.
Таблица 1
| Области | Примеры задач применения анализа рисков |
| Система качества | Объем документации, обучение персонала, отклонения от качества, аудиты, периодический пересмотр, управление изменениями |
| Регуляторные операции | Рассмотрение и инспектирование регистрации ЛС и лицензирования производства (объем и периодичность изучения) |
| Разработка ЛС | Проектирование продукта; выбор процесса и параметров; оценка свойств материалов; составление спецификаций, инструкций по применению; оценка необходимости доп. исследований |
| Проектирование фармпроизводств | Концепция зон и потоков; определение материалов, выбор оборудования и вспомогательных систем; объем квалификации; компьютерные системы управления процессом |
| Поставки материалов и оборудования | Оценка поставщиков; оценка пригодности материалов; оценка условий хранения; сравнительная оценка оборудования |
| Производство ЛС | Валидация и квалификация; объем внутрипроизводственного контроля; объем мониторинга; санитарные мероприятия |
| Контроль ЛС | Принятие решения в случае результатов ООС; определение программы исследования стабильности и переконтроля |
| Упаковка и маркировка ЛС | Проектирование упаковки; выбор системы для упаковки и укупорки; разработка процедур контроля маркировки |
Процесс управления рисками
Чтобы рассмотреть последовательность проведения анализа рисков, можно руководствоваться схемой управления рисками качества, приведенной в документе ICH Q9.
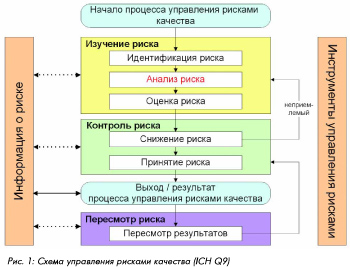
В соответствии с этой схемой процесс управления рисками может быть представлен следующим образом:
-
Изучение возможных отклонений / ошибок (потенциальных рисков) для отдельных компонентов и систем в целом (технологический процесс, оборудование, инженерные системы обеспечения, помещения и т.д.) -
Анализ и оценка критичности отклонений в отношении качества -
Определение мер по предотвращению или снижению риска -
Использование результатов и документирование -
Информирование о рисках и пересмотр рисков
Изучение возможных рисков для отдельных компонентов и системы относится к стадии идентификации риска. Для процесса должно быть составлено описание по стадиям и операциям или приведена блок-схема с указанием стадий и критических факторов (см. пример на рис. 2); для оборудования или систем должно быть приведено описание с перечислением компонентов (и/или приложены необходимы схемы).
Как правило, идентификация рисков в процессе производства лекарственных средств должна охватывать следующие аспекты:
· Состояние помещений и гигиена
· Потоки персонала и материалов
· Окружающие условия
· Спецификации на критические материалы
· Технические аспекты функционирования оборудования
· Поведение продукта (физические свойства, контакт с окружающей средой и оборудованием и др.)
На этой стадии изучения рисков должна использоваться вся имеющаяся информация (документация по процессам, оборудованию, продуктам, проектная документация, эмпирические сведения и опыт на основе аналогичных объектов). В данном случае очень важна достоверность и обширность изучения исходных данных, поэтому наиболее надежные результаты могут быть получены предпочтительно за счет привлечения опытных специалистов из соответствующих областей. В сложных случаях полезно использовать метод экспертной оценки, при этом также важна квалификация и опыт привлекаемых экспертов.
Анализ и оценка критичности рисков
, как правило, включает определение величины риска на основании анализа вероятности и тяжести вреда для качества. При этом для GMP -рисков (качественная оценка) достаточно анализа того, существует ли угроза нарушения требований GMP; в любом случае должно прослеживаться влияние на качество продукта.
При необходимости количественной оценки должны использоваться методы и подходы, учитывающие величину вероятности, тяжести и (дополнительно) возможности обнаружения вреда или ущерба.
Для качества и надежности результата важна достоверность данных, поэтому большое значение здесь также приобретает опыт экспертов в данной области. В сложных случаях можно использовать метод экспертной оценки. Поскольку анализ и оценка рисков предполагает возможность или необходимость проверки, то в документации на данной стадии полезно приводить пояснение или обоснование оценки критичности риска, чтобы не возникало разногласий или непонимания при коммуникации и проведении проверок и инспекций.
Для многих задач применения анализ и оценка рисков является окончательной стадией, дающей требуемый результат. Примерами таких задач являются, например, планирование валидации, выбор оборудования и систем, оценка поставщиков и др.
Определение мер по предотвращению или снижению риска относится к стадии контроля рисков. Контроль подразумевает 1) измерение уровня параметра, характеризующего риск (опасного фактора), и 2) управление риском, т.е. принятие меро по его снижению или предотвращению. Поэтому для идентификации и измерения опасного фактора должны быть указаны возможные контрольные признаки, позволяющие качественно или количественно протестировать этот фактор. Для этих контрольных признаков должны быть определены критерии приемлемости, в пределах которых риск считается допустимым.
Методы контроля, предусмотренные для данного риска на данной стадии, рассматриваются как предупреждающие действия в отношении риска, поэтому они также указываются как часть стадии контроля рисков. Все же по характеру действия их можно определить как пассивные методы контроля рисков.