Файл: Министерство науки и высшего образования и российской федерации.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 07.11.2023
Просмотров: 20
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ И РОССИЙСКОЙ ФЕДЕРАЦИИ
Федеральное государственное бюджетное образовательное учреждение высшего образования «Кузбасский государственный технический университет имени Т.Ф. Горбачева»
Институт химических и нефтегазовых технологий
Кафедра химии, технологии неорганических веществ и наноматериалов
Контрольная работа
По дисциплине: «НОВЫЕ ТЕХНОЛОГИИ ПРОИЗВАДСТВА МАТЕРИАЛОВ И ПРОДУКТОВ»
Вариант 3
Выполнил:
ст-т гр. ХНбз
Батанова Т.А
Проверила:
Доцент, к.х.н. Суровая В.Э.
Кемерово 2023
Содержание
1. Новые технологии в производстве аммиака. Совместное прои-зводство аммиака и метанола. Установка для осуществления способа, модернизации установки синтеза аммиака…………………………………………..3
2. Материальный баланс……………………………….…………….…..8
Список используемой литературы
1. Новые технологии в производстве аммиака. Совместное производство аммиака и метанола. Установка для осуществления способа, модернизации установки синтеза аммиака.
Изобретение относится к способам совместного производства аммиака и метанола. Способ совместного производства аммиака и метанола включает сероочистку, двухступенчатую конверсию метана, высокотемпературную конверсию оксида углерода, очистку газа от диоксида углерода абсорбцией горячим раствором поташа, синтез метанола под давлением 5 МПа и синтез аммиака под давлением 30 МПа, при этом очистку газа от диоксида углерода ведут непосредственно после высокотемпературной конверсии оксида углерода до остаточного содержания диоксида углерода 0,48 - 0,5 об.% с последующим синтезом метанола по проточной схеме на низкотемпературном медьсодержащем катализаторе (например ДН -8-2) под давлением 5 МПа при температуре 200 - 300°С и при соотношении Н2 : СО = 22.5 : 1, после отделения метанола газ компримируют и направляют на синтез аммиака по циркуляционной схеме. Реализация данного способа позволяет снизить суммарное содержание инертных примесей (аргон + метан) в свежем синтез-газе с 1,5 до 0,75 об.%, что уменьшает число продувок. Отравляющие катализатор синтеза аммиака оксиды углерода присутствуют в виде следов. 1 ил.
Изобретение относится к способам совместного производства аммиака и метанола.
Известно много схем совместного получения аммиака и метанола. Большинство из этих схем работают по схожему принципу. Существует проект совместного производства аммиака и метанола, согласно которому из конвертированного газа вначале получают метанол. При этом за счет переработки оксида углерода концентрация его в газе снижается. Далее остаточный оксид углерода окисляют кислородом воздуха и гидрируют до метана. Газовая смесь, очищенная от диоксида углерода, поступает на синтез аммиака. По другой схеме смесь оксидов углерода и водорода пропускают при температуре 160 - 300oC и давлении 5 - 15 МПа через слои катализатора. Катализатор размещается в нескольких, последовательно расположенных, реакторах. Циркуляция газа позволяет снизить содержание оксида углерода в отходящих газах, который затем конвертируют водяным паром. После очистки газа от диоксида углерода и метана остаточный водород используют для получения аммиака. Также разработана схема с несколько иным принципом действия. Согласно этому способу природный газ компримируют, очищают от сернистых соединений, смешивают с водяным паром и подают в трубчатую печь на конверсию. После этого конвертированный газ охлаждают в теплообменнике и направляют в диффузоры, где на селективных полимерных мембранах выделяют оксид углерода и водород. Выделенные газы смешивают в смесителе, компримируют до давления синтеза и направляют в колонну, где на катализаторе осуществляют синтез метанола. Непродиффундировавший в диффузорах газовый поток смешивают с нагретым воздухом и направляют в шахтный реактор, где осуществляется конверсия остаточных углеводородов. В качестве прототипа принимают схему совместного производства аммиака и метанола, по которой синтез-газ перед синтезом аммиака проходит следующие технологические стадии: очистка от соединений серы, конверсия избыточного оксида углерода, компримирование, очистка от диоксида углерода и синтез метанола. Для обеспечения глубокой переработки оксидов углерода и получения газа, обогащенного водородом, на стадии синтеза метанола поддерживают высокое соотношение H
2:CO в свежем (5:1) и циркуляционном (14:1) газе.
Отличительной чертой всех вышеописанных схем является наличие циркуляции синтез-газа на стадии синтеза метанола, что приводит к продувкам и потерям технологического газа, а также последующая тонкая очистка газов, отходящих на синтез аммиака, от оксидов углерода.
Целью изобретения является снижение содержания вредных и инертных примесей в газе, идущем на синтез аммиака, и, как следстсвие, уменьшение числа продувок и потерь сырья.
За основу предлагаемой схемы принимают стандартную схему производства аммиака мощностью 1360 т аммиака в сутки. Но по сравнению со стандартной в предлагаемой схеме отсутствуют стадии низкотемпературной конверсии оксида углерода и метанирования. Вместо этого предлагают после высокотемпературной конверсии CO проводить очистку газа от диоксида углерода в абсорбере горячим раствором поташа до остаточного содержания CO2 в газе 0.48-0.50 об.%. Затем газ направляют не на гидрирование до метана, а на первую ступень компримирования до давления 5 МПа, после чего проводят синтез метанола при температуре 200-300oC. Синтез метанола проводят при отсутствии циркуляции синтез-газа по проточной схеме. Соотношение H2: CO в газе при синтезе метанола достигает значения 22.5:1. Синтез проводят на низкотемпературном медьсодержащем катализаторе для низкого давления, например ДН-8-2. Состав катализатора, мольные доли: CuO: ZnO: Cr2O3:MnO:MgO:Al2O3:BaO=1:0.3:(0.15-0.2):(0.05-0.1):(0.05-0.1): (0.25-0.3). После синтеза метанола газ возвращается на стадии стандартной схемы синтеза аммиака (дожимание газа до давления синтеза и непосредственно синтез по циркуляционной схеме).
На рис. 1 приведена принципиальная схема для реализации предлагаемого способа.
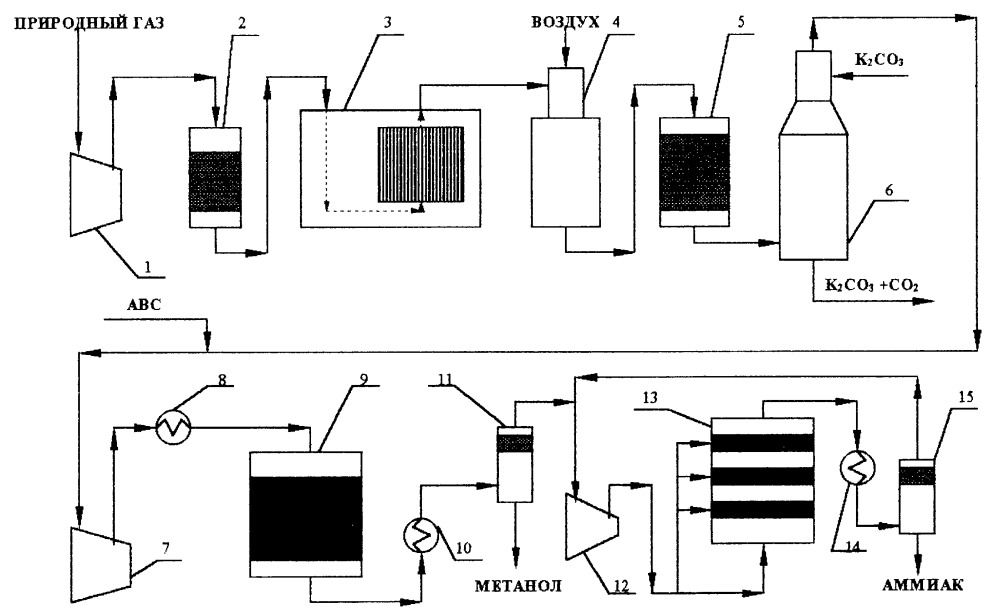
Рис. 1 – Схема производства
Природный газ сжимают в компрессоре 1 до давления 2.7 МПа и проводят сероочистку в адсорбере 2, затем газ направляют на двухступенчатую конверсию метана 3 и 4. После этого конвертированный газ, содержащий, об.%: N2 - 20.49, Ar - 0.26, H2 - 58.33, CO - 12.98, CO2 - 7.59, CH4 - 0.35, проходит высокотемпературную конверсию оксида углерода 5 при температуре 270oC и давлении 2.7 МПа. Далее газ с содержанием, об.%: N2 - 18.64, Ar - 0.23, Hz - 62.08, CO - 2.79, CO2 - 15.92, CH4 - 0.32, - направляют на очистку от диоксида углерода 6, после которой газ имеет следующий состав, об.%: N2
- 22.07, Ar - 0.28, H2 - 73.48, CO - 3.31, CO2 - 0.48, CH4 - 0.38. На следующем этапе в синтез-газ добавляют небольшое количество водорода для того, чтобы компенсировать нехватку H2 после синтеза метанола до стехиометрического в синтезе аммиака, и направляют в компрессор синтез-газа. После первой ступени компримирования 7 газ с давлением 5 МПа, содержащий об.%: N2 - 21.91, Ar - 0.28, H2 - 73.69, CO - 3.27, CO2 - 0.48, CH4 - 0.38, подогревают до 200oC в теплообменнике 8 и направляют в колонну 9 на синтез метанола под давлением 5 МПа при температуре 200 - 280oC на низкотемпературном медьсодержащем катализаторе с объемной скоростью 20000 ч-1. После охлаждения до 40oC в теплообменнике 10 и отделения метанола 11 газ, имеющий состав, об.%: N2 - 24.82, Ar - 0.31, H2 - 74.44, CH4 - 0.43, отправляют на вторую и последующие ступени 12 компримирования синтез-газа до 30 МПа. После каждой ступени компримирования установлены сепараторы для отбора сконденсировавшейся в процессе сжатия жидкости, также содержащей метанол. Затем газ идет на синтез аммиака 13 по циркуляционной схеме. После синтеза аммиака газ охлаждается в холодильнике 14, затем в сепараторе 15 происходит отделение продукционного аммиака.
Исследования проведены на проточной колонне синтеза метанола при температурах от 200 до 300oC на низкотемпературном медьсодержащем катализаторе ДН-8-2. Состав газа регистрировали хроматографом до и после синтеза. Результаты исследований показали, что начиная с температуры 220oC, оксиды углерода полностью превращаются в метанол. Выход метанола-сырца в диапазоне температур 240 - 280oC практически не изменяется и составляет около 4.5 об.% от общего количества синтез-газа, выходящего из колонны синтеза метанола. При этом содержание метанола в сырце колеблется от 91 до 95%. При температуре 300oC выход сырца несколько уменьшается (до 4 об. %), а содержание метанола в нем снижается до 87%. Поэтому наиболее целесообразно проводить процесс при температуре 240 - 280oC (для катализатора ДН-8-2).
В предлагаемой схеме содержание инертных примесей (аргона и метана) в газе, идущем на синтез аммиака, снижается в 2 раза за счет отсутствия стадии метанирования, а отравляющие катализатор синтеза аммиака оксиды углерода присутствуют в виде следов. Кроме этого, при увеличении расхода природного газа на 10% по сравнению со стандартной схемой синтеза аммиака удается получать такое же количество аммиака, что и по стандартной схеме, а также до 90000 т в год метанола-сырца с содержанием метанола в нем до 95%.
Способ совместного производства аммиака и метанола, включающий в себя сероочистку, двухступенчатую конверсию метана, высокотемпературную конверсию оксида углерода, очистку газа от диоксида углерода абсорбцией горячим раствором поташа, синтез метанола под давлением 5 МПа и синтез аммиака под давлением 30 МПа, отличающийся тем, что очистку газа от диоксида углерода ведут непосредственно после высокотемпературной конверсии оксида углерода до остаточного содержания диоксида углерода 0,48 - 0,5 об.% с последующим синтезом метанола по проточной схеме на низкотемпературном медьсодержащем катализаторе (например ДН - 8 - 2) под давлением 5 МПа при температуре 200 - 300oС и при соотношении Н2 : СО = 22,5 : 1, после отделения метанола газ компримируют и направляют на синтез аммиака по циркуляционной схеме.

1. Необходимый расход аммиака на 5200 кг/ч НNO3, согласно уравнению
NH3 + 2O2 = HNO3 + H2O
составит:
17/63*5200 = 1403,17 кг/ч
2. Фактический расход аммиака при степени конверсии 97 % и степени поглощения окислов азота 98 % равен:
1403,17 /(0,97*0,98)= 1476,09 кг/ч
3. Мольный расход аммиака . составит:
1476,09 /17=86,83 моль/ч
4. Определяем часовой расход воздуха при содержании 9,8 % аммиака в аммиачно-воздушной смеси:
5. Приняв, что воздух содержит 21% кислорода и 79% азота, определим количество поступающего кислорода:
799,18*0,21 = 167,83 моль или 167,83 *32 =5370,56 кг.
Количество других газов, поступающих с воздухом, в пересчете на азот составит:
799,18*0,79 =631,35 моль или 631,35 *28= 17677,8 кг/ч
Содержание паров воды в воздухе 4,3% (об.)
Следовательно, расход воды:
799,18*18*0,043=618,57 кг/ч
Состав газа после окисления аммиака в соответствии с принятой степенью конверсии 97 % рассчитываем в соответствии со следующими реакциями:
4NH3+5O2 = 4NO+6H2O
6. Определяем количество прореагировавшего кислорода:
7. Определяем количество непрореагировавшего кислорода:
5370,56 – 3961,89=1408,67 кг/ч
8. Определяем количество NO :
9. Определяем количество выделившейся воды: