Файл: Задание Опишите по плану строение атомов следующих элементов водород, кислород, фтор, фосфор, цинк.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 08.11.2023
Просмотров: 32
Скачиваний: 2
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Автономная некоммерческая организация профессионального образования
«Открытый социально-экономический колледж»
Практическое задание№3.
По предмету: Естествознание.
Выполнил: 1 курса ПСО СОО
Шулешкин Игорь Александрович
Задание 1. Опишите по плану строение атомов следующих элементов: водород, кислород, фтор, фосфор, цинк.
План описания строения атома: заряд ядра, количество протонов, количество нейтронов, количество электронов, общее число электронов в атоме, распределение электронов по уровням и подуровням (электронная и графические формулы).
Ответ:
Водород – первый элемент Периодической таблицы. Обозначение – H. Расположен в первом периоде, I группе, А подгруппе.
Относится к неметаллам. Заряд ядра равен 1. Атомный вес может варьироваться: 1, 2, 3, что связано с наличием изотопов дейтерия и трития.
Электронное строение атома водорода
В атоме водорода имеется положительно заряженное ядро (+1), 1 протон и один электрон. Поскольку водород имеет самое простейшее строение атома из всех элементов Периодической системы, он хорошо изучен. В 1913 году Нильс Бор предложил схему строения атома водорода, согласно которой положительно заряженное ядро находится в центре, а вокруг него по единственной орбитали движется электрон (рис. 1). В соответствии с этой схемой он вывел спектр излучения этого химического элемента. Который был позже доказан с помощью квантово-механических расчетов уравнения Шредингера (1925-1930 годы).
Электронная конфигурация атома водорода будет выглядеть следующим образом:
1s1.
Водород относится к семейству s-элементов. Энергетическая диаграмма атома водорода имеет вид:
Единственный электрон, который имеется у водорода является валентным, т.к. участвует в образовании химических связей. В результате взаимодействия водород может как терять электрон, т.е. являться его донором, так и принимать, т.е. быть акцептором. В этих случаях атом превращается либо в положительно, либо отрицательно заряженный ион (H
+/Н—):
H0 –e →H+;
H0 +e →H—.
Кислород – восьмой по счету элемент Периодической таблицы. Относится к неметаллам. Расположен во втором периоде VI группы A подгруппы.
Порядковый номер равен 8. Заряд ядра равен +8. Атомный вес – 15,999а.е.м. В природе встречаются три изотопа кислорода: 16O,17O и 18O, из которых наиболее распространенным является 16O (99,762 %).
Электронное строение атома кислорода
Атом кислорода имеет две оболочки, как и все элементы, расположенные во втором периоде. Номер группы –VI (халькогены) – свидетельствует о том, что на внешнем электронном уровне атома азота находится 6 валентных электронов. Обладает высокой окислительной способностью (выше только у фтора).
Электронная конфигурация основного состояния записывается следующим образом:
1s22s22p4.
Кислород – элемент p-семейства. Энергетическая диаграмма для валентных электронов в невозбужденном состоянии выглядит следующим образом:
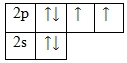
У кислорода есть 2 пары спаренных электронов и два неспаренных электрона. Во всех своих соединениях кислород проявляет валентность II.
Фтор – элемент, относящийся к группе галогенов. Неметалл. Расположен во втором периоде VII группы A подгруппы.
Порядковый номер равен 9. Заряд ядра равен +9. Атомный вес – 18,998 а.е.м. Это единственный стабильный нуклид фтора.
Электронное строение атома фтора
Атом фтора имеет две оболочки, как и все элементы, расположенные во втором периоде. Номер группы – VII (галогены) – свидетельствует о том, что на внешнем электронном уровне атома азота находится 7 валентных электронов и до завершения внешнего энергетического уровня не хватает всего одного электрона. Обладает самой высокой окислительной способностью среди всех элементов Периодической системы.
Электронная конфигурация основного состояния записывается следующим образом:
1s22s22p5.
Фтор – элемент p-семейства. Энергетическая диаграмма для валентных электронов в невозбужденном состоянии выглядит следующим образом:
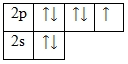
У фтора есть 3 пары спаренных электронов и один неспаренный электрон. Во всех своих соединениях фтор проявляет валентность I и степень окисления -1.
В результате взаимодействия фтор является акцептором электронов. В этом случае атом превращается в отрицательно заряженный ион (F—):
F0 +e →F—.
Фосфор расположен в третьем периоде V группы главной (А) подгруппы Периодической таблицы.
Относится к элементам p-семейства. Неметалл. Обозначение – P. Порядковый номер – 15. Относительная атомная масса – 30,974 а.е.м.
Электронное строение атома фосфора
Атом фосфора состоит из положительно заряженного ядра (+15), внутри которого есть 15 протонов и 16 нейтронов, а вокруг, по трем орбитам движутся 15 электронов.
Распределение электронов по орбиталям выглядит следующим образом:
+15 P)2)8)5;
1s22s22p63s23p3.
Внешний энергетический уровень атома фосфора содержит 5 электронов, которые являются валентными. Энергетическая диаграмма основного состояния принимает следующий вид:
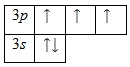
Каждый валентный электрон атома фосфора можно охарактеризовать набором из четырех квантовых чисел: n (главное квантовое), l (орбитальное), ml (магнитное) и s (спиновое):
| Подуровень | n | l | ml | s |
| s | 3 | 0 | 0 | +1/2 |
| s | 3 | 0 | 0 | -1/2 |
| p | 3 | 1 | -1 | +1/2 |
| p | 3 | 1 | 0 | +1/2 |
| p | 3 | 1 | 1 | +1/2 |
Наличие трех неспаренных электронов свидетельствует о том, что степень окисления фосфора равна +3. Так как на третьем уровне есть вакантные орбитали 3d-подуровня, то для атома фосфора характерно наличие возбужденного состояния:
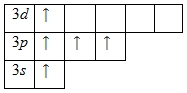
Именно поэтому для фосфора также характерна степень окисления +5.
Цинк — элемент четвертого периода II группы побочной (B) подгруппы Периодической таблицы.
Относится к элементам d — семейства. Металл. Обозначение – Zn. Порядковый номер – 30. Относительная атомная масса – 65,39 а.е.м.
Электронное строение атома цинка
Атом цинка состоит из положительно заряженного ядра (+30), внутри которого есть 30 протонов и 35 нейтронов, а вокруг, по четырем орбитам движутся 30 электронов.
Распределение электронов по орбиталям выглядит следующим образом:
+30 Zn)2)8)18)2;
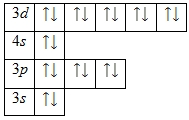
1s22s22p63s23p63d104s2.
Энергетическая диаграмма основного состояния принимает следующий вид:
Задание 2. Дайте определение понятию «изотопы». Укажите сколько протонов и нейтронов содержат ядра изотопов кислорода 16О, 17О, 18О.
Ответ: Изотопы – это те вещества, у которых атомы имеют одинаковое число протонов и электронов, а отличаются лишь числом нейтронов.
Протоны соответствуют номеру элемента, чтобы найти нейтроны от массы нужно отнять протоны или номер элемента
16О прот-8 нейтр 8
17О прот8 нейтр-9
18О прот-8 нейтр-10
Задание 3. Разделите вещества на простые и сложные: SO2 K, Cu, N2, O2 , Cl2, LiI, Al2O3 , H 2 , Br2 , NaCl, MgSO4 , KOH, Fe, Au, Ag, ZnO, KF, Cr, SO3
Ответ:
| Простые вещества | K, Cu, N2, O2, Cl2, H2, Br2, Fe, Au, Ag,, Cr |
| Сложные вещества | LiI, Al2O3,NaCl, MgSO4 , KOH, ZnO, KF, SO3 |
Задание 4.
1) В каком случае идёт речь о железе как о химическом элементе?
А) В состав сульфида железа входит один атом железа.
Б) Железо входит с состав ржавчины;
В) Для железа характерен металлический блеск;
Г) Железо - это металл, который притягивается магнитом;
Ответ: А, Б.
2) В каком случае идёт речь о кислороде как о простом веществе?
А) Кислород - это газ, поддерживает дыхание и горение;
Б) Рыбы дышат кислородом
, растворённым в воде;
В) Атом кислород входит в состав молекулы воды;
Г) Кислород входит в состав воздуха.
Ответ: А